Журнал «Здоровье ребенка» 6 (27) 2010
Вернуться к номеру
Опсонирующая сеть протеинов системы неспецифической защиты респираторного тракта Коллектины: маннозосвязывающий лектин, фиколины
Авторы: Абатуров А.Е., Днепропетровская государственная медицинская академия
Рубрики: Педиатрия/Неонатология
Версия для печати
В обзоре представлены современные данные о роли MBL, фиколинов в защите респираторного тракта человека от инфекционных агентов. Данные протеины, взаимодействуя с внешней мембраной бактерий, грибов и поверхностных гликопротеинов вирусов, без участия антител активируют систему комплемента, вызывающую осмолизис инфекционных агентов.
Введение
Коллектины (маннан- или маннозосвязывающие протеины) играют одну из основных ролей как в системе молекулярной неспецифической защиты респираторного тракта, так и в процессах распознавания РАМР инфекционных агентов и регуляции иммунного ответа [17, 35, 58, 63, 82].
Семейство коллектинов относится к семейству collagen-like-lectin и включает в себя маннозосвязывающий лектин (MBL), белки сурфактанта A (SP-A) и D (SP-D), конглютинин, печеночный коллектин 1 (CL-L1), плацентарный коллектин 1 (CL-P1), коллектин 43 кДа (CL-43) и коллектин 46 кДа (CL-46). Молекулы данных протеинов содержат коллагеноподобный терминальный N-домен и лектиновый (C-типа) лиганд-распознающий терминальный С-домен (область рекогниции углеводородов — CRD), связанные альфа-спиральным «coiled-coil neck» регионом. К семейству коллагеноподобных белков также относятся пулланаза (бактериальный фермент), рецепторы макрофагов I и II типов и, несмотря на отличия в молекулярном строении, фиколины [17–19, 32, 66, 86]. Показано, что нарушения продукции фиколинов могут играть критическую роль в патогенезе различных заболеваний: 1) инфекционно-воспалительных; 2) аутоиммунных (системной красной волчанки); 3) нефропaтии IgA и других [88].
Краткая характеристика MBL и фиколинов
Из представителей суперсемейства коллектинов наиболее выраженная экспрессия в респираторном тракте характерна для MBL, фиколинов, SP-A, SP-D (табл. 1). Основными опсонирующими белками респираторного секрета являются MBL и фиколины. MBL и фиколины в результате рекогниции N-ацетилглюкозамина и манноз липополисахаридов внешней мембраны бактерий, грибов и поверхностных гликопротеинов вирусов без участия антител активируют систему комплемента, вызывающую осмолизис инфекционных агентов [24, 34, 61, 73, 82, 87]. Особую роль в неспецифической защите респираторного тракта протеин MBL играет у детей в возрасте от 6 до 18 месяцев [54, 80].
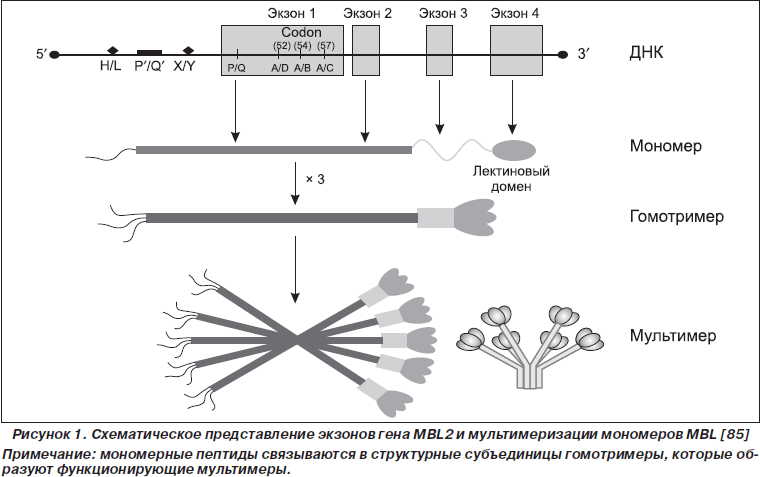
Молекула мономера MBL, как и других коллектинов, состоит из коллагеноподобного N- и лектинового C-терминального доменов. C-терминальный домен способен связываться со специфическими поверхностными олигосахаридами различных микроорганизмов [64, 79]. Олигомеризация мономеров приводит к образованию гомотримеров, которые в последующем образуют мультимеры (рис. 1, 2) [69, 80, 85].

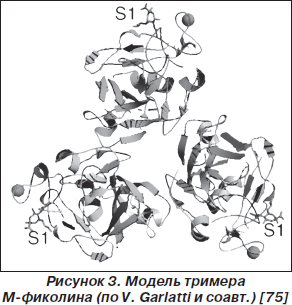
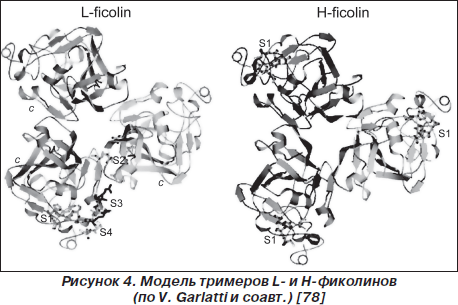
Субсемейство фиколинов представлено M-фиколином, L-фиколином, H-фиколином (рис. 3, 4). Молекулы различных фиколинов подобны на 48–54 % [14, 66, 67]. H-фиколин представляет собой часть последовательности термолабильного b2-макрогликопротеина [13, 75]. В респираторном тракте обнаруживаются все три представителя данного протеинового субсемейства [4, 33, 52, 66].
Синтез MBL осуществляется макрофагами, преимущественно в печени. Показано, что H-фиколин в респираторном тракте синтезируется реснитчатым эпителием и альвеолоцитами II типа [13, 33]. М-фиколин продуцируется альвеолоцитами II типа, нейтрофилами и моноцитами [27, 39]. Гены, кодирующие фиколины, расположены на разных хромосомах: М-фиколина — на хромосоме 9 (9q34), L-фиколина — на хромосоме 9 (9q34.3), H-фиколина — на хромосоме 1 (1p36.11) [52].
Среднее содержание MBL, L-фиколина и H-фиколина в сыворотке крови здоровых людей составляет 0,76, 3,3, 18,4 мкг/мл соответственно [23].
Механизм действия MBL и фиколинов
Противоинфекционное действие MBL и фиколинов
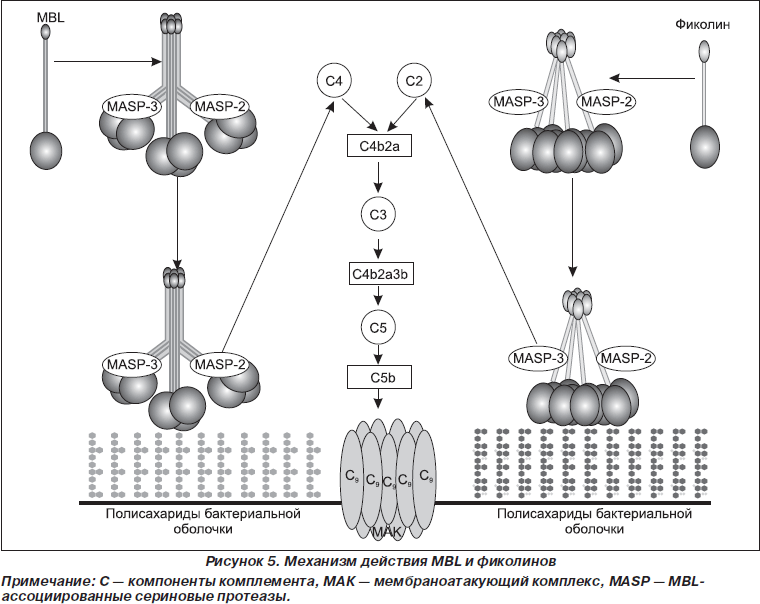
В биологических средах молекулы MBL, фиколинов комплексируются с MBL-ассоциированными сериновыми протеазами (MBL-associated serine proteases) — MASP1, MASP2, MASP3 и с неферментативным белком MAp19 (неферментативная редуцированная форма MASP-2) (рис. 4). Молекулы представителей семейства MASP состоят из шести доменов — двух C1r/C1s/Uegf/bone морфогенетических протеиновых (CUB) доменов, EGF (эпидермальный фактор роста) подобного домена, двух комплемент-контролирующих протеиновых (CCP) доменов и домена сериновой протеазы. CUB и EGF-подобный домены участвуют в ассоциации молекул MASP с MBL, фиколинами [12, 60]. Комплексы MBL/MASP и фиколин/MASP обладают выраженной протеолитической активностью по отношению как к С4- и С2-компонентам классического пути, так и к С3-компоненту альтернативного пути активации комплемента [1, 6, 11, 16, 30, 39, 53, 57].
MBL C-терминальным доменом селективно распознает маннозу, N-ацетилглюкозамин, а L-, M-фиколины — N-ацетилглюкозамин, липотейхоевую кислоту бактерий и 1,3-b-D-гликан грибов, что позволяет данным молекулам Са2+-зависимым способом прикрепляться к поверхности мембран микроорганизмов. Молекула H-фиколина не обладает выраженным аффинитетом к патоген-ассоциированным молекулярным структурам микроорганизмов. Были представлены доказательства о взаимодействии H-фиколина только с Aerococcus viridans [20, 38, 39, 48, 49]. Взаимодействие с инфекционными агентами обусловливает конформационные изменения мультимеров MBL и фиколинов, что приводит к расщеплению профермента MASP между вторым CCP и протеазным доменами. Таким образом, активируются сериновые протеазы, которые индуцируют лектиновый путь активации комплемента [9, 12, 31, 48, 49, 70].
Различают три пути активации комплемента — классический, лектиновый и альтернативный [28, 65, 84].
Все пути активации комплемента приводят к запуску сборки пороподобного мембраноатакующего комплекса. Классический путь активации комплемента инициализируется прикреплением комплекса C1 (C1q, C1r, C1s) к Fc-региону иммуноглобулинов, связанных с антигенами. Элементом рекогниции C1 является C1q. Функциональный C1q — это гетеротример, который состоит из продуктов трех генов: C1QA, C1QB и C1QC (g). Молекула гликопротеина C1q (460 000 kD) состоит из 18 полипептидных цепей: шести цепей C1qA (223 аминокислотных остатка), шести цепей C1qB (226 аминокислотных остатков) и шести цепей C1qC (g) (217 аминокислотных остатков) [36, 76].
C1q взаимодействует Fc-регионом молекул IgG, IgM иммунных комплексов, но не с Fc-регионом IgA, IgE, IgD [65].
Альтернативный путь индуцируется взаимодействием C3b с гидроксильными или аминогруппами поверхностных молекул инфекционных агентов.
Лектиновый путь активируется MASP. Предполагается, что лектиновый путь активации комплемента эволюционно старше классического и участвует в первой линии защиты макроорганизма от инфекционных агентов. Индуцированная MASP1 частично расщепляет C3 и C2, а MASP2 частично расщепляет C4 и C2, что приводит к формированию C3-конвертазы — C4b2a. При участии фактора D активная форма С3 отщепляет Ва от фактора В, формируя комплекс С3Bb, который обладает С3-конвертазной активностью. Проявлению активности комплекса С3Bb способствует и фактор Р, присоединяющийся к этому комплексу [1, 5, 16, 35, 47, 68, 70, 72]. С3-компонент взаимодействует с комплексами С4bC2a и С3bBbP, обусловливая формирование С5-конвертазы, которая способна расщеплять С5 на фрагменты С5b и С5а. При фиксации на поверхности клеточной мембраны С5-конвертазы С5b устойчиво связывается с С6-компонентом, образуя комплекс С5bС6, инициализируя сборку мембраноатакующего комплекса. В последующем к комплексу С5bС6 присоединяются молекулы С7 и С8. Завершающим этапом литического каскада является присоединение к комплексу 12–20 молекул С9, полимеризация которых приводит к образованию нерегулируемого ионного трансмембранного канала (рис. 5) [1, 3].
Показано, что MBL взаимодействует с различными инфекционными агентами — грамположительными и грамотрицательными бактериями, вирусами, грибами (табл. 2) [42, 43, 55]. Согласно данным A. Krarup и соавт. [23], MBL взаимодействует с некапсулированными формами грамположительных бактерий, в частности со Staphylococcus aureus. MBL не связывается со стрептококками группы В [50].
Представлены доказательства, что M-фиколин способен прикрепляться к поверхности мембран Staphylococcus aureus, L-фиколин — к поверхности мембран стрептококков, Salmonella typhimurium, B.subtilis, S.pyogenes, S.agalactiae, S.aureus, H-фиколин — к поверхности мембран стафилококков, Salmonella typhimurium, Escherichia coli с последующей активацией комплемента [38, 49, 71]. L-фиколин взаимодействует с серотипами III, V, VI, и VIII стрептококков группы В [50], связывается с капсулированными формами Staphylococcus aureus (серотипами 1, 8, 9, 11 и 12) и формами Streptococcus pneumoniae (серотипами 11A, 11D и 11F), но не взаимодействует с их некапсулированными формами [23]. По всей вероятности, такая селективность связана с особенностью строения полисахаридов бактериальных мембран. Так, известно, что полисахариды капсулированных форм стрептококков группы В могут содержать пять различных манноз. Наличие NeuNAc, глюкозы и галактозы характерно для полисахаридов всех девяти серотипов, а присутствие рамнозы специфично для полисахаридов VIII серотипа стрептококков группы В [77].
H-фиколин не связывается ни с одним из серотипов Streptococcus pneumoniae и Staphylococcus aureus, но закрепляется на поверхности Aerococcus viridans [23].
Y. Aoyagi и соавт. [71] предполагают, что L-фиколин-зависимый лектиновый путь активации комплемента является основным в предотвращении стрептококковой инфекции в периоде новорожденности вне зависимости от уровня концентрации антистрептококковых антител в сыворотке крови пациента.
Некоторые грамположительные кокки в течение эволюции приобрели механизмы, защищающие их от действия комплемента. В частности, b-гемолитический стрептококк группы А способен продуцировать обладающий беспрецедентной вариабельностью высокоиммуногенный внеклеточный белок 31-kDa — стрептококковый ингибитор комплемента (SIC), который также является важнейшим фактором вирулентности [22, 37]. SIC ингибирует лизис, предотвращая поглощение комплексов C5b67 мембранами клетки, по-видимому, блокируя мембранный участок C7 [74].
Влияние компонентов комплемента, MBL и фиколинов на иммунную систему
Компоненты комплемента C5a и C3a проявляют множество провоспалительных эффектов — усиливают хемотаксис лейкоцитов, продукцию активных радикалов кислорода, провоспалительных цитокинов, метаболитов арахидоновой кислоты, индуцируют дегрануляцию базофилов, эозинофилов, повышают сосудистую проницаемость [44, 45].
Сформированный C5a связывается с рецептором C5a на гранулоцитах и моноцитах, индуцируя экспрессию C3R — основного рецептора, который обусловливает фагоцитоз C3b-покрытых бактерий. Повышение экспрессии C3R усиливает процесс фагоцитоза бактерий и стимулирует дыхательный «взрыв» нейтрофилов [15].
MBL индуцирует фагоцитоз микроорганизмов, взаимодействуя с неизвестными до настоящего времени рецепторами [29].
L-фиколин усиливает процесс фагоцитоза Salmonella typhimurium [59]. М-фиколин способен связываться с ДНК апоптотических клеток, способствуя элиминации последних [26].
Состояния, сопровождающиеся дефицитом MBL
Люди с низким уровнем продукции MBL составляют 10–15 % среди белого населения [21].
Ген MBL находится на хромосоме 10 (q11.2-q21) и включает четыре экзона. В настоящее время идентифицировано семь полиморфизмов гена MBL, которые расположены в 1-м экзоне и промоторной области гена MBL2. В промоторной области мутации расположены в позиции –550G/C (H/L вариант), –221G/C (Y/X вариант), –70C/T, +4C/T (P/Q вариант) и в 5'-нетранслируемом регионе. Различают семь гаплотипов: HYPA, LYQA, LYPA, LXPA, LYPB, LYQC и HYPD. Гаплотип HY ассоциируется с высоким плазменным уровнем MBL, LY гаплотип — со средним, гаплотип LX связан со снижением концентрации белка MBL в плазме крови [2, 40, 41].
Три мутации расположены в 1-м экзоне гена MBL2 — в кодонах 52, позиции +223C/T (Arg52Cys); 54, позиции +230G/A (Gly54Asp) и 57, позиции +239G/A (Gly57Glu), которые кодируют N-терминальный домен белка и обозначаются как D, B и C соответственно. Замена глицина отрицательно заряженной аминокислотой, обусловленная мутациями в 54-м и 57-м кодонах, нарушает структуру a-спирали в коллагенподобном домене белковой цепи, препятствуя образованию гомотримера. Конформационные изменения MBL нарушают маннозный путь активации комплемента [2, 51]. Данные полиморфизмы объединены в О-генотип. Среди популяции белого населения гомозиготный генотип A/A (wildtype), характерный для здоровых людей с нормальным синтезом MBL, встречается в 57,6 % случаев; гетерозиготный генотип A/O — в 34,8 % (генотип A/D — в 11 %, генотип A/B — в 19,9 %, A/C — в 3,9 %); гомозиготный генотип O/O — в 7,6 % (B/B — в 2,1 %, B/C — в 2,1 %, B/D — в 2,5 %, D/D — в 0,9 %) [8, 41, 46, 56].
Дефицит MBL сопровождается сниженной резистентностью к респираторнотропным микроорганизмам, например к Streptococcus pneumonia [62]. Дефицит MBL сопровождается высоким риском развития пневмоний, отитов и сепсиса [83], склонностью к частым инфекциям и к затяжному течению инфекционно-воспалительных заболеваний [7, 25, 80].
Увеличение частоты острых респираторных заболеваний отмечено как у гомо-, так и у гетерозиготных детей, но у гомозиготных наблюдалось более тяжелое течение болезни [7].
Заключение
В защите респираторного тракта человека от инфекционных агентов важную роль играют опсонирующие протеины — MBL, фиколины, которые, взаимодействуя с внешней мембраной бактерий, грибов и поверхностных гликопротеинов вирусов, без участия антител активируют систему комплемента, вызывающую осмолизис инфекционных агентов. Уровень продукции MBL и, вероятно, фиколинов предопределяет процессы саногенеза инфекционно-воспалительных заболеваний респираторного тракта. Дальнейшие исследования позволят определить значение саногенетического вклада данных коллектинов в процесс выздоровления при различных конкретных заболеваниях органов дыхания. Внедрение в практику процедуры определения гаплотипа MBL2 позволит провести ранние мероприятия по модификации образа жизни, направленной на предупреждение развития инфекционных заболеваний.
Список литературы находится в редакции