Международный эндокринологический журнал 1 (33) 2011
Вернуться к номеру
Влияние заболеваний щитовидной железы на процесс клеточного старения
Авторы: Кадырова Д.А., Абдугафурова Д.Г., Якубова Р.А., Маматкулов Д.А., Институт биохимии АНРУз, г. Ташкент, Узбекистан
Рубрики: Эндокринология
Версия для печати
С возрастом секреторная функция щитовидной железы снижается. Снижение гормонообразования с возрастом, возможно, связано с нарушением регуляции экспрессии гена тиреоглобулина (ТГ) у людей пожилого возраста. По-видимому, нарушение регуляции экспрессии гена ТГ связано со структурно-функциональными изменениями хроматина. Проведено изучение структурно-функциональных изменений хроматина и роли различных модификаций в ДНК при старении (функциональная активность различных фракций ДНК, ДНКаза I-гиперчувствительность хроматина ядер). Установлено наличие прямой корреляции между степенью экспрессивности гена ТГ в тиреоидных клетках в процессе клеточного старения и ДНКаза I-гиперчувствительностью. Показано, что в процессе клеточного старения у людей старшей возрастной группы при узловом эутиреоидном зобе содержание ТГ-последовательностей во фракции ДНК I снижается в 2 раза. Клеточное старение сопровождается разнообразными хромосомными изменениями: нарушение числа хромосом, внутригрупповые вариации количества хромосом, структурные изменения хромосом. Хромосомная нестабильность при старении приводит к появлению большого числа клеток с различными количественными и структурными нарушениями, которые возникают при хромосомных аберрациях. Цитогенетическим анализом установлено, что при узловом эутиреоидном зобе у пациента в возрасте 75 лет наблюдаются хромосомные аберрации.
старение, ген тиреоглобулина, хромосомные аберрации, тиреоидная патология, ДНКаза I-гиперчувствительность.
Введение
Старение — многопричинный процесс, вызываемый многими факторами, действие которых повторяется и накапливается в течение всей жизни. Старение приводит к функциональной неполноценности клеток различного типа. Более того, глубокие возрастные изменения метаболизма, функции и структуры заканчиваются не только функциональной дефектностью клеток, но и в конечном итоге приводят к их гибели. Однако даже функционально однородные клетки стареют в неодинаковом темпе. Среди одного и того же класса клеток — нервных, мышечных, печеночных, эндокринных и др. — можно выделить клетки с грубыми нарушениями структуры и функции, с выраженными признаками гиперфункции, комплексом адаптационных реакций [1]. Так, во многих клетках отмечается уменьшение ядерно-цитоплазматического контраста; числа митохондрий, их набухание, нарушение репарации и репликации ДНК, уменьшение числа рибосом. Первичные механизмы старения связаны с нарушением генной регуляции. Ее изменения ведут к сдвигу соотношения разных белков, снижению потенциальных возможностей белоксинтезирующих систем. С возрастом в соматических клетках накапливаются не только мутации, но и хромосомные перестройки. Полагают, что изменения хроматина могут играть главную роль в связанных с возрастом изменениях регуляции генов [2]. В процессе старения центральное место занимает именно накопление генетических повреждений в клетке, в то время как иммунологические, гормональные и метаболические повреждения рассматриваются в качестве вспомогательных. Одной из причин накопления повреждений ДНК с возрастом может быть снижение эффективности систем репарации ДНК. Клеточное старение сопровождается разнообразными хромосомными изменениями: нарушение числа хромосом, внутригрупповые вариации количества хромосом, структурные изменения хромосом, появление маркерных хромосом-аберраций. Старение клеток, возможно, связано с появлением спонтанных хромосомных аберраций. Хромосомная нестабильность при старении приводит к появлению большого числа клеток с различными количественными и структурными нарушениями, которые возникают при хромосомных аберрациях [3]. Полагают, что изменения хроматина могут играть главную роль в связанных с возрастом изменениях регуляции экспрессии генов. При старении происходит нарушение процессов транскрипции и трансляции. Молекулярные события, определяющие транскрипцию, имеют решающее значение при изучении механизмов старения, поскольку регуляция экспрессии генов коренным образом влияет на старение и старческие изменения.
Цель работы: изучение структурно-функциональных нарушений хромосом и хромосомных аберраций, возникающих в клетках щитовидной железы (ЩЖ) при старении.
Материалы и методы исследований
Полирибосомы и ДНК выделяли из клеток ЩЖ и крови людей с различными формами тиреоидной патологии. Нами были созданы три возрастные группы людей без патологии ЩЖ и при некоторых формах тиреоидной патологии:
— 1-я группа — 10 человек в возрасте 45–55 лет;
— 2-я группа — 12 человек в возрасте 55–65 лет;
— 3-я группа — 8 человек в возрасте 65–75 лет.
Контрольная группа — 12 человек в возрасте 25 лет.
Для выделения суммарных полирибосом из клеток ЩЖ мы применили магниевый метод выделения полирибосом [4], с помощью которого удалось добиться их оптимального выхода. В основе метода лежит открытое Таканами [5] свойство полирибосом преципитировать из раствора под действием высоких концентраций магния. Суммарную РНК выделяли SDS-фенол-хлороформным методом. Выделение высокомолекулярной ДНК из лейкоцитов крови человека осуществляли методом фенольной экстракции [6]. Культивирование лимфоцитов проводили в среде для культивирования, состоящей (в расчете на 1 флакон) из: 6мл среды RPMI 1640 с глутамином («ПАНЭКО», Россия), 1 мл эмбриональной телячьей сыворотки (пр-во Франция— Германия), 40мкг/мл гентамицина и 20мкг/мл митогена — фитогемагглютинина (ФГА DifcоP), добавляли 0,8мл цельной крови. Препараты окрашивали 4% раствором Романовского — Гимза. Анализ проводили в стадии метафазы. Ядра из клеток ЩЖ выделяли осаждением в 0,25М сахарозе, содержащей 5мМ MgCl2, 1 мМ дитиотрейтола (ДТТ), 10 мМ трис-HCI pH7,5, и проводили очистку ядер путем наслоения на раствор 2М сахарозы в буфере Б (24 000 об/мин 1 час, ротор SW 27). Для определения ДНКаза-чувствительности обрабатывали ядра ДНКазой 1 (2000 Ед/мг Serva), инкубировали при 4°С в течение 5 мин с различными концентрациями ДНКазы I (от 0,1 до 100 Ед/мл) или с фиксированной концентрацией фермента (20 Ед/мл) при 37 °С в течение 15 мин. Выделение фракций ДНК из клеток крови проводили модифицированным фенольным методом, позволяющим выделить три фракции ДНК благодаря применению различных условий депротеинизации. Комплементарную ДНК для гена ТГ синтезировали методом полимеразной цепной реакции (ПЦР) на 0,5мкг суммарной РНК в присутствии обратной транскриптазы с применением праймеров, специфичных для гена ТГ: 51-AGGCTAGGAAAATGGCCCTGGTCC-31 и 51-TTGGATCCTTATGTGGGGGAATCTGCC-31. ПЦР проводили в инкубационной среде: 50 мкл содержали 60мМ трис-НС1 (рН 8,6), 6 мМ ЭДТА, 10 мМ b-меркаптоэтанола, 10мкг/мл ВСА, 1 мМ каждого из 4 нуклеотидов, 2 ед. обратной транскриптазы. ПЦР имела всего 55 циклов. Синтез проводили при 72 °С в течение 4мин. Последующие циклы включали денатурацию (1мин, 49°С), отжиг праймеров (1 мин, 55 °С), синтез кДНК (2 мин, 72 °С). После 55 циклов амплификации пробы выдерживали 10 мин при 72 °С и затем охлаждали, отбирали аликвоты, ставили электрофорез кДНК для гена ТГ в 1%-ном агарозе с бромистым этидием.
Результаты исследований и их обсуждение
С возрастом секреторная функция ЩЖ снижается. Снижение активности ЩЖ в онтогенезе выражается в уменьшении органификации йода и гормонообразования. Чувствительность гипоталамо-гипофизарного комплекса к ингибирующему воздействию трийодтиронина уменьшается, что способствует повышению уровня тиреотропного гормона (ТТГ) у здоровых людей в пожилом возрасте. Снижение гормонообразования с возрастом, возможно, связано с нарушением регуляции экспрессии гена ТГ у людей пожилого возраста. По-видимому, нарушение регуляции экспрессии гена ТГ связано со структурно-функциональными изменениями хроматина. Было проведено изучение структурно-функциональных изменений хроматина и роли различных модификаций в ДНК при старении (функциональная активность различных фракций ДНК, ДНКаза I-гиперчувствительность хроматина ядер). ДНКаза I-гиперчувствительные сайты локализованы во фланкирующих (51- или 31-) областях активных генов. Они отображают структурные вариации в хроматине, характер которых все еще не выяснен. Появление гиперчувствительных сайтов предшествует началу транскрипции и связано с транскрипционной активностью. Исходя из вышесказанного, представляло интерес изучить влияние различий в степени экспрессии гена ТГ при клеточном старении на структуру хроматина.
Проведено изучение ДНКаза I-гиперчувствительности хроматина клеток ЩЖ у пожилых людей при различной тиреоидной патологии. В качестве контроля были использованы пожилые люди без нарушений ЩЖ. В этом случае ядра выделяли из эпителиальных клеток слюны пациентов. Было исследовано 70 людей пожилого возраста. На рис. 1 приведены данные по ДНКаза I-гиперчувствительности хроматина ядер пожилых людей без патологии ЩЖ и при узловом эутиреоидном зобе (УЭЗ). Из приведенных данных видно, что существует прямая корреляция между степенью экспрессированности гена ТГ и ДНКаза I-гиперчувствительностью хроматина ядер ЩЖ пожилых при узловом эутиреоидном зобе,т.е. экспрессированные гены являются более чувствительными к ДНКазе, чем неактивные гены. Для понимания экспрессии гена ТГ важное значение имеет выяснение структурной организации функциональных свойств транскрипционно активных участков генома. Выяснение факторов, определяющих потенциально активное состояние гена ТГ, чрезвычайно важно для понимания молекулярных механизмов регуляции экспрессии данного гена в процессе клеточного старения [7].
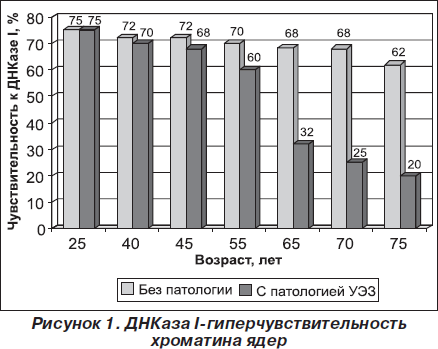
Из лейкоцитов крови людей без патологии ЩЖ и при узловом эутиреоидном зобе методом дифференциальной бездетергентной фенольно-солевой депротеинизации выделены три фракции ДНК: ДНК I, ДНК II, ДНК III. Фракция ДНК I охарактеризована как транскрипционно активная ДНК, фракция ДНК II представляет собой ДНК стабильно репрессированных участков генома, ДНКIII— потенциально активные участки генома.
Прямые доказательства функциональных различий ДНК I, ДНК II и ДНК III были получены при изучении содержания последовательностей гена ТГ во фракциях методом молекулярной гибридизации этих фракций с избытком 3Н ТГ кДНК. Методом ПЦР была синтезирована ТГ кДНК. Для синтеза кДНК для гена ТГ использовали как ДНК-полимеразу I, так и РНК-зависимую ДНК-полимеразу (ревертазу). Синтезированный препарат ТГ кДНК был использован нами в качестве зонда в экспериментах по гибридизации.
На рис. 2 приведены данные по гибридизации фракций с 3Н ТГ кДНК. В случае фракции ДНК I процент гибридизации в контроле (25 лет) составил 30 %, в то время как у людей в возрасте 55 лет при узловом эутиреоидном зобе этот показатель равен 26 %. Процент гибридизации фракции ДНК I с 3Н ТГ кДНК у людей в возрасте 65 и 75 лет составил 20 и 15 % соответственно. Таким образом, содержание последовательностей гена ТГ во фракции ДНК I при клеточном старении уменьшается в 2 раза по сравнению с контролем.
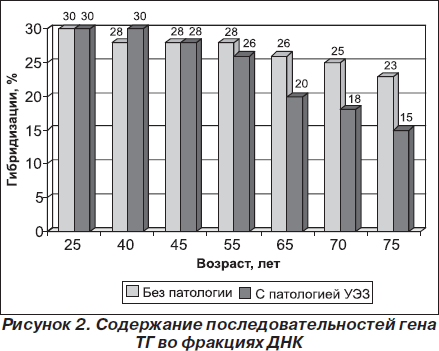
При гибридизации фракции ДНК III с 3Н ТГ кДНК гибридизуемость в контроле составила 23 %. У людей в возрасте 55, 65 и 70 лет процент гибридизации составил 18, 11 и 6 % соответственно. Содержание последовательностей гена ТГ во фракции ДНК III при клеточном старении уменьшается в 3,8 раза. При изучении содержания последовательностей гена ТГ во фракциях ДНК I, ДНК II и ДНК III у людей старшей возрастной группы без патологии ЩЖ различия в содержании последовательностей гена ТГ в этих фракциях было незначительно. На рис. 2 приведены данные по содержанию последовательностей гена ТГ во фракциях ДНК I и ДНК III.
Из приведенных данных видно, что фракция ДНК I более обогащена последовательностями гена ТГ в клетках ЩЖ в контроле, т.е. доказано, что фракция ДНК I является транскрипционно активной.
Для подтверждения полученных данных нами был проведен цитогенетический анализ хромосомных аберраций на стадии метафазы митоза лимфоцитов периферической крови у молодых людей (18 лет и 24 года) и людей в возрасте 54, 69 и 75 лет. В табл. 1 приведены данные по изучению хромосомных аберраций в лимфоцитах периферической крови людей разного возраста.
Необходимо отметить, что люди старшей возрастной группы были с патологией ЩЖ: 54 и 69 лет — с диффузным токсическим зобом и 75 лет — с узловым эутиреоидным зобом.
В данных культурах мы изучали уровень спонтанных хромосомных аберраций в клетках лимфоцитов периферической крови. Из табл. 1 видно, что на каждую культуру анализировали не менее 100 метафаз с хорошим разбросом хромосом. У пациентов в возрасте 50 лет общее число изученных метафаз составило 123 клетки, среди которых одна клетка с одним микрофрагментом (0,8 %); у пациентов в возрасте 69 лет общее число изученных метафаз составляло 111 клеток, и одна клетка — с парным фрагментом (0,9%). У пациента в возрасте 75 лет с узловым эутиреоидным зобом общее число изученных метафаз составило 156 клеток, из них 3 (1,92 %) — аберрантные клетки с парными фрагментами. Аберрантные клетки у данного пациента превышают количество аберрантных клеток в контроле (18 лет и 24 года).
Нами был проведен цитогенетический анализ хромосом клеток лимфоцитов периферической крови людей возрастной группы без патологии ЩЖ (59–75 лет). Цитогенетический анализ хромосом клеток лимфоцитов периферической крови в возрасте 75 лет без патологии ЩЖ выявил единичные асимметричные транслокации хромосом.
Известно, что структурные аберрации хромосом относятся к тому типу генетических нарушений, которые вносят свой вклад в многофакторный процесс старения. Нестабильные хромосомные аберрации — дицентрики, кольца, фрагменты — приводят к гибели клеток, стабильные — транслокации, инсерции — могут влиять на процесс клеточного старения. На основании полученных данных можно заключить, что независимо от патологии ЩЖ при старении наблюдаются различные хромосомные аберрации.
Выводы
1. Установлено наличие прямой корреляции между степенью экспрессированности гена ТГ в тиреоидных клетках в процессе клеточного старения и ДНКаза I-гиперчувствительностью.
2. Показано, что в процессе клеточного старения у людей старшей возрастной группы при узловом эутиреоидном зобе содержание ТГ-последовательностей во фракции ДНК I снижается в 2 раза.
3. Установлено, что при узловом эутиреоидном зобе у пациента в возрасте 75 лет наблюдаются небольшие хромосомные аберрации.
4. Показано, что у пациентов в возрасте 75 лет без патологии щитовидной железы наблюдаются единичные асимметричные транслокации хромосом.
1. Recves D. Molecular mechanisms of aging // Experim. Cell. Researh. — 1998. — Vol. 185. — P. 277-283.
2. Recves D. Trancriptionally active chromatin // Biochem. Biophys. Acta. — 1999. — Vol. 782. — P. 343-393.
3. Sanchez-Cespedes M., Monzo M., Rosell R. et al. Detection of chromosome 3p alterations in serum DNA of non-small-cell lung cancer patients // Ann Oncol. — 1998. — № 9. — P. 113-116.
4. Лейтин В.Л., Лерман М.И. Изучение полирибосом из клеток печени крыс. Препаративный метод получения полирибосом // Биохимия. — 1969. — Т. 34. — С. 839-841.
5. Takanami M. Stable ribonucleoprotein for amino acid incorporation // Biochim. Biophys. Acta. — 1960. — Vol. 39. — P.318-322.
6. Дашкевич В.С., Аршинова Т.В. Выделение фракций реплицирующейся ДНК печени крыс бездетергентным фенольным методом // Биология. — 1963. — Вып. 43, т. 15. — С. 133-136.