Международный эндокринологический журнал 1 (33) 2011
Вернуться к номеру
Оценка значимости внешних и внутренних факторов риска развития остеопороза
Авторы: Мищенко E.Б., Государственное образовательное учреждение высшего профессионального образования «Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию», государственное учреждение «Научно-исследовательский институт экспериментальной медицины Российской академии медицинских наук»
Рубрики: Эндокринология
Версия для печати
Введение
Остеопороз (ОП) — системное заболевание скелета, основными признаками которого являются снижение костной массы и нарушение микроархитектоники костной ткани, ведущие к увеличению риска переломов. В развитых странах с увеличением продолжительности жизни ОП становится наряду с сердечно-сосудистыми и онкологическими заболеваниями одной из главных причин потери здоровья и смерти как женщин, так и мужчин.
Прочность кости зависит от минеральной плотности костной ткани (МПКТ) и качества кости. Процессы костеобразования и резорбции регулируются местными (цитокины и факторы роста) и системными (гормоны) факторами. Нарушение взаимодействия указанных факторов ведет к недостаточной пиковой костной массе, более высокой скорости ремоделирования и возрастной потере минеральной плотности кости [1].
Результаты семейных и близнецовых исследований свидетельствуют о том, что ОП является классическим мультифакториальным заболеванием, генетическая составляющая которого формируется за счет взаимодействия многих генов [2]. В качестве маркеров ОП изучено большое число генов, детерминирующих МПКТ и качество кости. Было показано, что мутации генов: рецептора витамина D (VDR), a1-коллагена типа I (COLIA1), b-трансформирующего фактора роста (TGFB1), интерлейкина-6 (IL6), рецептора эстрогенов (ER1) и других, ассоциированы с ОП [3]. Они вызывают слабые нарушения экспрессии, которые могут компенсироваться или усиливаться под воздействием межгенных и экологических факторов [4].
Образ жизни играет важную роль в развитии ОП. Так, низкая физическая активность, особенности питания (недостаточное потребление кальция, дефицит витамина D, микроэлементов), курение и злоупотребление алкоголем являются факторами риска развития ОП [5]. Кроме того, на развитие ОП влияют возраст, конституциональные данные, сопутствующие заболевания, прием лекарственных препаратов.
Тотальный скрининг нарушений МПКТ не целесо-образен, поскольку он превысил бы в 2–10 раз затраты на лечение всех потенциальных остеопоротических переломов. Поэтому перспективны формирование групп риска и разработка профилактических мероприятий на основе анализа накопленных данных клинического, биохимического, рентгенологического и молекулярно-генетического обследований.
Целью исследования явилось изучение генетических маркеров остеопороза, роли минерального и гормонального статуса, а также особенностей образа жизни в развитии остеопороза.
Материалы и методы исследования
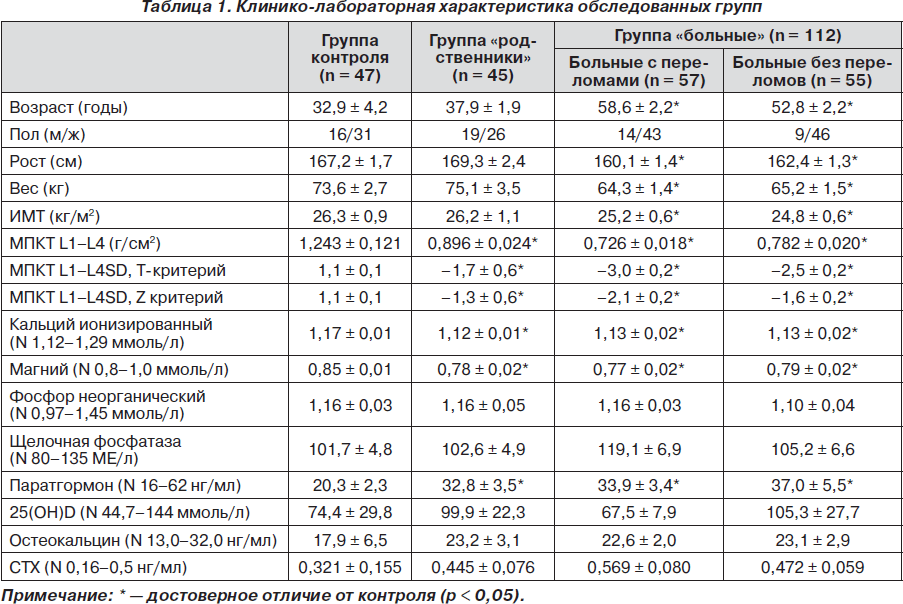
В ходе обследования сформирована группа «больные» (112 человек, средний возраст 54,1 ± 1,6 года — от 37 до 81 года) с диагнозом «первичный ОП» (86 человек, средний возраст 58,6 ± 3,8 года) или «остеопения» (26 человек, средний возраст 41,8 ± 6,4 года). По степени тяжести ОП группу «больные» разделили на две подгруппы: больные тяжелым ОП (57 человек, средний возраст 60,6 ± 2,2 года), имевшие переломы в анамнезе, и больные, не имевшие переломов (55 человек, средний возраст 48,8±2,2 года) (табл. 1).
Группу «родственники» составили кровные родственники, в основном дети (45 человек, средний возраст 37,9± 1,9 года — от 20 до 54 лет), больных тяжелым ОП. Всего обследовано 30 семей.
Группу контроля 1 при клинико-лабораторном обследовании составили 47 человек (средний возраст 32,9±4,2 года — от 24 до 48 лет) без анамнестических указаний на патологию костной ткани, проживающих в Северо-Западном регионе. В качестве контроля в генетическом исследовании были использованы 48 образцов ДНК лиц без упоминания в анамнезе о костной патологии, проживающих в Северо-Западном регионе (контрольная группа2). Для оценки влияния факторов образа жизни опрошены по тест-анкете 37 человек (средний возраст 54,3 ± 2,6 года— от 44 до 77 лет), не имеющих остеопенического синдрома (по данным денситометрии) (контрольная группа 3). Критерием исключения из исследования являлась сопутствующая патология, приводящая к развитию вторичного ОП.
Исследования минеральной плотности костной ткани поясничного отдела позвоночника были выполнены на двухэнергетическом рентгеновском денситометре QDR-4500/C (Hologic, США) на базе Санкт-Петербургского центра диагностики и лечения остеопороза (ЦМСЧ 122). Диагностику остеодефицитных состояний осуществляли согласно рекомендациям ВОЗ по Т-критерию. Рентгенологическое обследование проведено на аппарате Compact-Diagnost фирмы Phillips.
Концентрацию неорганического фосфора, кальция (ионизированного), магния и щелочной фосфатазы в сыворотке крови измеряли с помощью стандартных клинических методик. Содержание паратиреоидного гормона (ПТГ), 25-гидроксивитамина D (25(OН)D), остеокальцина и С-концевого телопептида коллагена I типа (CTX) в сыворотке крови определяли методом твердофазного иммуноферментного анализа с использованием коммерческих наборов (DSL, IDS и Nordic Bioscience). Концентрацию меди измеряли спектрофотометрически с использованием коммерческого набора (Randox). Содержание ЦП определяли методом количественного ракетного иммуноэлектpофоpеза. Оксидазную активность определяли по методу Pэвина. Собранные образцы сывороток предварительно хранили при –70 °С. Анализы проводили одновременно во всей коллекции.
Общеклиническое обследование пациентов проводилось с помощью разработанной автором тест-анкеты. Изучались анамнез заболевания, предшествующее лечение и его эффективность, продолжительность периода грудного вскармливания, продолжительность лактации, особенности питания, степень физической активности, наличие вредных привычек, сопутствующих заболеваний и приема препаратов, профессия, степень трудоспособности, условия жизни больных. Всего анкета состоит из 113 пунктов.
ДНК выделяли из лейкоцитов периферической крови экстракцией фенолом с хлороформом или гуанидин-изотиоцианатом. Полимеразную цепную реакцию (ПЦР) проводили в амплификаторе «Терцик» (г. Москва) при оптимально подобранных профилях реакции амплификации с использованием специфических праймеров. ПЦР-продукты анализировали методом полиморфизма длин рестрикционных фрагментов, подвергая гидролизу эндонуклеазами: VDR — PсtI (BsmI), ApaI, TaqI и FokI; COLIA1 — Msp20I; TGFB1 — FokI; ER1 - XbaI (СибЭнзим). Анализ рестрикционных фрагментов и вариабельного числа тандемных повторов гена IL6 осуществляли методом электрофореза в агарозном или полиакриламидном носителе.
Статистическая обработка показателей осуществлялась с помощью программы Statistica 6.0 на персональном компьютере. Для сравнения количественных показателей между группами использовался комплекс непараметрических критериев (критерий Манна — Уитни, медианный тест и критерий Крускала — Уоллиса модуля ANOVA). Различия считались достоверными, если вероятность (р) была меньше 0,05. Для оценки зависимости использовали однофакторный дисперсионный анализ. Для расчета частоты выявляемых изменений применялся точный метод Фишера, достоверность различий между группами проверяли с помощью коэффициента согласия Хи-квадрат. В случае наличия достоверных отличий использовали коэффициент соотношения шансов (odds ratio — OR), вычисленный с помощью специальной компьютерной программы для эпидемиологических исследований PEPI v. 4.0. Сравнение проводили с группой контроля, сопоставимой по возрасту и полу с обследуемой. Относительный риск развития ОП, связанный с генетическими факторами, приводится в сравнении с популяционной группой и может считаться заниженным.
Результаты исследования и их обсуждение
Минеральная плотность костной ткани
Исследование поясничного отдела позвоночника проведено для всех групп пациентов. У 62,2 % родственников больных выявлено снижение МПКТ, причем у 7 пациентов (средний возраст 40,6 ± 7,6 года) впервые выявлен ОП, и у 21 пациента (средний возраст 35,7 ± 6,6 года) — остеопения. В контрольной группе остеопения выявлена в 14,9 % случаев (p < 0,05), причем ОП выявлен не был. В среднем в группе родственников абсолютные значения МПКТ снижены на 11,7 % по сравнению с контрольной группой (табл. 1). Кровные родственники больных остеопорозом имеют высокий риск развития остеопенического синдрома (OR = 9,4, DI 3,2 ¸ 29,9).
Минеральный гомеостаз
Электролиты сыворотки крови
У 89 % родственников больных ОП (40 человек) выявлено отклонение концентрации электролитов сыворотки крови от нормы, в контрольной группе — у 48,9 % (р < 0,05). Гипомагниемия наблюдалась у 51,1 %, гипокальциемия — у 40,0 %, гипофосфатемия — у 31,1 % родственников.
У 17,8 % родственников больных ОП выявлен повышенный уровень фосфора, при этом не наблюдалось ни одного случая повышенного содержания кальция или магния. В группе «больные» выявлено снижение уровня электролитов крови: кальция — у 43,8 %, магния — у 49,1% и фосфора — у 25,9 % больных. Средние показатели концентрации кальция и магния у больных и у родственников были достоверно ниже контрольных (табл. 1).
Выявлена прямая корреляционная связь между абсолютным значением МПКТ и уровнем магния (r =+0,64, p < 0,05), а также МПКТ и уровнем кальция (r = +0,42, p< 0,05) сыворотки крови. Относительный риск развития ОП, связанный с гипокальциемией, составил 4,6 (OR=4,6, DI 1,4 ч 15,3), а с гипомагниемией — 12,9 (OR=12,9, DI 3,9 ч 44,6).
Паратгормон и витамин D сыворотки крови
Одним из основных компенсаторных механизмов гипокальциемии является повышение концентрации ПТГ, который мобилизует кальций из костной ткани, нормализуя его концентрацию в крови, но тем самым способствует развитию остеопении. В группе родственников уровень ПТГ был значимо выше, чем в группе контроля (32,2 ± 3,5 нг/мл и 20,3 ± 2,3 нг/мл соответственно, p=0,006).
С другой стороны, ПТГ стимулирует активность 1a-гидроксилазы в почках, повышая тем самым выработку 1,25(ОН)2D из 25(ОН)D и всасывание кальция в кишечнике. В нашей группе родственников больных остеопорозом выявлена отрицательная корреляция между уровнем ПТГ и 25(ОН)D в сыворотке крови (r = –0,42, p < 0,01).
Влияние факторов образа жизни на минеральный гомеостаз
Причиной гипокальциемии может являться недостаточное поступление кальция и витамина D с пищей. По подсчетам, выполненным на основе опроса родственников, более чем у половины из них (51,1 %) суточное потребление кальция не превышало 600 мг против рекомендуемых 1000 мг. В группе больных недостаточное поступление кальция отмечено у 47,3 %, в контрольной группе 3 — у 24,3 % обследованных (p < 0,05). Относительный риск развития ОП, связанный с низким поступлением кальция, составил 2,8 (OR = 2,8, DI 1,2 ч 7,3).
Среди больных идиопатическим ОП преобладали курящие больные (54,1 %) по сравнению с группами больных постменопаузальным (38 человек, средний возраст 59,0 ± 1,0 года), сенильным (24 человека, средний возраст 71,5 ± 0,8 года) ОП (7,8 и 12,5 % соответственно, р <0,05). Отличия от контрольных групп 1 (27,7 % курящих) и 3 (21,6 % курящих) носили недостоверный характер. Достоверных отличий по употреблению алкоголя, кофе и крепкого чая также получено не было.
В группе больных с переломами низкий уровень физической активности (менее 2 часов в неделю) на протяжении всей жизни выявлен у 38,6 % по сравнению с 20,0% (р < 0,05) у больных без переломов. Среди родственников больных в 42,2 % случаев отсутствовала регулярная дополнительная мышечная нагрузка (спортивные клубы, секции и т.п.), а в контрольной группе № 1 — в 19,1 %. Относительный риск развития ОП, связанный с низкой физической активностью, составил 3,4 (OR = 3,4, DI 1,1 ч 14,4).
При сравнении антропометрических данных пациентов с ОП и данных контрольной группы 3 нами выявлены более низкие показатели роста (р < 0,05), веса (р<0,05) и ИМТ (р < 0,05) у больных.
Костное ремоделирование
У значительной части больных ОП и их родственников выявлен высокий уровень костного ремоделирования, о чем свидетельствует превышение нормы показателей костеобразования (остеокальцин) и резорбции (CTX). CTX сыворотки крови повышен более чем у 30% родственников и больных, что достоверно отличается от контрольной группы № 1 (17,0 %). Относительный риск ОП у родственников, связанный с высоким уровнем CTX, составил 6,1 (OR = 6,1, DI 2,1 ч 21,5). В группах родственников и больных выявлена положительная корреляция между уровнями остеокальцина и CTX в сыворотке крови (r = +0,56, p < 0,01, и r = +0,63, p < 0,05 соответственно). Это может свидетельствовать о преобладании у этих пациентов процессов резорбции на фоне ускоренного костного метаболизма.
Дефицит эстрогенов ускоряет костное ремоделирование с преобладанием резорбции и является главной причиной постменопаузального ОП. Среди обследованных в менопаузе находились 36 женщин, больных тяжелым ОП (длительность менопаузы 17,5 ± 1,5 года), 26 женщин, не имевших переломов (длительность менопаузы 12,8 ± 2,3 года), и 27 женщин в контрольной группе 3 (длительность менопаузы 7,2 ± 1,2 года). Длительность менопаузы в этих группах значимо различалась (p < 0,05), причем у больных ОП она отрицательно коррелировала с МПКТ (r= –0,46, p < 0,001). Длительность менопаузы более 5 лет увеличивает относительный риск развития постменопаузального ОП в 5,4 раза (OR = 5,4, DI 1,8 ч 16,5).
Потерю МПКТ могут ускорять процессы, требующие мобилизации кальция из костной ткани, как, например, длительная лактация. В контрольной группе 3 суммарная продолжительность лактации была значимо меньше, чем у больных женщин (9,5 ± 2,5 мес. и 15,5 ± 2,3 мес. соответственно, р < 0,05). У женщин группы родственников средняя суммарная продолжительность лактации составила 13,5 ± 2,7 мес. Выявлена отрицательная корреляция длительности лактации и МПКТ (r = –0,2, p < 0,05). Относительный риск развития ОП, связанный с длительностью лактации более 18 месяцев, составил 2,8 (OR = 2,8, DI 1,1 ч 8,5).
Значимых различий в продолжительности репродуктивного периода, количестве беременностей и родов получено не было.
Процесс костного формирования определяется образованием компонентов костного матрикса. Ведущую роль в формировании коллагена играет лизилоксидаза, медьсодержащий гликопротеин. Ионы меди, как кофакторы купроэнзимов, являются обязательными компонентами клеток, но в то же время могут индуцировать образование гидроксильных радикалов, что приводит к разрушению всех типов биомолекул. Безопасный перенос меди осуществляет система транспортных белков. Дефицит этих белков может быть причиной нарушения ремоделирования костной ткани. Основываясь на этих соображениях, в обследуемой группе нами был определен статус меди, в качестве критерия которого был избран церулоплазмин (ЦП), основной медьсодержащий гликопротеин сыворотки крови (содержит 99 % внеклеточной меди) и донор ионов меди для клеток негепатоцитарных рядов.
В группе больных ОП выявлено недостоверное повышение уровня белка ЦП в сыворотке крови и снижение оксидазной активности по сравнению с контрольной группой. Однако снижение удельной активности ЦП в группе больных оказалось достоверным (p < 0,05). Содержание меди коррелировало с уровнем оксидазного ЦП. У больных с низкой (< 25 ед. акт) энзиматической активностью ЦП (n = 24, средний возраст 49,8 ± 6,9 года) уровень маркера костеобразования (остеокальцин сыворотки крови) оказался ниже (16,2 ± 4,1 нг/мл), чем в общей группе больных (22,7 ± 1,7 нг/мл, р < 0,05). Анализ изменения показателей статуса меди в семьях больных выявил семью (3 чел.), члены которой имеют остеопороз/остеопению и низкие уровни ЦП и оксидазной активности. При генетическом обследовании маркеров ОП у этих пациентов не выявлено.
Полученные данные с осторожностью позволяют предположить, что выявленное снижение уровня костного формирования у определенной группы больных потенциально может быть ассоциировано с нарушением обмена меди. Для проверки этого предположения планируется изучить активность медьтранспортных генов у пациентов группы с измененным статусом меди.
Генетическое обследование пациентов
Витамин D регулирует гомеостаз кальция посредством рецептора витамина D (VDR). В исследовании определены четыре общих полиморфизма гена VDR. Это полиморфизмы сайтов узнавания эндонуклеаз BsmI и ApaI в интроне 8, TaqI (T1055-C) в экзоне 9 и FokI (T2-C) второго экзона.
Полиморфизм BsmI, ApaI, TaqI гена VDR
У обследуемой группы пациентов были выявлены три гаплотипа из восьми возможных: baT, BAt и bAT (строчная буква означает наличие соответствующего сайта рестрикции в амплифицированном фрагменте ДНК). При этом были обнаружены все шесть возможных генотипов. В семьях больных ОП частота генотипа BAtBAt, ассоциированного по многим данным (Gennari et al., 1998; Langdahl et al., 2000; Harvey et al., 2003) с ОП, составила 24,0 %, в группе родственников — 20,0 %, в группе «больные» — 21,4 %, что значимо не отличалось от контрольной группы (18,8 %).
Интересно, что среди больных женщин встречаемость генотипа BAtBAt составила 25,8 % и была выше, чем у больных мужчин (4,3 %, p > 0,05).
Выявлена достоверная зависимость концентрации кальция (p = 0,001) и щелочной фосфатазы (p = 0,027) сыворотки крови от генотипа VDR. Носители генотипов BAtBAt и bATbAT имели наименьшие значения уровня кальция (1,11 ± 0,02 и 0,87 ± 0,19 ммоль/л соответственно) и наибольшие щелочной фосфатазы (128,1± 9,9 и 206,5±99,5 МЕ/л соответственно). В группах с генотипами BAtBAt, BAtbAT и bATbAT отмечена достоверно низкая концентрация 25(OH)D в сыворотке крови (63,4±11,2, 59,6 ± 7,8 и 41,3 ± 11,4 ммоль/л соответственно) по сравнению с генотипом baTbaT (108,9 ± 34,6 ммоль/л, p < 0,05). Следует отметить, что наибольшее число параметров, отличных от нормы, имели двое носителей генотипа bATbAT, однако малочисленность выборки не позволяет сделать вывод об ассоциации этого генотипа VDR с ОП.
В шести семьях как у больных, так и у их родственников (всего 14 человек) выявлен дефицит витамина D в сыворотке крови. При этом среди членов этих семей частота ассоциированного с ОП гаплотипа BAt составила 50%, а генотипа BAtBAt, обнаруженного у представителей трех семей, — 35,7 %, что выше, чем в популяции и среди больных ОП. Несмотря на недостоверность отличий, связанных, возможно, с малочисленностью выборки, мы считаем, что изменение рецептора витамина D может являться фактором предрасположенности к ОП у лиц со сниженным уровнем 25(OH)D в сыворотке крови.
В группе больных тяжелым ОП у 6 из 12 носителей генотипа BAtBAt VDR одновременно выявлено наличие аллели s гена COLIA1, также ассоциированного с ОП. В контрольной группе это сочетание наблюдалось лишь у 1 из 9 носителей генотипа BAtBAt. Результаты хорошо согласуются с данными других исследований (Brown et al., 2001; McClean et al., 2003), свидетельствующих о развитии тяжелых форм ОП в случаях сочетания генотипов «риска» VDR с определенными аллельными вариантами других маркерных генов ОП.
Полиморфизм FokI гена VDR
При анализе полиморфизма стартового кодона во втором экзоне гена VDR (выявляется эндонуклеазой FokI) у обследуемой группы пациентов были выявлены генотипы FF, Ff, ff. Данные об ассоциации FokI полиморфизма VDR с ОП носят противоречивый характер (Gross et al., 1996; Langdahl et al., 2000; Алексеева и др., 2005). В нашей выборке в группе «больные», в семьях больных ОП, в группе «родственники» и в контрольной группе распределение генотипов FokI VDR значимо не отличалось. Встречаемость генотипов у больных мужчин и женщин также не различалась. В то же время в группе больных тяжелым ОП частота аллели F (64,0 %) и генотипа FF VDR (38,6 %) достоверно отличалась от контрольной группы (50,0 и 18,8 % соответственно, р < 0,05).
Среди пациентов с МПКТ ниже 0,75 г/см2 (n = 68) частота генотипа FF составила 41,2 %, что достоверно отличалось от пациентов с МПКТ больше 0,75 г/см2 (n=44) (22,7 %, р < 0,05). При анализе средних показателей МПКТ поясничного отдела позвоночника выявлена зависимость T-критерия от генотипа (p = 0,045). Причем наименьшие значения Т-критерия (–3,1 ± 0,3) выявлены у пациентов с FF-генотипом VDR. У носителей FF-генотипа VDR повышен риск развития тяжелого ОП (OR= 2,7, DI 1,1ч7,6), что может быть связано у них с наиболее низкими значениями МПКТ.
Меньшая эффективность рецептора витамина D может сказываться при снижении уровня кишечной всасываемости кальция, что неизбежно имеет место в старшей возрастной группе. Действительно, среди больных сенильной формой ОП (24 человека, средний возраст 71,5±0,8 года) частота генотипа BAtBAt (равно как и генотипа FF) VDR оказалась более чем вдвое выше популяционной (41,7 и 18,8 % соответственно, p < 0,05). Наличие BAtBAt- или FF-генотипа VDR увеличивает относительный риск развития сенильного ОП более чем в 3 раза (OR = 3,1, DI 1,0 ч 10,5).
Полиморфизм Msp20I гена COLIA1
Коллаген I типа, составляющий 90 % органического матрикса кости, кодируется генами COLIA1 и COLIA2, которые отвечают за регуляцию метаболизма коллагена и массу костной ткани. В работе определялся G/T-полиморфизм в сайте связывания транскрипционного фактора Sp1 в первом интроне гена COLIA1.
В гене COLIA1 в обследуемых группах пациентов были выявлены три возможных генотипа — SS, Ss и ss (строчная буква означает наличие сайта рестрикции эндонуклеазы Msp20I в амплифицированном фрагменте ДНК). Частота нормальной аллели S в группе «больные» составила 77,7%, в группе «родственники»— 78,9 %, среди семей больных — 72,6 %, причем последняя была значимо ниже, чем в группе контроля (83,4 %, p < 0,05).
Частота гомозиготного генотипа ss составила в группе «больные» 11,6 %, среди родственников — 13,3 %, а в семьях — 14,6 %, что более чем в 3 раза превышает частоту этого генотипа в контрольной группе (4,2 %, p > 0,05).
Большинство показателей минерального обмена в группах с различными генотипами COLIA1 соответствовали пограничным значениям нормы и значимо не различались. Нами выявлена достоверная зависимость концентрации фосфора крови (p = 0,006) от генотипа гена COLIA1, причем наибольшие показатели (1,34±1,18ммоль/л) обнаружены у больных с ss-генотипом. Имеются данные (Mann et al., 2001) о повышенной скорости потери МПКТ у пациентов с s-аллелью в условиях дефицита алиментарного кальция (косвенным показателем которого может быть повышенная концентрация фосфора в сыворотке крови).
При анализе показателей МПКТ поясничного отдела позвоночника не обнаружено их достоверной зависимости от генотипа COLIA1. Однако при клиническом обследовании родственников, имеющих ассоциированную с ОП аллель s гена COLIA1, в большинстве случаев было выявлено снижение МПКТ. Следует отметить, что заболевание было диагностировано впервые.
Данные об отсутствии связи полиморфизма Sp1 COLIA1 и минеральной плотности кости согласуются с результатами исследований последних лет (Mann et al., 2001; Pluijm et al., 2004), свидетельствующими скорее об изменении механической прочности кости независимо от МПКТ. Это заставило нас отдельно рассмотреть распределение генотипов и аллелей гена COLIA1 среди больных ОП с наличием переломов в анамнезе (тяжелый ОП, n = 57). Частота аллели s оказалась выше, чем в группе больных без переломов и в группе контроля (29,8, 14,5 и 16,5 % соответственно, р < 0,05). Установлена достоверная взаимосвязь наличия s-аллели гена COLIA1 с остеопоротическими переломами (c2 = 5,88, р = 0,015). Носительство s-аллели гена COLIА1 вне зависимости от уровня МПКТ увеличивает риск возникновения переломов в 2,1 раза (OR = 2,1, DI 1,1 ч 4,5).
Ассоциация s-аллели гена COLIA1 с риском переломов независимо от показателей МПКТ показана в случае его сочетания с определенными аллельными вариантами других генов. В нашей группе больных тяжелым ОП среди 25 носителей аллели s гена COLIA1 в шести случаях эти изменения сочетались с генотипом BAtBAt VDR. В то же время в контрольной группе это сочетание наблюдалось лишь у 1 из 14 носителей аллели s гена COLIA1.
Полиморфизм FokI гена TGFB1
Трансформирующий фактор роста-b1 (TGF-b1) — один из регуляторов баланса между процессами образования и резорбции костной ткани. Он стимулирует пролиферацию и дифференциацию остеобластов и подавляет костную резорбцию. В работе определялась однонуклеотидная замена в экзоне 5 (C788-Т) гена TGFB1. Были выявлены две аллели С и T (T означает наличие тимина, обеспечивающего сайт узнавания эндонуклеазы FokI в амплифицированном фрагменте ДНК). При этом были обнаружены два возможных генотипа — СС и СТ, гомозигот ТТ не обнаружено. Частота аллели T у больных, родственников и в контрольной группе составила 5,5–6,2 % и не имела достоверных отличий. Среди больных носителей T-аллели гена TGFB1 (n=7) уровень остеокальцина оказался ниже по сравнению с пациентами с СС-генотипом (20,7 ± 2,9 нг/мл и 23,1± ± 1,1 нг/мл соответственно, р <0,05). Уровень ПТГ также был ниже у носителей Т-аллели гена TGFB1 (27,9± ± 4,5нг/м и 38,1±3,7нг/мл, р < 0,05). Таким образом, однонуклеотидная замена C788-Т, приводящая к замене треонина на изолейцин в пропептиде, возможно, влияет на образование активного TGF-b1, что сказывается на скорости ремоделирования.
Полиморфизм 3’-фланкирующей области гена IL6
Интерлейкин-6 (IL-6) — цитокин плейотропного действия, участвующий в метаболизме костной ткани. Он активирует остеокласты, связываясь с их поверхностным рецептором, способствуя резорбции кости. При исследовании полиморфизма 3’-фланкирующей области гена IL6 были выявлены варианты, содержащие различное число АТ-богатых тандемных повторов. Частота короткого аллельного варианта «l» (размер ПЦР-продукта — 611 п.н.) у больных составила 71,4 % и не отличалась от контроля (75,0 %). При сравнении клинико-лабораторных характеристик больных с различными генотипами IL6 выявлена достоверная зависимость уровня магния (p = 0,049) сыворотки крови и ПТГ (p = 0,001) от генотипа, причем наибольшие значения уровня ПТГ (70,3 ± 18,5 нг/мл) и наименьшие значения концентрации магния (0,63 ± ±0,05ммоль/л) выявлены у носителей LL-генотипа IL6. У этих же пациентов наблюдается тенденция к снижению уровня кальция и витамина D сыворотки крови и МПКТ. Полученные данные свидетельствуют о нарушении минерального гомеостаза у носителей LL-генотипа IL6, что может способствовать нарушению минерализации кости.
Полиморфизм XbaI гена ER1
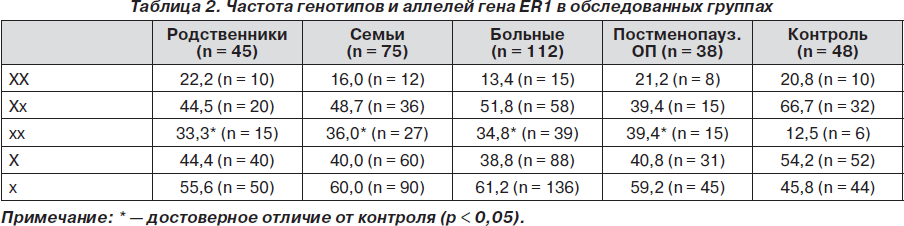
Действие эстрогенов на костную ткань осуществляется через эстрогеновые рецепторы и проявляется в замедлении процессов ремоделирования костной ткани, преимущественно резорбции. В исследовании проведен анализ полиморфизма длин рестрикционных фрагментов в первом интроне гена ER1, выявляемого рестриктазой XbaI. В гене ER1 в обследуемой группе пациентов выявлены генотипы ХХ, Хх и хх. Частота генотипа хх, ассоциированного с ОП, среди больных составила 34,8 %, в семьях — 36,0 %, у близких родственников больных — 33,3 %, в контрольной группе — 12,5 % (табл. 2). Причем отличия от контроля носили достоверный характер. Среди больных мужчин частота генотипа хх не отличалась от таковой у больных женщин.
Большинство показателей минерального обмена и МПКТ поясничного отдела позвоночника не обнаруживают зависимости от генотипа ER. Достоверная зависимость от генотипа ER1 выявлена лишь для концентрации фосфора крови (p = 0,002), причем наименьшие показатели (1,03± 0,03 ммоль/л), обнаруженные у больных с хх-генотипом, достоверно отличались от показателей пациентов с другими генотипами (1,21 ± 0,04 ммоль/л, p=0,001).
Среди больных постменопаузальным ОП частота генотипа хх возрастала до 39,5 % и достоверно отличалась от контрольной группы (12,5 %, c2 = 6,9, р < 0,05). Относительный риск развития ОП в постменопаузальном периоде возрастает более чем в 3 раза у носителей хх-генотипа ER1 (OR = 3,2, DI 1,1 ч 8,9).
При анализе результатов генетического обследования в группе «больные» выявлено преобладание пациентов, имеющих хотя бы один из выявленных маркеров ОП (78,6%), что достоверно отличалось от контрольной группы (50,0 %, c2 = 11,7, p = 0,001). Относительный риск развития ОП при этом составил 3,0 (OR =3,0, DI 1,6ч8,0). Одновременное носительство двух и более маркеров ОП среди больных и в контроле составило 37,5 и 12,5 % соответственно (c2 = 8,8, p = 0,003). Относительный риск развития ОП при этом составил 4,2 (OR = 4,2, DI 1,7 ч 11,6). Стоит отметить, что 26 из 42 носителей одновременно двух или трех генетических маркеров ОП имели в анамнезе остеопоротические переломы (тяжелый ОП).
Таким образом, родственники больных остеопорозом составляют группу высокого риска развития остеопороза, и выявление у них отрицательных прогностических факторов риска развития остеопороза (низкое поступление кальция с пищей, лактация более 18 мес., низкая физическая активность, длительность менопаузы более 5 лет) является показанием к выполнению денситометрии. Проведение биохимического обследования с оценкой уровня кальция, магния и фосфора в сыворотке крови, контроль кальций-регулирующих (витамин D, паратгормон) гормонов и маркеров ремоделирования (остеокальцин, CTX) позволят выявить у этой группы пациентов нарушение минерального и костного обмена на ранней стадии. Выявление генетических маркеров остеопороза может быть использовано при прогнозе развития заболевания и выборе профилактических мероприятий: s-аллель гена COLIA1 и FF-генотип VDR— факторы риска возникновения переломов; BAtBAt- и FF-генотип VDR — факторы риска развития сенильного остеопороза, хх-генотип — постменопаузального остеопороза.
Выводы
1. Кровные родственники больных остеопорозом имеют высокий риск развития остеопенического синдрома (OR = 9,4, DI 3,2 ч 29,9). Частота нарушения минерального гомеостаза и снижения МПКТ в группе родственников достоверно выше, чем в контроле. Гипокальциемия и гипомагниемия — факторы риска остеопороза (OR = 4,6, DI 1,4 ч 15,3, и OR = 12,9, DI 3,9 ч 44,6 соответственно).
2. Уровень паратгормона и маркеров костной резорбции у больных и их родственников значимо выше, чем в контрольной группе. Уровень паратгормона отрицательно коррелирует с уровнем 25(ОН)D в сыворотке крови, положительно коррелируют показатели костной резорбции (СТХ) и остеосинтеза (остеокальцин). Высокий уровень костной резорбции — фактор риска развития остеопороза (OR = 5,4, DI 1,8 ч 16,5).
3. Аллель s гена COLIA1 и FF-генотип VDR ассоциированы с остеопоротическими переломами, BAtBAt- и FF-генотип VDR — с сенильным, а хх-генотип ER1 — с постменопаузальным остеопорозом. Относительный риск развития остеопороза, связанный с носительством одного генетического маркера, составил 3,0 (DI 1,6 ч 8,0), а двух и более маркеров — 4,2 (DI 1,7 ч 11,6).
4. Значимыми факторами образа жизни в развитии остеопороза являются низкая физическая активность (OR = 3,4, DI 1,1 ч 14,4) и диета с низким содержанием кальция (OR = 2,8, DI 1,2 ч 7,3), для женщин значимыми являются менопауза более 5 лет (OR = 4,3, DI 1,6 ч 16,7) и лактация более 18 месяцев (OR = 2,8, DI 1,1 ч 8,5).
1. Kanis J.A., Burlet N., Cooper C. еt al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. — 2008.
2. National Institute for Health and Clinical Excellence (2007) Final appraisal determination. Alendronate, etidronate, risendronate, raloxifene and strontium ranelate for the primary prevention of osteoporotic fragility fractures in postmenopausal women. NICE, London.
3. Bagan J., Blade J., Cozar J.M. et al. Recommendations for the prevention, diagnosis, and treatment of osteonecrosis of the jaw (ONJ) in cancer patients treated with bisphosphonates // Med. Oral. Patol. Oral. Cir. Bucal. — 2007. — Vol. 12, № 4. — P. 336-340.
4. Burr D.B. Summary of ASBMR Task Force on ONJ // J. Musculoskeletаl Neuronal Interact. — 2007. — Vol. 7, № 4. — P.354-355.
5. Weitzman R., Sauter N., Eriksen E.F. et al. Critical review: updated recommendations for the prevention, diagnosis, and treatment of osteonecrosis of the jaw in cancer patients // Crit. Rev. Oncol. Hematol. — 2007. — Vol. 62. — P. 148-152.