Международный эндокринологический журнал 2 (34) 2011
Вернуться к номеру
Состояние сперматогенеза при диффузном токсическом зобе до и после лечения
Авторы: Исмаилов С.И., Узбеков К.К., Элов А.А., Республиканский специализированный научно-практический медицинский центр эндокринологии МЗ Республики Узбекистан, Ташкент, Республика Узбекистан
Рубрики: Эндокринология
Версия для печати
Целью нашего исследования явилось изучение степени выраженности нарушений сперматогенной функции у больных с диффузным токсическим зобом в зависимости от тиреоидного статуса и метода лечения. Было обследовано 88 мужчин с диффузным токсическим зобом. 39 пациентов принимали консервативное лечение, 11 пациентов — радиойодотерапию, 38 пациентов — хирургическое лечение. Состояние тиреоидного статуса оценивалось клинически и посредством гормональных показателей (тиреотропный гормон, тироксин, трийодтиронин), исследовался эякулят. В группе больных в стадии декомпенсации отмечалось достоверное снижение количества сперматозоидов до 37,1 млн/мл по сравнению со здоровой группой (101,0 ± 10 млн/мл, р < 0,05), хотя показатели плотности сперматозоидов находились в пределах нормальных значений. Количество активных форм снижено до 25,3 %, соответственно, с повышением количества неподвижных форм. После достижения эутиреоза наблюдалось увеличение количества активных форм сперматозоидов во всех исследуемых группах. Наши данные свидетельствуют о немаловажной роли тиреоидного статуса в функционировании тестикулярной ткани.
Диффузный токсический зоб, сперматозоиды.
Введение
Исследований, проведенных по изучению влияния патологии щитовидной железы (ЩЖ) на репродуктивную функцию у мужчин, очень мало. Возможно, это связано с меньшей частотой встречаемости патологии ЩЖ у мужчин, чем у женщин. Диффузный токсический зоб (болезнь Грейвса) — достаточно распространенное заболевание. Частота его встречаемости достигает 3 % у женщин и 0,3 % у мужчин в районах с нормальным йодным обеспечением и возрастает по мере проведения йодной профилактики [1]. По данным немногочисленных исследований, при синдроме тиреотоксикоза наблюдается ряд гормональных изменений в гипоталамо-гипофизарно-тестикулярной оси, изменения сперматогенной функции яичек не остаются в стороне. Показана роль тиреоидных гормонов в развитии тестикул после обнаружения большого количества тиреоидных рецепторов в неонатальных клетках Сертоли [2, 3]. Эти находки полностью изменили ранее существующее мнение о том, что тиреоидные гормоны не играют роли по отношению к тестикулам.
Целью нашего исследования является изучение степени выраженности нарушений сперматогенной функции у больных с диффузным токсическим зобом (ДТЗ) до лечения и после достижения эутиреоза в зависимости от метода лечения.
Материалы и методы исследования
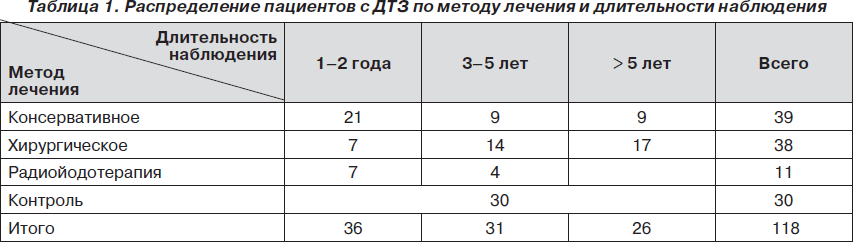
Было обследовано 88 мужчин с ДТЗ, находившихся на стационарном и амбулаторном лечении в клинике РСНПМЦЭ с 2002 по 2010 г. Пациенты получали консервативное (39 пациентов) лечение, радиойодотерапию (11 пациентов), отдельную группу составили больные, прошедшие хирургическое лечение в период с 2002 по 2009 год и находящиеся под наблюдением (38 пациентов). Распределение пациентов по методу лечения и длительности наблюдения показано в табл. 1. В опытных группах исследовались пациенты, достигшие состояния эутиреоза в период от 1 года до 8 лет с момента начала лечения. Состояние тиреоидного статуса оценивалось клинически и посредством гормональных показателей. Были использованы иммунологические коммерческие наборы (Immunotech, Чехия) для определения гормонов: ТТГ, общего Т3, общего Т4. Нормальными диапазонами гормонов считались следующие показатели: ТТГ — 0,17–4,05 мМЕ/л; общий Т3 — 1,2–2,8 нмоль/л; общий Т4 — 60–160 нмоль/л. Исключались пациенты в группах после лечения, с клиническими признаками гипотиреоза и показателями ТТГ более 4,0 мМЕ/л. Средний возраст пациентов составил 27,2 ± 7,1 года. Контрольную группу составили 30 практически здоровых пациентов без патологии ЩЖ.
Исследовался эякулят больных с ДТЗ в стадии тиреотоксикоза и после достижения эутиреоза. Анализ эякулята проводился на микроскопе Zeiss (Япония) с увеличением 20 х 10, программа «Видео-Сперм 2.1». Анализ спермы проводился в соответствии с принятыми критериями ВОЗ — Лабораторным руководством ВОЗ по семени и взаимодействию спермы и цервикальной слизи (4-е издание) [4–6]. Нормальными показателями считались: объем ≥ 2,0 мл; концентрация сперматозоидов ≥ 20 млн/мл (концентрация менее 20 млн/мл — олигозооспермия); подвижность ≥ 50 % сперматозоидов с поступательным движением (категории А + В; количество подвижных сперматозоидов менее 50 % — астенозооспермия); морфология ≥ 14 % сперматозоидов нормальной формы (при менее 14 % нормальных форм сперматозоидов — тератозооспермия).
Факторы риска — курение, сопутствующие заболевания, лекарственные средства (принятые за последние 2 месяца до момента обследования) и другие причины, которые могли повлиять на сексуальное желание, эякуляцию, эрекцию, были учтены. Пациенты с сопутствующей сердечно-сосудистой патологией были исключены. Курение отмечали 38,6 % (34) больных. В группе больных в стадии декомпенсации ДТЗ 68,9 % (20) пациентов принимали b-блокаторы, 58,6 % (17 пациентов) принимали терапию глюкокортикоидами.
Результаты исследования и их обсуждение
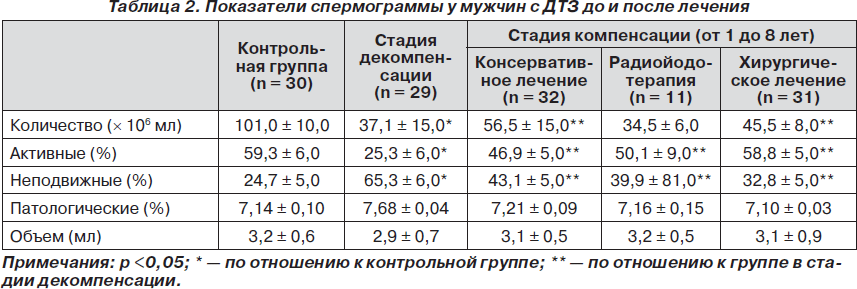
Показатели количества (плотности) сперматозоидов в стадии декомпенсации тиреотоксикоза и после достижения эутиреоза во всех группах находились в пределах нормальных значений (>20 млн/мл). В группе больных в стадии декомпенсации отмечалось достоверное снижение количества сперматозоидов (37,1 млн/мл) по сравнению со здоровой группой и активных форм (25,3 %), соответственно, с повышением количества неподвижных форм. Два пациента из этой группы, находящиеся в браке, были бездетными в течение 2 и 3 лет (репродуктивные нарушения у партнеров были исключены). Исходя из вышеизложенных результатов нашего исследования, установлены достоверно низкие показатели спермограммы относительно контрольной группы, хотя показатели плотности сперматозоидов находились в пределах нормальных значений. Следует также учесть, что за последние 50 лет нормальные показатели концентрации спермиев в эякуляте были снижены сначала до 40 млн/мл, а в последние 10–15 лет — до 20 млн/мл (по рекомендации ВОЗ) [5, 6]. В контрольной группе и группе консервативного лечения наблюдался широкий диапазон концентрации сперматозоидов — от 33 до 279 млн/мл. В группах, где проводилось консервативное и хирургическое лечение (за период 1–8 лет с момента достижения эутиреоза), при повторном обследовании отмечалось достоверное повышение плотности сперматозоидов — 56,5 и 45,5 млн/мл соответственно. У двух больных в ходе консервативного лечения (после 6 месяцев наблюдения) отмечалась высокая плотность сперматозоидов в эякуляте — более 200 млн/мл. Показатели спермограммы у мужчин с ДТЗ до и после лечения основной патологии показаны в табл. 2.
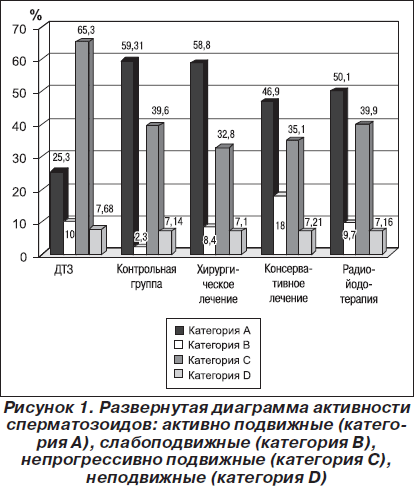
В группе больных в стадии декомпенсации отмечались достоверно низкие показатели активных форм — астенозооспермия (25,3 %), соответственно, с увеличением количества неподвижных форм. Увеличение количества активных форм сперматозоидов отмечалось во всех группах после достижения эутиреоза в период от 1 года до 8 лет (рис. 1). В группах с консервативным лечением, радиойодотерапией, хирургическим лечением — 46,9, 50,1 и 58,8 % соответственно. После проведенной терапии наблюдалось достоверное повышение уровня ТТГ во всех группах, из исследования исключались пациенты с клиническими признаками гипотиреоза и показаниями ТТГ более 4,0 мМЕ/л (табл. 3).
Изменений объема эякулята и наличия патологических форм сперматозоидов во всех группах до и после достижения эутиреоза не отмечалось.
Вышеописанные изменения можно объяснить с помощью выводов ряда экспериментальных исследований на крысах и других видах млекопитающих, в которых установлено, что трийодтиронин регулирует рост и развитие тестикул, контролирует пролиферацию и дифференциацию клеток Сертоли и Лейдига в период становления тестикулярной ткани [7, 8]. Основной путь образования биоактивной формы тиреоидных гормонов Т3 осуществляется в периферических тканях путем дейодирования Т4 в Т3, этот процесс модулируют ферменты дейодиназы типа 1 и типа 2 (D1, D2). Выявлено, что концентрированная экспрессия D2 наблюдается в удлиненных сперматидах [9]. Это подтверждает, что тиреоидные гормоны могут играть роль в сперматогенезе взрослых. Экспрессия D2 и D3 с младенческого до взрослого периода указывает на строгий контроль внутриклеточного Т3 в этом органе.
Исходя из вышеуказанных данных, можно сделать вывод о немаловажной роли тиреоидного статуса в становлении тестикулярной ткани и последующем ее функционировании.
Выводы
1. В группе больных с диффузным токсическим зобом в стадии декомпенсации отмечалось достоверное снижение количества сперматозоидов — 37,1 млн/мл по отношению к здоровой группе (101 млн/мл) и активных форм — 25,3 и 59,3 % соответственно, с повышением количества неподвижных форм в группе ДТЗ в стадии декомпенсации до 65,3 %.
2. Повышение активных форм сперматозоидов отмечалось во всех группах после достижения эутиреоза в период от 1 года до 8 лет. В группе с консервативным лечением, радиойодотерапией, хирургическим лечением — 46,9, 50,1 и 58,8 % соответственно.
1. Mostbeck A., Galvan G., Bauer P. et al. The incidence of hyperthyroidism in Austria from 1987–1995 before and after an increase in salt iodization in 1990 // European Journal of Nuclear Medicine. — 1998. — Vol. 25. — P. 367-373.
2. Palmero S., Maggiani S., Fugassa E.. Nuclear triiodothyronine receptors in rat Sertoli cells // Molecular and Cellular Endocrinology. — 1988. — Vol. 58. — P. 253-256.
3. Jannini E.A., Olivieri М., Francavilla S. et al. Ontogenesis of the nuclear 3,5,30-triiodothyronine receptor in the rat testis // Endocrinology. — 1990. — Vol. 126. — P. 2521-2526.
4. Dohle G.R., Jungwirth A., Kopa Z. et al. Guidelines on Male Infertility // European Association of Urology, 2009.
5. World Health Organization. WHO Laboratory Manual for the Examination of Human Semen and Sperm-Cervical Mucus Interaction. — 4th ed. — Cambridge: Cambridge University Press, 1999.
6. World Health Organization. WHO Manual for the Standardized Investigation, Diagnosis and Management of the Infertile Male. — Cambridge: Cambridge University Press, 2000.
7. Wagner M.S., Wajner S.M., Maia A.L.. The role of thyroid hormone in testicular development and function // Journal of Endocrinology. — 2008. — Vol. 199. — P. 351-365.
8. Mendis-Handagama S.M., Siril Ariyaratne H.B. Leydig cells, thyroid hormones and steroidogenesis // Indian Journal of Experimental Biology. — 2005. — Vol. 43. — P. 939-962.
9. Wajner S.M., Wagner M.S., Melo R.C. et al. Type 2 iodothyronine deiodinase is highly expressed in germ cells of adult rat testis // Journal of Endocrinology. — 2007. — Vol. 194. — P. 47-54.