Журнал «Травма» Том 12, №1, 2011
Вернуться к номеру
Дифференцированный подход к профилактике тромбоэмболических осложнений у больных с травматической болезнью
Авторы: Хижняк А.А., Волкова Ю.В. Харьковский национальный медицинский университет
Рубрики: Травматология и ортопедия
Версия для печати
Целью исследования был поиск наиболее рационального выбора средств профилактики тромбоэмболических осложнений у пострадавших с тяжелой политравмой. Под наблюдением находились 120 пациентов. Исследовались показатели центральной гемодинамики и всех звеньев гемостаза на фоне применения в комплексе интенсивной терапии нефракционированного и низкомолекулярного гепарина. Выявлено, что применение бемипарина с целью профилактики тромбоэмболических осложнений в остром и раннем периодах травматической болезни способствует более раннему восстановлению показателей гемостаза.
Травматическая болезнь, гиперкоагуляция, бемипарин.
В результате достигнутого обществом научно-технического прогресса социальное и медицинское значение проблемы травматизма имеет тенденцию к стойкому увеличению [1, 2].
На основании современных данных, тяжесть травматической болезни зависит от тяжести, обширности, характера и локализации повреждений, а компоненты интенсивной терапии при ней прежде всего должны быть подобраны на основе патогенетического принципа течения различных ее вариантов [3]. Принимая во внимание, что 25 % пострадавших с политравмой имеют нарушения свертывающей-антисвертывающей систем крови различной степени, а их характер определяется объемом кровопотери, обширностью тканевого повреждения, видом проводимого лечения [2], актуальным является поиск наиболее рациональных с патогенетической точки зрения компонентов интенсивной терапии, направленных на профилактику гемокоагуляционных осложнений в периоперационном периоде.
Известно, что механизм образования и лизиса кровяного сгустка состоит из трех компонентов: первичного сосудисто-тромбоцитарного гемостаза, коагуляции и фибринолиза [4]. Наиболее часто встречающимся гемокоагуляционным расстройством у пострадавших с политравмой является гиперкоагуляция, которая наблюдается, как правило, при преобладании травматического токсикоза [2] и представляет собой состояние, при котором в результате определенных патологических изменений происходит неадекватная аккумуляция тромбоцитов или фибрина, что в итоге может привести к тромбозу сосудов [5, 6]. Это усугубляется такими неблагоприятными факторами, как вынужденная гиподинамия, отсутствие присасывающего эффекта грудной клетки во время искусственной вентиляции легких на фоне введения миорелаксантов, тугое накладывание на голень или бедро манжеты для электродов и привязных ремней, нефизиологическое положение (чрезмерная ротация) конечности в состоянии миорелаксации [7].
С учетом приведенных данных нами было проведено исследование, целью которого явился поиск наиболее рационального подхода к профилактике тромбоэмболических осложнений у пострадавших с политравмой в остром и раннем периоде травматической болезни.
Материал и методы
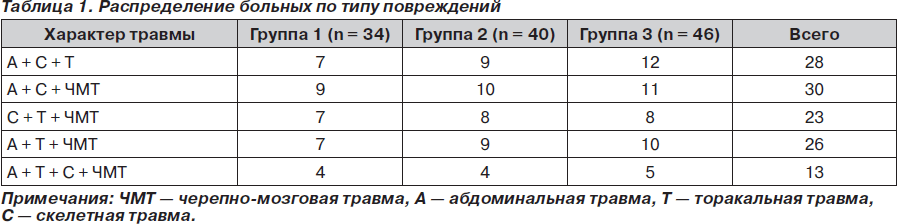
Нами было обследовано 120 пациентов с политравмой — 66 мужчин и 54 женщины. Возраст больных варьировал от 19 до 50 лет. Для сравнительного анализа было отобрано 3 группы пострадавших: группа 1, группа 2 и группа 3, по 34, 40 и 46 человек соответственно, которые достоверно не различались по полу, возрасту, антропометрическим данным, характеру и степени тяжести повреждений, срокам с момента травмы до поступления в стационар. Тяжесть политравмы была сравнима в группах и при оценке по шкале ISS составляла 29,30 ± 5,92, 28,87 ± 6,25 и 28,79 ± 8,17 балла соответственно, прогноз по шкале TS составил 10–13 баллов. При выборе пациентов для исследования особое значение придавали сочетанности повреждений, различные варианты и количество которых оказывают непосредственное влияние на течение травматической болезни (табл. 1).
При этом черепно-мозговая травма была представлена исключительно сотрясением и ушибом головного мозга легкой степени, не требующих оперативного вмешательства и отсрочки старта антикоагулянтной терапии. Уровень сознания пострадавших в момент поступления по шкале комы Глазго составлял 13,88 ± 1,12 с отсутствием достоверной разницы между группами (р > 0,05). Всем пострадавшим со скелетной травмой выполнялось наложение аппарата внешней фиксации с целью иммобилизации обломков.
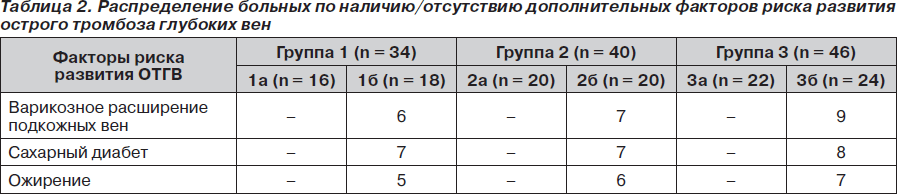
Каждая из групп в зависимости от наличия/отсутствия дополнительных факторов риска развития острого тромбоза глубоких вен (ОТГВ) была разделена на 2 подгруппы: 1а (n = 16), 1б (n = 18), 2а (n = 20), 2б (n = 20) и 3а (n = 22), 3б (n = 24) (подгруппа категории «б» — с наличием дополнительных факторов риска). Под дополнительными факторами риска подразумевали наличие такой сопутствующей патологии, как сахарный диабет, ожирение, варикозное расширение подкожных вен (табл. 2).
При поступлении все больные подвергались первичному осмотру, который обязательно включал в себя выяснение анамнестических данных, давность и течение сопутствующих заболеваний, осмотр нижних и верхних конечностей с целью выявления патологии подкожных и глубоких вен. При осмотре конечностей выявляли изменения их окраски, наличие мышечной гипотрофии и дистрофические изменения кожи, а также наличие и paспространенноcть отеков. Проводили измерение артериального давления на обеих верхних конечностях. Комплекс стандартных клинико-лабораторных обследований был дополнен определением количества тромбоцитов в крови методом фазово-контрастной микроскопии в камере Горяева в оксалатной среде, индуцированной агрегации тромбоцитов методом турбодиметрии с индукцией адреналином. Скрининговые тесты для оценки плазменного звена гемостаза включали определение активного частичного тромбопластического времени (АЧТВ) ручным методом с каолином, протромбинового времени по методу Квика, Международного нормализованного отношения (МНО, INR), тромбинового времени, концентрации фибриногена в плазме методом Клаусса, протеина С коагуляционным методом, антитромбина III аппаратным методом с помощью реактива «Антитромбин-Техпластин», времени лизиса эуглобулиновых сгустков (XIIa-зависимый фибринолиз) методом добавления хлорида кальция, плазминогена методом гидролиза хромогенного субстрата, растворимых фибрин-мономерных комплексов (РФМК) по ортофенантролиновому тесту.
Принимая во внимание, что фактор некроза опухоли (TNF-a) является высокоинформативным молекулярно-иммунологическим маркером синдрома системного воспалительного ответа, мы определяли его концентрацию в плазме с помощью иммуноферментного анализа с использованием реактивов TNF-Vector Best.
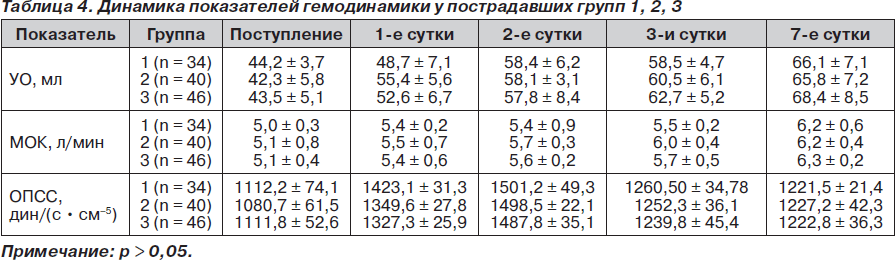
Всем пострадавшим с целью подтверждения репрезентативности групп обследуемых пациентов проводили определение параметров центральной гемодинамики методом интегральной тетраполярной реографии по Тищенко.
Для оценки достоверности отличий использовали t-критерий Стьюдента. При р < 0,05 отличия рассматривались как статистически достоверные.
Всем пострадавшим с целью улучшения реологических свойств крови и микроциркуляции применяли низкомолекулярные коллоиды, дезагреганты. Схема их введения была идентичной во всех обследуемых группах.
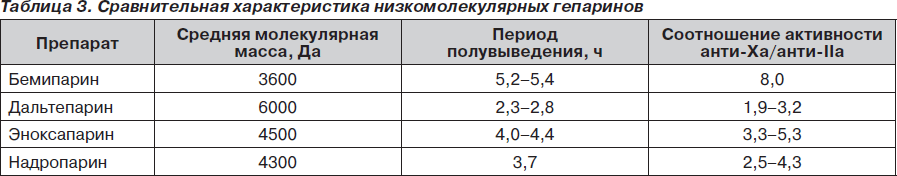
При выборе препарата для профилактики гиперкоагуляции мы оценили фармакологический профиль известных низкомолекулярных гепаринов (табл. 3) [8, 9].
Пациенты группы 1 с целью профилактики тромбоэмболических осложнений в остром и раннем периодах травматической болезни в дополнение к стандартной терапии получали нефракционированный гепарин в дозировке 5000 МЕ 2–3 раза в сутки каждые 8–12 часов подкожно в течение 10 суток. Первое введение препарата осуществлялось через 6–8 часов после оперативного вмешательства.
Пациенты группы 2 получали бемипарин в дозировке 2500 МЕ 1 раз в сутки подкожно. Первое введение препарата осуществлялось через 6–8 часов после оперативного вмешательства.
Пациенты группы 3 получали бемипарин в дозировке 3500 МЕ 1 раз в сутки подкожно. Первое введение препарата осуществлялось через 6–8 часов после оперативного вмешательства. Дифференцированный подход к интенсивной терапии у пострадавших с политравмой заключался в минимализации тромбоэмболических осложнений в остром и раннем периодах травматической болезни в зависимости от наличия/отсутствия у них факторов риска развития ОТГВ.
Результаты и обсуждение
При изучении гемодинамических параметров достоверной разницы между показателями нами выявлено не было, что подтверждает репрезентативность обследуемых групп (табл. 4).
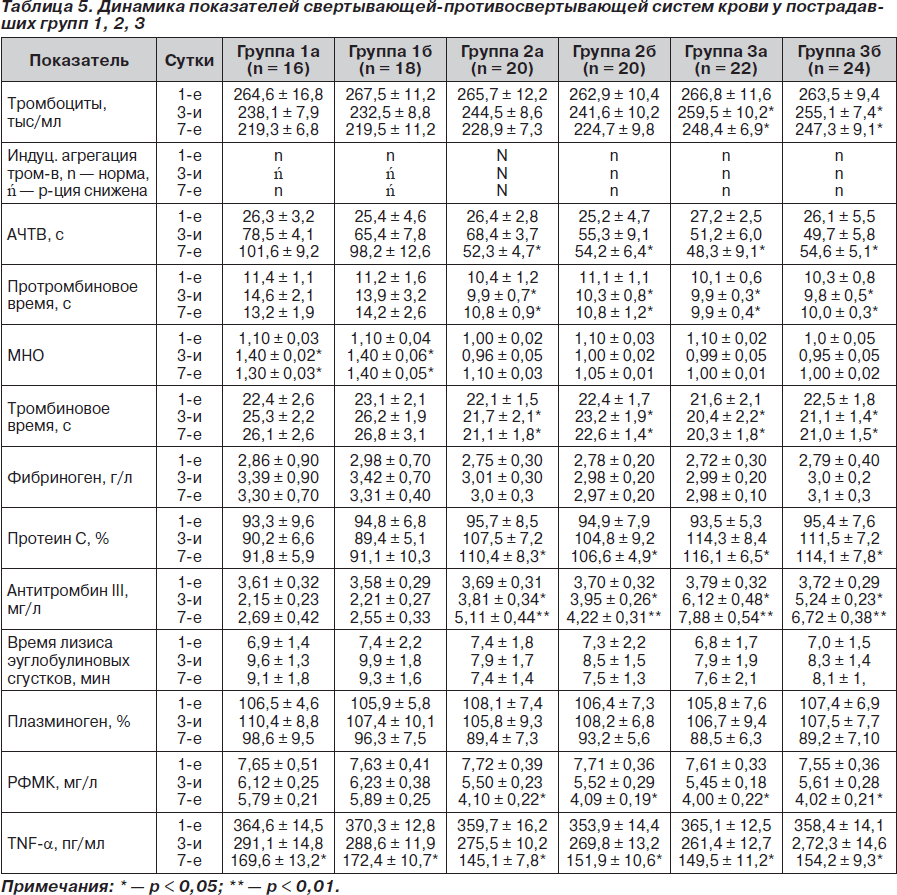
Мы провели сравнительный анализ показателей свертывающей-противосвертывающей систем крови во всех обследуемых группах (табл. 5).
При анализе показателей сосудисто-тромбоцитарного звена гемостаза у всех пострадавших было отмечено длительное снижение концентрации тромбоцитов на протяжение всего периода обследования, при этом достоверное (р < 0,05) уменьшение их количества было выявлено у больных подгруппы 1а и 1б по сравнению с подгруппами 3а и 3б на 3-и и 7-е сутки лечения, что свидетельствует в пользу большего их потребления в результате формирования тромбоцитарных тромбов и повышенное потребление антитромбина III. Эти изменения подтверждаются данными, полученными при оценке индуцированной агрегации тромбоцитов.
При сравнительном анализе показателей АЧТВ выявлено достоверное (р < 0,05) повышение его у пострадавших подгрупп 1а и 1б на 7-е сутки, что коррелирует с дозой нефракционированного гепарина и обусловлено его влиянием на IIа-фактор. У пациентов групп 2 и 3 достоверной разницы между цифрами АЧТВ как между подгруппами, так и между группами выявлено не было, при этом отмечалось его некоторое увеличение на протяжении всего периода обследования.
При статистическом анализе показателя протромбинового времени достоверное (р < 0,05) его удлинение было отмечено у пострадавших подгрупп 1а и 1б на 3-и и 7-е сутки по сравнению с таковым в других подгруппах. Это свидетельствует в пользу уменьшения риска возникновения кровотечения у больных групп 2 и 3. В свою очередь, аналогичная динамика была отмечена и при анализе данных результатов исследования тромбинового времени, МНО. Данные подтверждают минимальное влияние низкомолекулярного гепарина на IIa-фактор за счет высокого соотношения анти-Ха/анти-IIa-факторной активностей.
При проведении анализа содержания фибриногена в крови достоверных отличий между подгруппами выявлено не было. При оценке динамики плазменной концентрации протеина С было выявлено достоверное (р < 0,05) ее снижение на 3-и сутки у больных группы 1.
При проведении анализа показателя антитромбина III отмечалось достоверное (р < 0,05) сниженное его содержание на 3-и и (р < 0,01) 7-е сутки лечения у больных подгрупп 1а и 2а. При этом в группе 1 только на 7-е сутки была отмечена тенденция к нормализации его концентрации. Это свидетельствует в пользу высокого потребления антитромбина III для коррекции тромбинемии. У пострадавших групп 2 и 3 концентрация антитромбина III нормализовалась уже на 3-и сутки лечения, что свидетельствует в пользу устранения персистирующей длительной тромбинемии.
При сравнении показателя времени лизиса эуглобулиновых сгустков и количества плазминогена достоверных отличий между группами выявлено не было.
Концентрация РФМК исходно была повышена у пациентов всех групп, при этом достоверное снижение (р < 0,05) отмечено у пациентов групп 2 и 3, получающих бемипарин; на 7-е сутки данный показатель достиг субнормальных значений, что свидетельствует в пользу эффективности проводимой у них антикоагулянтной терапии. У пациентов групп 1 уровень РФМК снижался в динамике, однако достоверности не достигал.
Статистический анализ динамики содержания TNF-a в плазме крови выявил достоверное (р < 0,05) снижение его концентрации у больных групп 2 и 3 на 7-е сутки, что свидетельствует в пользу улучшения состояния микроциркуляции у пациентов, получавших бемипарин.
При сравнении всех исследуемых показателей у пострадавших между подгруппами каждой из групп достоверных отличий выявлено не было. При проведении анализа динамики факторов оценки системы гемостаза между группами 2 и 3 достоверных отличий выявлено не было, однако у больных группы 3, получающих бемипарин в дозе 3500 МЕ, их цифры были более приближенными к нормальным.
Таким образом, на основании полученных данных видно, что в первые 7 суток послеоперационного периода у пострадавших с тяжелой политравмой имеет место гиперкоагуляция, степень выраженности которой не зависит от наличия/отсутствия факторов риска развития ОТГВ, что свидетельствует об отсутствии влияния сопутствующей патологии на клинико-патогенетические механизмы развития нарушений в системе коагуляции у пострадавших с тяжелой политравмой в остром и раннем периодах травматической болезни.
На основании проведенного нами статистического анализа можно утверждать, что препаратами выбора профилактики развития тромбоэмболических осложнений у данного контингента больных являются низкомолекулярные гепарины. Принимая во внимание данные сравнительной оценки фармакологического профиля низкомолекулярных гепаринов для профилактики тромбоэмболических осложнений у пациентов с тяжелой политравмой, можно рекомендовать бемипарин по 3500 МЕ 1 раз в сутки в течение острого и раннего периодов травматической болезни под контролем коагулограммы.
Выводы
1. Нарушения в системе гемостаза, а именно гиперкоагуляция, являются одним из значимых составляющих патогенеза травматической болезни.
2. Частота развития тромбоэмболических осложнений в послеоперационном периоде у пострадавших с тяжелой политравмой не зависит от наличия/отсутствия факторов риска развития острого тромбоза глубоких вен в анамнезе.
3. Важным моментом при проведении интенсивной терапии у пострадавших с тяжелой политравмой является профилактика развития тромбоэмболических осложнений.
4. У пострадавших с тяжелой политравмой профилактическое применение бемипарина способствует более раннему восстановлению нормальных значений показателей системы гемостаза по сравнению с применением нефракционированного гепарина.
5. Доза бемипарина 3500 МЕ в сутки является оптимальной для пациентов с политравмой.
Антонюк М.Г. Епідеміологія закритої торакоабдомінальної травми // Український журнал екстремальної медицини імені Г.О. Можаєва. — 2002. — Т. 3, № 4. — С. 23-27.
Травматическая болезнь и ее осложнения / Под ред. С.А. Селезнева и др. — СПб.: Политехника, 2004. — 414 с.
Хижняк А.А. Патогенетическое обоснование лечебного комплекса острого периода торако- абдоминальной травмы / А.А. Хижняк, Ю.В. Волкова // Матеріали наук.-практ. конф. з міжнародною участю, присвяченої 200-річчю з дня заснування Харківського державного медичного університету. — Харків, 2005. — С. 164-165.
Geerts W.H., Bergqvist D., Pineo G.F. et al. Prevention of Venous Thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition) // Chest. — 2008. — 133. — 381S-453S.
Perler B.A. Hypercoagulability and the hypercoagulability syndromes // Am. J. Roentgenol. — 1995. — Mar, 164(3). — Р. 559–564.
Girolami A. Venous and arterial thrombophilia / A. Girolami., P. Simioni, L. Scarano, B. Girolami // Haematologica. — 1997. — Jan, 82(1). — Р. 96-100.
Рябцев В.Г. Профилактика и диагностика послеоперационных тромботических осложнений / В.Г. Рябцев, П.С. Гордеев. — М.: Медицина, 1987. — 182 с.
Усенко Л.В. Низкомолекулярные гепарины в анестезиологии и интенсивной терапии (методические рекомендации) / Л.В. Усенко, С.В. Срибнюк, В.И. Слива, Г.В. Панченко // Изд. ДГМА. — 2001. — 41 с.
Martinez-Gonzales J., Vila L., Rodriguez C. Bemiparin: second-generation, low-molecular-weight heparin for treatment and prophylaxis of venous tromboembolism //Expert Review of Cardiovascular Therapy. — 2008. — Vol. 6, № 6. — P. 793-802.