Журнал «Травма» Том 12, №1, 2011
Вернуться к номеру
Региональная анестезия у пациентов с травмой: проблемы антикоагулянтной и дезагрегантной терапии
Авторы: Кучин Ю.Л.1, Тарасенко С.А.2 1Национальный медицинский университет имени академика А.А. Богомольца, г. Киев, 2Киевская городская клиническая больница № 17
Рубрики: Травматология и ортопедия
Версия для печати
В статье обобщены данные по коагуляционным осложнениям нейроаксиальной блокады и дан обзор современных рекомендаций по региональной анестезии у пациентов, нуждающихся в терапии антикоагулянтами или дезагрегантами. Накопленные доказательства свидетельствуют о том, что начало введения низкомолекулярных гепаринов в послеоперационном периоде не менее эффективно для профилактики венозных тромбозов, чем в предоперационном. Такая стратегия при нейроаксиальных и «больших» периферических блокадах имеет значительные преимущества.
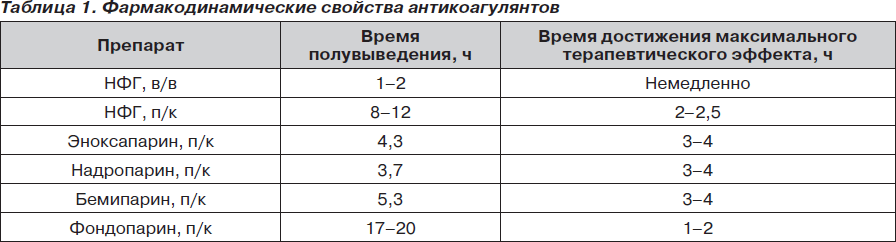
Среди низкомолекулярных гепаринов препаратом с доказанной эффективностью при послеоперационном начале тромбопрофилактики является только бемипарин (Цибор), первое введение которого рекомендуется через 6 часов после окончания операции.
Анестезия, низкомолекулярные гепарины, бемипарин.
Увеличение среднего возраста оперируемых пациентов и широкое распространение хирургических методов лечения заболеваний сердечно-сосудистой системы, в том числе и ишемической болезни сердца, а также многие другие факторы обусловливают рост в популяции доли пациентов, получающих постоянную терапию антикоагулянтами и дезагрегантами. Кроме того, любая большая ортопедическая операция или даже сама по себе скелетная травма автоматически относит пациента к группе высокого риска тромботических осложнений, что диктует необходимость назначения им антикоагулянтной терапии. С другой стороны, именно у травматологических пациентов региональная анестезия является методом выбора не только в качестве анестезиологического пособия во время оперативного вмешательства, но также используется для обезболивания как до операции (при травме), так и в послеоперационном периоде. Однако наиболее грозные осложнения региональной анестезии связаны именно с кровотечениями из непреднамеренно поврежденных сосудов: эпидуральная или спинальная гематома при нейроаксиальных блоках и гематомы при повреждении крупных сосудов при «больших» периферических блоках (плечевое и поясничное сплетения, паравертебральная блокада, блокады седалищного и бедренного нервов). В обоих случаях решающими факторами в их возникновении могут быть изменения в системе коагуляции, вызванные терапией антикоагулянтами и дезагрегантами. Целью настоящего исследования является обобщение имеющихся данных по коагуляционным осложнениям нейроаксиальной блокады и обзор современных рекомендаций по региональной анестезии у пациентов, нуждающихся в терапии антикоагулянтами или дезагрегантами.
Геморрагические осложнения региональной анестезии
Редким, но часто крайне опасным осложнением спинальной или эпидуральной анестезии является кровоизлияние под или над твердой мозговой оболочкой спинного мозга. В большинстве случаев это приводит к необратимым неврологическим нарушениям и инвалидизации пациента той или иной степени тяжести. В литературе данный вид осложнений часто объединяют под термином «спинальная гематома», независимо от локализации их по отношению к менингеальным оболочкам. При этом истинно субарахноидальные кровотечения, в связи с размытостью клинической картины, фиксируются реже, чем эпидуральные, при которых кровотечение происходит в замкнутое пространство с последующим развитием тяжелых неврологических осложнений. Клинически спинальная гематома проявляется болью в спине, сенсорными расстройствами, прогрессирующим моторным параличом, нарушением дефекации, дизурией. Определяющими в постановке диагноза являются данные КТ/МРТ, а единственно правильной тактикой ведения таких пациентов, которая может улучшить прогноз заболевания, является раннее хирургическое лечение.
Действительная частота неврологических дисфункций как результата геморрагических осложнений нейроаксиальных блокад неизвестна. Вероятно, часть осложнений, отнесенных на счет спинальной или эпидуральной анестезии, на самом деле имеет другую этиологию, но выяснить, какой процент из них ошибочный, не представляется возможным. Наиболее обширный обзор литературы Tryba [1] описывает 13 случаев спинальных гематом на 850 000 эпидуральных анестезий и 7 случаев на 650 000 спинальных блоков. Основываясь на обобщенных данных, расчетная инцидентность спинальной гематомы составляет 1 : 150 000 эпидуральных и 1 : 220 000 спинальных анестезий. При этом, учитывая широкий разброс 95% доверительного интервала, настоящая частота, вероятно, значительно ниже. Кроме того, этот анализ базируется на данных, полученных преимущественно из описания клинических случаев и исследований с непредставительной выборкой [2–4]. Например, оценка риска двукратного за сутки введения низкомолекулярного гепарина (НМГ) проводилась на основании лечения 3100 пациентов [5], а статистически необходимое количество пациентов для анализа инцидентности такого порядка (1 : 200 000) должно быть трехкратным, т.е. не менее 600 000 пациентов. Еще одним фактором, не позволяющим считать расчетную частоту спинальных гематом точной, является неоднородность этой патологии в разных группах. Moen [6] в своем исследовании анализирует тяжелые неврологические осложнения после нейроаксиальных блокад в Швеции. Общее количество зарегистрированных нейроаксиальных блокад в 1990–1999 годах составило в общем 1 260 000 спинномозговых и 450 000 эпидуральных анестезий. При этом было описано 127 неврологических осложнений (104 документировано), из которых спинальных гематом было 33. Таким образом, инцидентность в целом была 1 : 710 000 нейроаксиальных анестезий. Однако при анализе субпопуляций были выявлены значительные различия: большая часть случаев была отмечена у женщин пожилого возраста, а эпидуральная анестезия значительно повышала риск в сравнении со спинальной.
В отчетах FDA с мая 1993 по октябрь 1998 года упоминается о 43 пациентах в США, у которых отмечались тяжелые осложнения после нейроаксиальной блокады: спинальная, эпидуральная гематома или кровотечение. В связи с этим было выполнено 28 ургентных декомпрессионных ламинэктомий. Несмотря на это, 16 пациентов были выписаны с параплегией. 78 % пациентов были женского пола, средний возраст составил 75 лет, у 26 из них производилась хотя бы одна попытка установки эпидурального катетера, а у 6 отмечено кровотечение или гематома после удаления катетера. 3 пациента имели патологию позвоночника. Первая доза (30 мг эноксапарина) была введена перед, во время или сразу после окончания операции у 4 пациентов, на протяжении 12 ч — у 12, а у 2 пациентов доза низкомолекулярного гепарина превышала рекомендуемую. Развитие клинических симптомов отмечали в среднем на 2–3-й день после начала терапии эноксипарином. 16 пациентов получали сопутствующее лечение препаратами риска (гепарин, варфарин, кеторолак или НПЛП). Предрасполагающими к развитию спинальной гематомы факторами в этом отчете называются: превышение рекомендуемой профилактической дозы, назначение низкомолекулярных гепаринов хирургическим пациентам до обеспечения надежного гемостаза, катетеризация эпидурального пространства, сопутствующее лечение препаратами, влияющими на гемостаз, наличие аномалий позвоночника, пожилой возраст и женский пол.
В рекомендациях Американской ассоциации региональной анестезии (ASRA) [8] на основании описанных случаев спинальных гематом выделяли следующие независимые факторы риска развития этого осложнения после нейроаксиальной блокады: женский пол, пожилой возраст, травматичная манипуляция, эпидуральная (в сравнении со спинальной) техника, катетеризация эпидурального пространства, периоперационное назначение НМГ (сразу перед, сразу после), раннее послеоперационное назначение НМГ, сопутствующая терапия антиагрегантами или антикоагулянтами, назначение НМГ дважды в день. Rosencher [9] отмечает, что инцидентность спинальной гематомы должна быть распределена по ревалентным группам. Например, отмечается очень низкая частота в популяции рожениц, но она очень высокая в популяции пожилых женщин. Также значительно отличается инцидентность спинальных гематом в зависимости от вида анестезии — значимо более высокий риск отмечен при использовании эпидурального катетера в сравнении с одномоментной эпидуральной или спинальной анестезией.
Таким образом, большинство исследователей указывают на следующие независимые факторы риска: возраст 75 лет и старше, женский пол, сопутствующая терапия препаратами, влияющими на систему гемостаза (гепарин, варфарин, кеторолак или другие НПЛП, декстраны), патология позвоночника, травматичная пункция или множественные пункции, эпидуральная анестезия с катетеризацией в сравнении с одномоментной эпидуральной анестезией, которая, в свою очередь, имеет большие риски, нежели спинномозговая анестезия. При этом точно оценить все риски чрезвычайно сложно, что и является причиной некоторых различий в рекомендациях разных стран по проведению нейроаксиальной анестезии на фоне терапии антикоагулянтами.
Региональная анестезия на фоне антикоагулянтной терапии
С точки зрения доказательной медицины [10] тромбопрофилактика с использованием подкожного введения нефракционированного гепарина не является противопоказанием к нейроаксиальной блокаде. Эпидуральный катетер следует удалять не ранее чем через 6 часов после последнего введения гепарина и не позднее чем за 2 часа до следующей дозы, при этом важен контроль уровня тромбоцитов из-за возможной гепарин-индуцированной тромбоцитопении. Интраоперационное внутривенное введение нефракционированного гепарина может быть начато не ранее чем через 1 час после установки эпидурального катетера или спинномозговой пункции. Удаление эпидурального катетера можно производить после нормализации показателей коагулограммы. Никаких рекомендаций относительно применения низкомолекулярных гепаринов или других антикоагулянтов в силу небольшой доказательности имеющихся данных указанный выше документ не содержит.
Американский колледж торакальных врачей (ACCP, American College of Chest Physicians) в седьмом издании (2004) рекомендует придерживаться следующих рекомендаций относительно нейроаксиальных блокад и тромбопрофилактики: избегать нейроаксиальной анестезии/аналгезии у пациентов с известными нарушениями свертывания, у пациентов, которым предоперационно проводили коррекцию свертывающей системы с использованием антитромботических препаратов, спинальная пункция должна быть отложена до момента, когда действие препарата минимально, а тромбопрофилактика антикоагулянтами должна быть отложена, если при манипуляции аспирировалась кровь. В документе 8-го пересмотра (2008) рекомендации еще более лаконичны [12]: рекомендуется тщательный отбор пациентов, которым планируется нейроаксиальная анестезия или аналгезия, и осторожность при использовании тромбопрофилактики антикоагулянтами (уровень 1А); если планируется блокада глубоких нервов и сплетений, при использовании тромбопрофилактики антикоагулянтами должна быть соблюдена такая же осторожность (уровень 1С).
Американская ассоциация региональной анестезии на второй консенсусной конференции нейроаксиальной анестезии и антикоагулянтной терапии дает следующие рекомендации: тщательная оценка риска ТГВ, оценка опыта анестезиолога, проведение нейроаксиальной анестезии не ранее чем через 12 часов после последнего введения низкомолекулярных гепаринов, после проведения пункции введение низкомолекулярных гепаринов следует проводить не ранее чем через 6–8 часов, а при условии, что манипуляция была травматичной, введение НМГ откладывают на 12 часов. Кроме того, удалять эпидуральный катетер желательно в той же позиции, в какой он и устанавливался, а саму процедуру следует отложить на 10–12 ч после последней дозы НМГ, следующее введение антикоагулянта — не ранее чем через 2 часа.
В странах Европы существуют некоторые различия не только в отношении к рекомендациям Американской ассоциации региональной анестезии, но и между отдельно взятыми национальными рекомендациями [13].
В целом, несмотря на некоторые отличия, общими для рекомендаций европейских анестезиологических сообществ являются следующие положения [9]:
— нейроаксиальная блокада должна быть отложена на 12 ч после введения НМГ (везде, кроме Франции);
— введение НМГ должно быть отложено на 6–8 ч после манипуляции;
— удаление катетера должно производиться при минимальной плазменной концентрации (18–20 ч после последней дозы НМГ);
— следующая инъекция НМГ производится через 4–6 ч после удаления катетера;
— при признаках повреждения сосуда (кровоточивость) во время выполнения манипуляции следует отложить введение НМГ.
Национальный протокол тромбопрофилактики, утвержденный приказом МЗ Украины № 329 от 15.06.2007 «Про затвердження клінічних протоколів надання медичної допомоги з профілактики тромботичних ускладнень в хірургії, ортопедії і травматології, акушерстві та гінекології» [14], включил в себя положения, сходные с международными рекомендациями. Согласно этому документу, нейроаксиальных блокад следует избегать у пациентов с известными нарушениями гемостаза. Нефракционированный гепарин следует вводить за 4 часа и через 30 минут после нейроаксиальной анестезии. Низкомолекулярные гепарины следует вводить не позднее чем за 12 часов и не ранее чем через 12 часов после нейроаксиальной анестезии.
У больных, которым вводились антикоагулянты в предоперационном периоде, спинномозговую или эпидуральную блокаду следует отложить до минимизации эффектов антикоагулянтов. Этот период продолжается не менее 8–12 часов после подкожной дозы гепарина или ежедневной профилактической дозы НМГ с двукратным введением или не менее 18 часов после однократной за сутки профилактической дозы. Профилактику антикоагулянтами следует отложить, если при спинномозговой пункции был получен геморрагический аспират.
Удаление эпидурального катетера необходимо производить тогда, когда эффект антикоагулянта становится минимальным (обычно как раз перед следующим запланированным подкожным введеним), а следующее введение антикоагулянта следует отложить не менее чем на 2 часа после спинномозговой пункции или удаления эпидурального катетера.
Если для профилактики используются антагонисты витамина К, не рекомендуется длительность постоянной эпидуральной аналгезии более 1–2 суток из-за непредсказуемости эффекта антикоагулянтов. Удалять эпидуральный катетер рекомендуется при международном нормализованном отношении (МНО) не выше 1,5.
Хотя послеоперационная профилактика фондопарином считается безопасной для больных, которым проводили нейроаксиальную блокаду, отсутствуют доказательные данные относительно его применения одновременно с послеоперационной эпидуральной аналгезией. Убедительных данных, которые могли бы быть основанием для однозначных рекомендаций применять или не применять фондопарин одновременно с эпидуральной аналгезией, нет.
Блокады периферических нервов в местах, где невозможна компрессия сосуда при непреднамеренном его повреждении, у пациентов, получающих антикоагулянты, рассматриваются с такими же предосторожностями, что и спинальная или эпидуральная анестезия. При этом применение методик поиска нервов и сплетений с помощью ультразвука не уменьшает степень риска геморрагических осложнений [10].
Поскольку безопасность режимов введения антикоагулянтов относительно спинальной гематомы невозможно выявить в клинических исследованиях, соответствующим принципам доказательной медицины, эти рекомендации базируются на понимании фармакодинамики и фармакокинетики применяемых препаратов [15]. На рис. 1 схематически показана фармакодинамическая активность низкомолекулярных гепаринов.
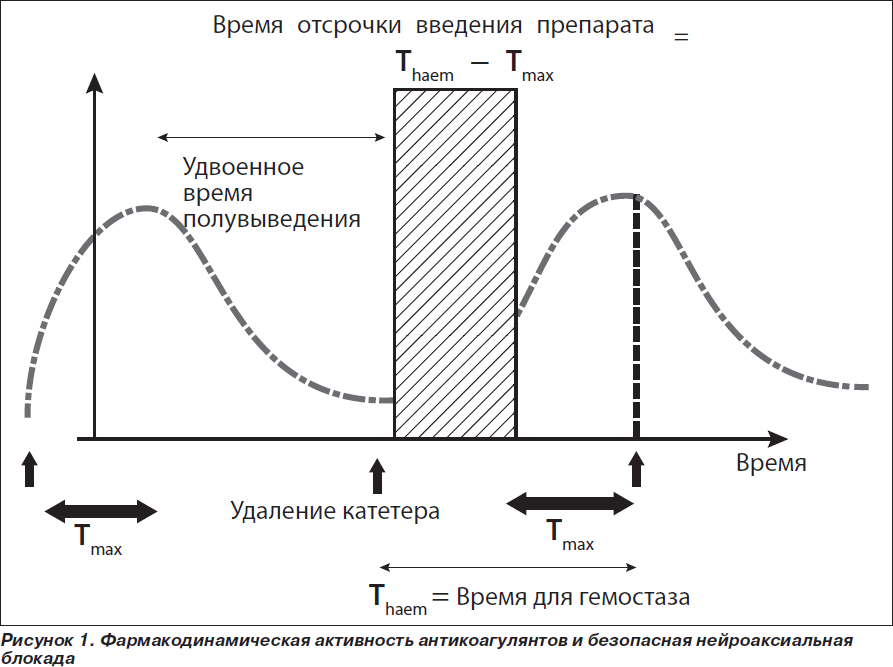
Исходя из этого, если период полувыведения антикоагулянта 4–5 часов, а время для достижения максимальной терапевтической активности — 4 часа (как для среднего НМГ), то удаление катетера следует отложить по крайней мере на 10 часов, безопасное время должно быть не менее 8 часов, поэтому следующее введение следует делать не ранее чем через 4 часа после удаления катетера (т.е. 8 ч — Тmax). В табл. 1 представлены данные относительно основных антикоагулянтов, применяемых в Украине.
Таким образом, исходя из расчетных показателей, введение эноксапарина следует прекращать за 9 ч [14] до пункции, надропарина — за 7–8 ч, бемипарина — за 10–11 ч. После удаления катетера временные промежутки должны быть соответственно: 5 ч для эноксапарина, 4 — для надропарина и 6 — для бемипарина.
Относительно новых для рынка Украины препаратов тромбопрофилактики дабигартрана и ривароксабана рекомендации также могут быть сделаны, базируясь только на их фармакодинамических свойствах. В случае атравматичной спинальной пункции ривароксабан в стандартной профилактической дозировке может назначаться через 6–8 часов, дабигартран — через 1–4 часа. Кроме того, в настоящее время не рекомендуется использовать дабигартран у пациентов, которым планируется продленная эпидуральная анестезия с катетеризацией.
Первое введение антикоагулянта
Время начала тромбопрофилактики на сегодняшний день остается дискутабельным вопросом. Действующие рекомендации европейских стран в качестве базовой рекомендации содержат указание на предоперационное начало тромбопрофилактики, однако в рутинной клинической практике введение НМГ чаще переносится на 6–12 часов после операции [13] из-за опасений увеличения интраоперационной кровопотери. Единого для стран Европы консенсуса на сегодняшний день нет. Эксперты рекомендуют оценивать соотношение риск/польза в каждом отдельном случае, основываясь на типе и дозе конкретного антикоагулянта, виде региональной анестезии и факторах риска со стороны пациента.
Идея послеоперационного начала тромбопрофилактики активно развивается на фоне накопления доказательств того, что введение антикоагулянтов до операции не имеет объективных преимуществ, в то время как риск увеличения интраоперационной кровопотери увеличивается. Учитывая частоту использования местной и региональной анестезии, послеоперационное начало тромбопрофилактики при больших ортопедических операциях (артропластика тазобедренного и коленного суставов, остеосинтез бедра), по мнению проводивших системный обзор авторов [16], кажется более предпочтительным, а периоперационного назначения этих препаратов следует избегать (уровень доказательности В) [16]. При переломах бедра и отсрочке операции дооперационное назначение НМГ считают оправданным, но последняя доза должна быть введена не позже чем за 12 ч (в идеале — 24) до начала операции (уровень доказательности С).
Результаты другого метаанализа [17] свидетельствуют, что проведенные на сегодняшний день рандомизированные контролируемые исследования не дают убедительного ответа: обязательно ли вводить антикоагулянт до операции, или его введение может быть отложено на послеоперационный период. Однако авторы делают заключение, что, учитывая очень небольшую разницу между этими двумя стратегиями, послеоперационное введение препарата может уменьшить время нахождения больного в лечебном учреждении до операции, что является положительным моментом для пациента.
В рекомендациях Американского колледжа торакальных врачей (ACCP, 8-й пересмотр) указывается [12], что при тотальном эндопротезировании тазобедренного сустава могут использоваться различные режимы тромбопрофилактики: НМГ (учитывая обычно высокий риск у этих пациентов, начинать тромбопрофилактику за 12 часов перед операцией или через 12 или 24 часа после операции, или через 4–6 часов после операции в половинной от рекомендуемой для высокого риска дозе с последующим увеличением дозы до обычной), фондопарин (2,5 мг с началом через 6–24 ч после операции) или подобранная доза антагониста витамина К перед операцией или накануне вечером (целевое МНО — 2,5, пределы 2,0–3,0) (все рекомендации уровня доказательности 1А). Относительно пациентов, получающих НМГ в качестве тромбопрофилактики при больших ортопедических операциях, рекомендуются обе стратегии: до- и послеоперационного начала введения НМГ (уровень доказательности 1А). При больших нейрохирургических операциях также рекомендуется рутинная тромбопрофилактика (уровень доказательности 1А), включая перемежающуюся компрессию нижних конечностей (уровень 1А). Приемлемой альтернативой компрессии считается НМГ послеоперационно (уровень 2А) или нефракционированный гепарин в профилактических дозах (уровень 2В).
Таким образом, относительно ортопедических и травматологических оперативных вмешательств в настоящее время отмечается смещение стратегии начала тромбопрофилактики в сторону послеоперационного периода. В то же время большинство низкомолекулярных гепаринов с профилактической целью должны быть введены, согласно инструкции по применению, за 12 часов до оперативного вмешательства. Долгое время послеоперационный старт тромбопрофилактики был разрешен только для фондопарина.
В отличие от других низкомолекулярных гепаринов препарат второго поколения бемипарин для профилактики тромботических осложнений, согласно общей характеристике продукта, разрешено вводить в послеоперационном периоде. Поэтому именно его рекомендуют в качестве препарата выбора при необходимости именно послеоперационного старта тромбопрофилактики [18]. Это положение базируется не только на анализе фармакодинамических свойств препарата, но и подтверждено рядом контролируемых клинических исследований.
Небольшое пилотное исследование [19] среди 65 пациентов с тотальной артропластикой тазобедренного сустава продемонстрировало, что тромбопрофилактика бемипарином в дозе 3500 ЕД может начинаться через 6 ч после окончания операции, что обеспечивает достаточную безопасность в плане интраоперационной кровопотери и хорошую эффективность профилактики тромботических осложнений. Общая инцидентность составила 7 % без разницы между группами. Обсервационное исследование с участием более 1000 пациентов [20] не только подтвердило эффективность и безопасность послеоперационного старта бемипарином, но и продемонстрировало значительный экономический эффект. Объединенные данные 5 клинических исследований [21] с общим количеством больных 1759 показали, что оптимальное время для начала тромбопрофилактики бемипарином — это 6 часов после операции.
В многоцентровом рандомизированном двойном слепом исследовании сравнивали эффективность и безопасность тромбопрофилактики бемипарином 3500 ЕД начиная после 6 часов от окончания операции и эноксапарином 40 мг начиная с первого введения за 12 часов до начала операции у пациентов с артропластикой коленного сустава [22]. Инцидентность тромбозов глубоких вен была идентичной (32,1 % у бемипарина против 36,9 % у эноксапарина). Абсолютное снижение риска было на 4,8 % в пользу бемипарина, однако статистически незначимо при таком количестве наблюдений. Подобные же данные были получены и относительно ТЭЛА (0 против 1,2 % в пользу бемипарина — незначимо). Не было различий и в кровотечениях между группами, что продемонстрировало, хоть и на относительно небольшой выборке (n = 386), не меньшую эффективность тромбопрофилактики бемипарином при послеоперационном начале в сравнении с традиционным дооперационным началом профилактики эноксапарином.
Антитромбоцитарная терапия и региональная анестезия
Антитромбоцитарные препараты обычно назначают для профилактики артериальных тромбозов, при которых тромбоциты играют ключевую роль в формировании тромба. Антитромбоцитарные препараты могут назначаться пациентам по следующим показаниям [23–25]: острый инфаркт миокарда, острый коронарный синдром, состояние после стентирования коронарных артерий, мерцательная аритмия, состояния после кардиохирургических операций, включая коррекцию пороков сердца, ишемический инсульт в остром периоде, профилактика повторных инсультов, стеноз сонной артерии, состояние после каротидной эндартерэктомии, пациенты с антифосфолипидным синдромом, периферические артериопатии, а также для первичной профилактики у пациентов с высоким кардиоваскулярным риском. Хотя все антитромбоцитарные препараты ингибируют функцию тромбоцитов, они могут делать это по-разному [21, 26]. Принципиально антитромбоцитарные препараты разделены на 4 группы. К первой группе относят антагонисты аденозиндифосфата (АДФ), включающие тиенопиридины, такие как тиклопидин и клопидогрель. Они достигают пиковой активности на 3–5-й день приема и оказывают продолжительный антитромбоцитарный эффект (7–10 дней). Ко второй группе относят ингибиторы гликопротеиновых рецепторов IIb/IIIa. Они используются только в остром периоде, так как имеют только формы для парентерального введения и достаточно короткий период полувыведения (24 ч). Кроме того, в Украине они еще не получили широкого распространения. К третьей группе относят вещества, увеличивающие цАМФ в тромбоцитах. Из этой группы препаратов распространен дипиридамол, средний антитромбоцитарный эффект которого составляет 24 ч. К четвертой группе относятся ингибиторы циклооксигеназы 1-го типа (аспирин, НПЛП). Антитромбоцитарные свойства аспирина изучены наиболее хорошо. Он необратимо ингибирует ЦОГ-1, следовательно, длительность его эффекта соответствует длительности жизни тромбоцита (7–10 суток). Однако при прекращении приема аспирина уже на 3-и–4-е сутки накапливается достаточное для образования сгустка количество тромбоцитов. НПЛП имеют сходный антитромбоцитарный механизм, однако существуют и значимые различия. Во-первых, ингибиция ЦОГ-1 обратима, то есть после выведения препарата функция тромбоцитов восстанавливается. Во-вторых, различные НПЛП по-разному влияют на изомеры циклооксигеназы (ЦОГ-1 и ЦОГ-2). Те препараты, которые преимущественно ингибируют ЦОГ-2, ингибируют продукцию эндотелиального простациклина (который оказывает вазодилатационный эффект и ингибирует агрегацию тромбоцитов), но не тромбоксана (который способствует агрегации тромбоцитов). Соответственно, эти препараты не оказывают антитромбоцитарного эффекта и могут потенциально рассматриваться как проагрегационные агенты, хотя последний вопрос остается дискутабельным [27]. Также существует гипотеза, что аспирин в низких (доклинических) дозах, что может наблюдаться после отмены препарата, оказывает сходный проагрегационный эффект. Это следует учитывать у больных с высоким риском артериальных тромбозов. Кроме того, больным высокого риска (например, после стентирования коронарных сосудов) часто назначают комбинацию антитромбоцитарных препаратов для усиления их эффекта (например, аспирин и клопидогрель).
При плановом оперативном вмешательстве вопрос об отмене антитромбоцитарного препарата, изменении в антитромбоцитарной терапии (например, замена клопидогреля или тиклопидина на аспирин либо у пациента, получавшего клопидогрель и аспирин, отмена только клопидогреля) или о продолжении прежнего режима решается на основании сопоставления риска геморрагии и риска тромботических осложнений [28–30].
Рекомендации относительно региональных методов анестезии у пациентов, получающих антитромбоцитарную терапию, хотя и имеют некоторые отличия в различных профессиональных организациях, в целом весьма сходны [31].
Имеющиеся в литературе данные дают возможность предположить, что аспирин и НПЛП в обычных терапевтических дозах и без взаимодействия с другими дезагрегантами не увеличивают риск возникновения спинальной гематомы при спинальной или эпидуральной анестезии [32–35]. Таким образом, отмена аспирина у этих пациентов не требуется. Если пациент, получающий аспирин, нуждается в периоперационном назначении других препаратов, влияющих на коагуляцию (например, низкомолекулярных гепаринов для профилактики тромбозов нижней конечности и ТЭЛА), существуют как рекомендации, указывающие на необходимость перерыва в тромбопрофилактике или применении аспирина, так и не считающие это необходимым [31–35]. Практически все протоколы разрешают использование аспирина в дозе от 70 до 325 мг/сут вплоть до дня операции (в Швеции и Германии рекомендуют перерыв в 2 дня). Также не требуется отмена НПЛП. Не рекомендуется использовать нейроаксиальную анестезию или «большие» блокады нервов и сплетений у больных, получающих тиенопиридины. Отмена клопидогреля должна быть произведена не менее чем за 7 суток до выполнения манипуляции, а для тиклопидина этот промежуток составляет 10–14 суток. Что касается других групп антитромбоцитарных препаратов (II и III группа), то не рекомендуют использовать региональные техники анестезии до окончания действия соответствующих препаратов.
Заключение
Таким образом, общей задачей для хирурга (или травматолога) и анестезиолога является определение правильного соотношения между рисками тромботических и геморрагических осложнений. Решение о назначении, продлении или отмене терапии антитромбоцитарными или антикоагулянтными препаратами должно приниматься после этой оценки, основанной на понимании фармакодинамики этих препаратов.
В случае высокого риска геморрагических осложнений (постоянный прием варфарина, клопидогреля, комбинаций дезагрегантов и антикоагулянтов) необходимо отложить операцию на безопасный период или отказаться от региональных методов. Если отказаться от региональных техник у пациентов, получавших антитромбоцитарную терапию, нельзя, а также при невозможности перенести оперативное вмешательство следует предпочесть анестезию с меньшим риском. В этом случае периферические блоки предпочитают спинальной анестезии, а спинальную анестезию — эпидуральной.
В то же время пациенты с высоким риском артериальных тромбозов не должны оставаться без профилактики последних. В этом случае риск геморрагии уменьшает перевод пациента с терапии препаратами высокого риска (тиклопидин, клопидогрель или их комбинация с аспирином) на аспирин в терапевтических дозах.
Накопленные доказательства свидетельствуют о том, что послеоперационное начало введения НМГ не менее эффективно для профилактики венозных тромбозов, чем предоперационное, а безопасность такой стратегии при нейроаксиальных и «больших» периферических блоках значительно выше.
Среди низкомолекулярных гепаринов препаратом с доказанной эффективностью при послеоперационном начале тромбопрофилактики является только бемипарин (Цибор), первое введение которого рекомендуется через 6 часов после окончания операции.
Tryba M. Epidural regional anesthesia and low molecular heparine // Anasthesiol Intensivmed Notfallmed Schmerzther. — 1993. — 28. — 179-81.
Vandermeulen E., Van Aken H., Vermylen J. Anticoagulants and spinal-epidural anesthesia // Anesth. Analg. — 1994. — 79. — 1165-77.
Horlocker T., Wedel D. Neuraxial block and low-molecular-weight heparin: balancing perioperative analgesia and thromboprophylaxis // Reg. Anesth. Pain Med. — 1998. — 23 (Suppl 2). — 164-77.
Horlocker T., Wedel D., Schroeder D. et al. Preoperative antiplatelet therapy does not increase the risk of spinal hematoma associated with regional anesthesia // Anesth. Analg. — 1995. — 80. — 303-9.
Schroeder D. Statistics: detecting a rare adverse drug reaction using spontaneous reports // Reg. Anesth. Pain Med. — 1998. — 23 (Suppl. 2). — 183-9.
Moen V., Dahlgren N., Irestedt L. Severe neurological complications after central neuraxial blockades in Sweden 1990–1999 // Anesthesiology. — 2004. — 102 (4). — 950-959.
Wysowsky D., Talarico L., Bacsanyi J. et al. Spinal and Epidural Hematoma and Low-Molecular-Weight Heparin // N. Engl. J. Med. — 1998. — 338 (24). — 1774-1775.
Horlocker T., Denise J. Wedel, Honorio Benzon Regional Anesthesia in the Anticoagulated Patient: Defining the Risks (The Second ASRA Consensus Conference on Neuraxial Anesthesia and Anticoagulation) // Regional Anesthesia and Pain Medicine. — 2003. — 28 (3). — Р. 172-197.
Rosencher, 2008.
Updates for Acute Pain Management: Scientific Evidence. — Australian and New Zealand College of Anaesthetists and Faculty of Pain Medicine.
Hirsh J., Chair P., Guyatt G. Antithrombotic аnd Thrombolytic Therapy, 7th Ed.: ACCP Guidelines // Chest. — 2004. — 126. — 172-173.
Hirsh J., Chair P., Guyatt G. Antithrombotic аnd Thrombolytic Therapy, 8th Ed.: ACCP Guidelines // Chest. — 2008. — 133. — 71-109.
Llau J., Andres J., Gomar C. et al. Anticlotting drugs and regional anaesthetic techniques: comparative update of the safety recommendations // EJA. — 2007. — 24. — 387-398.
www.moz.gov.ua.
Rosencher N., Bonnet M., Sessler D. Selected new antitrombotic agents and neuraxial anaesthesia for major orthopaedic surgery: management strategies // Anaesthesia. — 2007. — 62. — 1154-60.
Samama C., Albaladejo P., Benhamou D. et al. Venous thromboembolism prevention in surgery and obstetrics: clinical practice guidelines // EJA. — 2006. — 23. — 95-116.
Treasure T. (editor) Venous Thromboembolism Reducing the risk of venous thromboembolism (deep vein thrombosis and pulmonary embolism) in inpatients undergoing surgery. — National Collaborating Centre for Acute Care at The Royal College of Surgeons of England, WC2A 3PE.
Planes A. Review of bemiparin sodium — a new second-generation low molecular weight heparin and its application in venous thromboembolism // Expert Opin Pharmacother. — 2003. — 4 (9). — 1551-1561.
Planes A., Vochelle N., Gonzalez M. et al. Profilaxis antitrombotica poscirugiaortopeica con bemiparina, heparina de bajo peso molecular de segunda generacion // Rev. Anestesiol. Reanim. — 2001. — 48. — 258-263.
Abad J., Gomez-Qutes A., Martinez-Gonzales J. et al. Observational study of bemiparin, first dose administered 6 hours after surgery, in hip or knee replacement surgery // Pathophysiol. Haemost Thromb. — 2007. — 36 (Suppl. 1).
Gomez-Qutes A., Lecumberri R., Rocha E. Optimal timing of initiation of bemiparin thromboprophylaxis in total hip/knee replacement // Pathophysiol. Haemost Thromb. — 2007. — 36 (Suppl. 1).
Navaro-Quilis A., Castellet E., Rocha E. et al. Efficacy and safety of bemiparin compared with Enoxaparin in prevention of venous thromboembolism after total knee arthroplasty: A randomized double-blind clinical trial // J. Thromb. Haemost. — 2003. — 1. — 425-432.
Lecompte T., Hardy J.F. Antiplatelet agents and perioperative bleeding // Can J. Anesth. — 2006. — 53. — S103-S112.
Patrono C., Bachmann F., Baigent C. et al. Expert consensus document on the use of antiplatelet agents. The task force on the use of antiplatelet agents in patients with atherosclerotic cardiovascular disease of the European society of cardiology // Eur. Heart. J. — 2004. — 25. — 166-181.
Smith S.C., Allen J., Blair S.N. et al. AHA/ACC guidelines for secondary prevention for patients with coronary and other atherosclerotic vascular disease: 2006 update // Circulation. — 2006. — 113. — 2363-2372.
Patrono C., Coller B., Fitzgerald G.A. et al. Platelet active drugs: the relationships among dose, effectiveness and side effects // Chest. — 2004. — 126 (Suppl). — 234S-264S.
Steffel J., Luscher T.F., Ruschitzka F., Tanner F.C. Cyclooxygenase-2 inhibition and coagulation // J. Cardiovasc. Pharmacol. — 2006. — 47 (Suppl. 1). — S15-S20.
Newsome L.T., Weller R.S., Gerancher J.C. et al. Coronary artery stents. II: Perioperative considerations and management // Anesth. Analg. — 2008. — 107. — 570-590.
Spahn D.R., Howell S.J., Delabays A., Chassot P.G. Coronary artery and perioperative antiplatelet regimen: dilemma of bleeding and stent thrombosis // Br. J. Anaesth. — 2006. — 96. — 675-677.
Broad L., Lee T., Conroy M. et al. Successful management of patients with a drug-eluting coronary stent presenting for elective, noncardiac surgery // Br. J. Anaesth. — 2007. — 98. — 19-22.
Juan V. Llau, Cristina Lopez-Forte, Luisa Sapena and Raquel Ferrandis. Perioperative management of antiplatelet agents in noncardiac surgery // Eur. J. Anaesthesiol. — 26. — 181-187.
Llau J.V., De Andres J., Gomar C. et al. Anticlotting drugs and anaesthestic and analgesic techniques: an update of the safety recommendations // Eur. J. Anaesth. — 2007. — 24. — 287-298.
Horlocker T.T., Wedel D.J., Benzon H. et al. Regional anesthesia in the anticoagulated patient: defining the risks (The Second ASRA Consensus Conference on Neuraxial Anesthesia and Anticoagulation) // Reg. Anesth. Pain Med. — 2003. — 28. — 172-197.
Kozek-Langenecker S.A., Fries D., Gutl M. et al. Locoregional anesthesia and coagulation inhibitors // Anaesthetist. — 2005. — 54. — 476-484.
Despotis G., Eby C., Lublin D.M., Llau J.V., De Andres J., Gomar C. et al. Anticlotting drugs and anaesthestic and analgesic techniques: an update of the safety recommendations // Eur. J. Anaesth. — 2007. — 24. — 287-298.