Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Макролиды в лечении инфекций органов дыхания у детей
Авторы: Чернышева О.Е., Сорока Ю.А. Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье с учетом фармакокинетических свойств показана высокая терапевтическая эффективность и безопасность макролидных антибиотиков, в частности АзитроСандоз, что позволяет рекомендовать их в лечении инфекций дыхательных путей у детей.
Дети, инфекции дыхательных путей, макролиды.
Острота проблемы респираторных инфекционных заболеваний в педиатрической практике связана не только с их широким и повсеместным распространением в детской популяции, но и с риском развития серьезных осложнений, особенно у детей раннего возраста [1]. Среди возбудителей респираторных заболеваний бактерии занимают одно из ведущих мест и считаются основной причиной возникновения первичной или вторичной (поствирусной) инфекции. При острой респираторной инфекции бактериального генеза воспалительный процесс может локализоваться (изолированно или захватывать несколько отделов) в миндалинах (тонзиллит), слизистой оболочке носовой полости (ринит), глотке (фарингит), синусах (синуситы), гортани (ларингит), трахее (трахеит), бронхах (бронхит) и легких (пневмония).
Согласно исследованиям, проведенным в 2003–2006 гг., более чем в 80 % случаев этиологически значимыми бактериальными агентами в развитии внебольничных тяжелых и распространенных форм острых заболеваний органов дыхания у детей, и в частности пневмоний, сопровождающихся выраженными симптомами интоксикации и местного воспаления, остаются стрептококки (пневмококки) и гемофильная палочка [2]. Наряду с этим в патогенезе заболеваний респираторного тракта достоверно возросла роль Chlamydophilapneumonia: в виде моноинфекции Chlamydophilapneumonia определяется в 12,5 % случаев, а в сочетании с другими бактериальными агентами — у трети больных детей. У большинства больных с активным течением респираторного хламидиоза выявляются ассоциации хламидий с различными типами стрептококков [3].
При анализе данных, полученных при определении чувствительности к антибиотикам выделенных из соскобов со слизистых полости рта и мокроты микробных агентов при различных острых респираторных заболеваниях, выявлено, что наиболее часто определяемые инфекционные агенты — стрептококки, гемофильная палочка, Moraxellacatarhalis — высокочувствительны к макролидам, цефалоспоринам II, III и IV поколения, респираторным фторхинолонам. Снизилась чувствительность этиотропной флоры к пенициллинам, как незащищенным, так и защищенным, цефалоспоринам I поколения. Учитывая то, что макролиды эффективны в отношении как внеклеточных (стрептококки, гемофильная палочка, Moraxellacatarhalis), так и внутриклеточных инфекций, в частности Chlamydophilapneumonia, микоплазма, использование их в качестве стартовой терапии при осложненных формах респираторных инфекционных заболеваний, в том числе пневмониях, находит сегодня все больше сторонников [4–7]. Так, в клиническом руководстве Национального центра нормативной документации США лечение внебольничных пневмоний у детей пяти лет и старше рекомендовано проводить макролидами, а в случаях тяжелого течения заболевания сочетать их с b-лактамными антибиотиками [8].
Макролиды широко используются в клинической практике с начала 50-х годов ХХ века. Первый препарат этого класса — эритромицин А, полученный из почвенного грибка Streptomyces erythreus, был внедрен в практику в 1952 г. Спустя три года появились еще два препарата — олеандомицин и спирамицин. В первые годы клинического применения макролиды рассматривались прежде всего в качестве эффективной замены пенициллина при лечении стафилококковых инфекций, так как именно в шестидесятые годы прошлого века появились и быстро распространились пенициллинорезистентные штаммы стафилококков. Однако с появлением новых данных об этиологии инфекционных заболеваний человека (в частности, о роли так называемых атипичных возбудителей), об особенностях различных антимикробных препаратов, резистентности возбудителей к антибиотикам использование макролидов существенно расширилось, и сейчас в мире они прочно занимают 2–3-е место среди всех антибиотиков по частоте применения.
До середины 80-х годов макролиды применялись довольно ограниченно из-за низкой биодоступности, быстрой элиминации из организма и широкого распространения устойчивых к ним микроорганизмов, особенно среди стафилококков. Повторное «возрождение» макролидов и получение ряда высокоактивных и безопасных природных и полусинтетических производных с улучшенными фармакокинетическими свойствами произошло в середине 70-х — начале 80-х гг. прошлого столетия в связи с появлением новых данных об этиологии инфекционных заболеваний человека (легионеллез, Campylobacter и др.), и в частности атипичных (микоплазм, хламидий и др.) внутриклеточных возбудителей.
Последующие модификации молекулы эритромицина позволили улучшить отдельные фармакокинетические и фармакодинамические характеристики других представителей данного семейства антибиотиков, у части которых 14-членное кольцо было заменено на 15- или 16-членное. В настоящее время новые макролиды практически вытеснили эритромицин из практики применения у детей дошкольного возраста. Известно более 20 макролидных антибиотиков, из них 8 применяются в клинике. Сегодня в большинстве стран Европы (Германии, Испании, Великобритании и др.) макролиды прочно занимают первое место среди всех антибиотиков по частоте применения. Расширение антибактериального спектра макролидов нового поколения дало вторую жизнь этой группе препаратов.
Макролиды являются одним из наиболее интенсивно развивающихся классов антибиотиков за счет высокой эффективности и относительной безопасности, они имеют широкий спектр антимикробной активности и благоприятные фармакокинетические свойства, сочетают высокую эффективность в лечении инфекций и хорошую переносимость детьми. Появление в последние годы в арсенале педиатров «новых» макролидов существенно расширило возможности их использования на практике.
К макролидам относят антибиотики, в химическую структуру которых входит макроциклическое лактонное кольцо, связанное с одним или несколькими углеводными остатками. В зависимости от числа атомов углерода в лактонном кольце различают 3 основных подкласса макролидов — 14-, 15- и 16-членные макролидные антибиотики, среди них природные и полусинтетические препараты (табл. 1). 15-членные препараты правильнее называть не макролидами, а азалидами, так как в состав лактонного кольца у них включен атом азота.
Антибактериальный механизм действия у различных макролидов практически одинаков. В то же время антибактериальная активность, фармакокинетика, переносимость и взаимодействие с другими лекарственными средствами у разных макролидов различаются и зависят от особенностей их строения. Следует отметить, что при применении большинства макролидов при взаимодействии с различными лекарственными препаратами (сердечные, гипотензивные средства, антикоагулянты, антигистаминные, ксантины и др.) могут возникать побочные токсические реакции.
Макролиды считаются бактериостатическими антибиотиками. В то же время «новые» макролиды (полусинтетические антибиотики) отличаются наличием бактерицидного эффекта и большей эффективностью в отношении Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus agalactiae, гемофильной палочки, моракселлы, хламидий, микоплазм, легионелл, возбудителей коклюша и дифтерии, Campylobacter spp., Helicobacter pylori, метициллиночувствительных штаммов золотистого стафилококка. В то же время макролиды практически неактивны против грамотрицательных бактерий семейства Enterobacteriaceae, Pseudomonas spp., Acinetobacter spp.
Макролиды обладают большей кислотоустойчивостью, более высокой биодоступностью, увеличенной способностью проникать в ткани и внутрь клеток, пролонгированным действием и лучшей переносимостью.
Следует отметить, что широкое, а в ряде случаев бесконтрольное и неоправданное использование макролидных антибиотиков при различных ОРИ, в том числе и вирусной этиологии, привело к появлению среди пневмотропных возбудителей макролидоустойчивых штаммов.
Механизм действия макролидов заключается в подавлении синтеза белка в рибосомах микробов. С этим связан и постантибиотический эффект макролидов — подавление жизнедеятельности микроорганизмов, продолжающееся после прекращения контакта с антибиотиком. В основе постантибиотического эффекта лежат необратимые изменения в рибосомах чувствительных возбудителей после кратковременного воздействия макролидов. В результате этого нарушается синтез функциональных белков возбудителя, что приводит к замедлению их роста и размножения.
Кроме антибактериального эффекта макролиды обладают противовоспалительным действием — ингибируют «окислительный взрыв», угнетая выработку провоспалительных цитокинов и стимулируя противовоспалительные; снижают образование медиаторов воспаления — простагландинов, лейкотриенов и тромбоксанов. Противовоспалительное действие проявляется даже при субтерапевтических концентрациях макролидов и сравнимо с эффектом нестероидных противовоспалительных средств. 14-членные макролиды усиливают противовоспалительный эффект за счет увеличения продукции эндогенных глюкокортикоидов вследствие активации гипоталамо-гипофизарно-надпочечниковой системы [9]. Установлено также стимулирующее влияние макролидов на фагоцитоз за счет их накопления в нейтрофилах и макрофагах и усиления фагоцитарной активности и миграции в очаг воспаления. Макролиды обладают и иммуномодулирующим действием, повышая активность Т-киллеров.
«Новые» макролидные антибиотики (полусинтетические 14-членные, 15-членные — азалиды, природные и полусинтетические 16-членные макролиды) характеризуются значительно лучшей переносимостью, так как обладают по сравнению с эритромицином более низким прокинетическим эффектом. Макролиды достоверно считаются одними из самых безопасных антибиотиков, поскольку на фоне терапии ими крайне редко возникают жизнеугрожающие нежелательные лекарственные реакции. При этом установлено, что макролидные антибиотики не влияют на двигательную функцию желудочно-кишечного тракта. В результате этого при использовании «новых» макролидов у детей значительно реже отмечаются диспептические проявления.
Макролиды являются препаратами выбора при хламидийной инфекции у новорожденных, детей раннего возраста и беременных, поскольку применение тетрациклинов и фторхинолонов у них противопоказано.
Особенностью фармакокинетики макролидов является их хорошее проникновение во многие органы, ткани и среды организма. Макролидные антибиотики в высоких концентрациях накапливаются в миндалинах, легких, бронхиальном секрете, плевральной жидкости, полости среднего уха, придаточных пазухах носа и др. При этом большинство макролидов создают высокие тканевые концентрации, которые значительно превышают уровень препаратов в сыворотке крови. Кроме того, практически все «новые» макролиды имеют лучшие фармакокинетические характеристики и более продолжительный период действия, что позволяет применять их не более 2–3 раз в сутки. Следует отметить, что особенности фармакокинетики азитромицина определяют возможность его применения коротким курсом — 3–5 дней, при однократном суточном приеме.
Большинство макролидных антибиотиков метаболизируется в печени при участии оксидазной системы цитохрома Р-450. Макролиды достоверно считаются одними из самых безопасных антибиотиков, поскольку на фоне терапии ими крайне редко возникают жизнеугрожающие нежелательные лекарственные реакции. Из нежелательных проявлений очень редко отмечаются тошнота, рвота, боли в животе, реже — диарея. Противопоказаниями для назначения макролидов являются выраженные нарушения функции печени, а также повышенная индивидуальная чувствительность к макролидам.
В настоящее время имеются многочисленные свидетельства благоприятных эффектов макролидов при лечении внебольничных пневмоний. Это и сокращение госпитального этапа лечения, и снижение летальности, в том числе у пациентов с пневмококковой пневмонией, осложненной вторичной бактериемией, и уменьшение прямых затрат на проведение антимикробной химиотерапии. Эти закономерности были установлены и R.B. Brown и соавт. [11], проанализировавшими исходы 45 000 случаев внебольничных пневмоний: оказалось, что монотерапия макролидами сопровождается наименьшими показателями летальности (2,2 %) по сравнению с назначением других антибиотиков (цефтриаксон, другие цефалоспорины, фторхинолоны, пенициллины) — > 5 %. Назначение же макролидов в комбинации с цефтриаксоном характеризуется снижением риска летального исхода на 30–60 % по сравнению с монотерапией b-лактамами или фторхинолонами. Подобная комбинация сопровождается также сокращением госпитального этапа лечения и снижением прямых затрат на лечение (на $1800–3400) по сравнению с альтернативными направлениями терапии.
Для объяснения столь «демонстративного» превосходства макролидов, назначаемых в рамках моно- или комбинированной терапии, над другими режимами антимикробной химиотерапии у больных внебольничной пневмонией следует, очевидно, помимо антибактериального эффекта в отношении хламидий, привлечь и их неантибактериальную (противовоспалительную или иммуномодулирующую) активность.
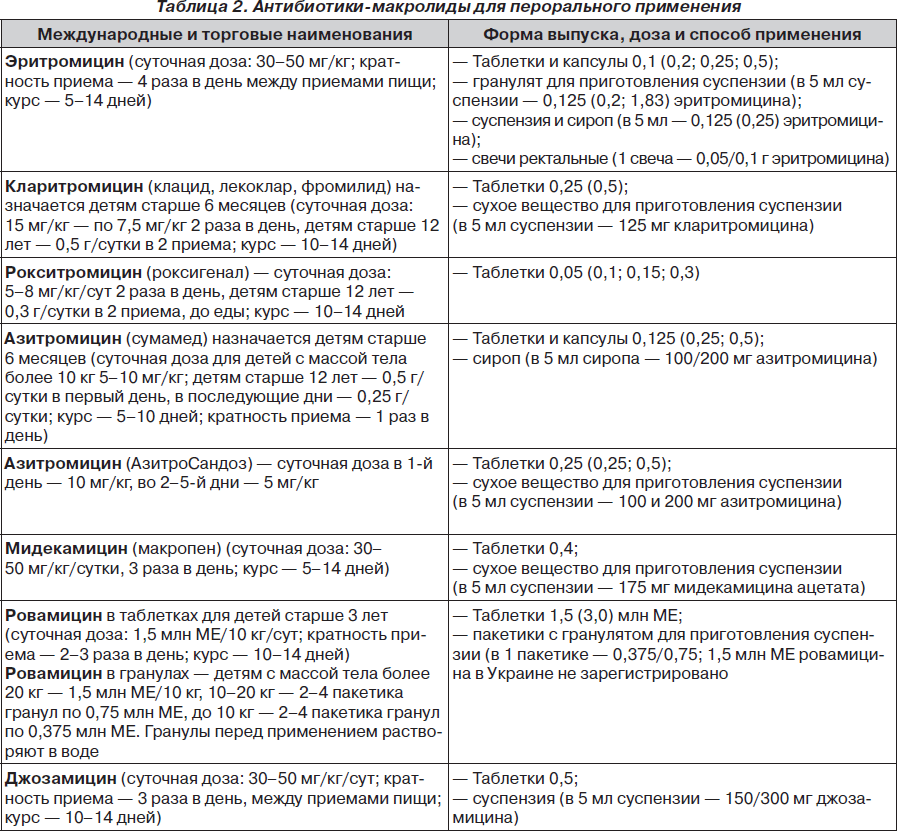
Макролиды (табл. 2) рекомендуется использовать у детей в качестве стартовой терапии при лечении атипичных инфекций органов дыхания (микоплазменные и хламидийные бронхиты и пневмонии), а также в тех случаях, когда имеется непереносимость бета-лактамных антибиотиков (чаще всего – аллергия на пенициллины).
Некоторые макролиды имеют формы для парентерального введения (эритромицин, кларитромицин, азитромицин), что делает возможным их применение в неотложных ситуациях, а также при проведении ступенчатой терапии.
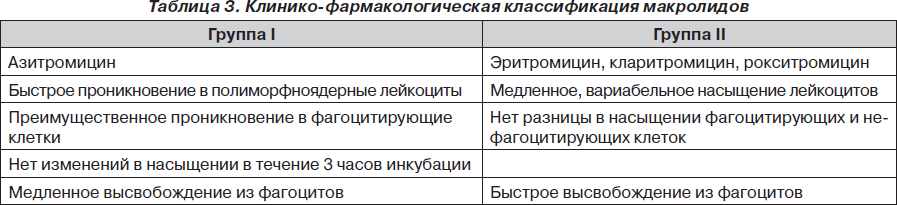
На состоявшемся в июне 2006 г. в Лиссабоне 12-м Международном конгрессе по инфекционным заболеваниям и антимикробной химиотерапии (12th ICID congress) на обсуждение была выдвинута привлекательная своей практической направленностью клинико-фармакологическая классификация макролидов (табл. 3). Предлагается разделить антибиотики этого класса на 2 группы согласно их внутриклеточной фармакодинамике. Препараты 1-й группы проникают внутрь лейкоцитов быстрее и медленнее высвобождаются в очаге инфекции, но, что принципиально важно, они задействуют только фагоцитирующие клетки в отличие от антибиотиков второй группы. Таким образом, создаются предпосылки для адресного точечного воздействия на очаг воспаления, что, по мнению экспертов, свидетельствует о меньшем воздействии на неинфицированные ткани. Конечно, степень высвобождения любого макролида в десятки раз выше в присутствии инфекционного фактора, чем в интактной ткани, тем не менее ограничение поступления ксенобиотика туда, где он не нужен в данный момент, — дополнительный «кирпичик» в фундамент безопасности при лечении декретированных категорий больных — беременных женщин, детей, лиц с иммунодефицитами.
Учитывая локальную направленность азалидов на пораженные органы, высокую биодоступность, безопасность применения у детей даже раннего возраста (препараты одобрены Администрацией США по продуктам питания и лекарственным средствам для использования у детей в возрасте 6 месяцев и старше [12]), использование азитромицина в последние годы получило очень широкое распространение в педиатрии.
Среди сравниваемых макролидов азитромицин обладает наибольшей активностью и против грамотрицательных микроорганизмов (МПК90 < 8 мкг/мл для различных типов сальмонелл, шигелл, менингококков, гонококков, моракселл). Он превосходит по степени активности другие препараты и в отношении Н.influenzae.
Исключительно важным вопросом является не только стимуляция иммунного ответа на фоне текущей инфекции, но и прекращение активации иммунитета по мере стихания воспалительного процесса. С этой точки зрения уникальны возможности азитромицина. После санации инфекции он фактически останавливает потенцирование иммунитета. Азитромицин в этот период активирует апоптоз (биологически запрограммированную гибель) нейтрофилов [13], что останавливает процессы локального повреждения и предупреждает клетки хозяина от потенциального вовлечения в уже становящийся ненужным иммунный ответ [14].
Использование азитромицина в педиатрической практике выявило еще один положительный аспект — низкую частоту побочных эффектов (сыпи, тошноты, диареи). Кроме того, суспензия азитромицина приятна на вкус, легко дозируется и разводится до необходимой консистенции, что позволяет вводить ее через зонд при отсутствии у ребенка сосательного рефлекса.
В настоящее время среди макролидов особым вниманием пользуется АзитроСандоз (Sandoz, Швейцария), антибактериальное средство, широко используемое как в педиатрии — у детей после шести месяцев жизни, так и во взрослой практике. АзитроСандоз — это единственный на украинском рынке препарат азитромицина, который можно принимать независимо от приема пищи, даже во время еды. Формы выпуска — таблетки по 250 и 500 мг и в суспензии — по 100 и 200 мг азитромицина в 5 мл раствора.
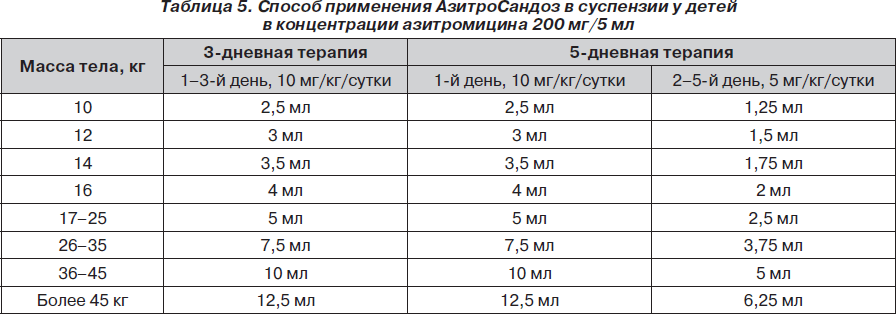
Способ применения и дозирование АзитроСандоз. Взрослым по 500 мг в сутки в течение 3 дней или 500 мг в первый день и в последующие 4 дня по 250 мг. Детям — из расчета 10 мг/кг в сутки один раз на протяжении 3 дней или 10 мг/кг в сутки в первый день с переходом на 5 мг/кг в последующие 4 дня.
Методика применения АзитроСандоз в зависимости от концентрации суспензии представлена в табл. 4, 5.
Проведенное профессором Е.Н. Охотниковой исследование эффективности препарата АзитроСандоз детям от 6 месяцев до 15 лет с респираторной бактериальной патологией (внебольничные пневмонии, заболевания верхних и нижних дыхательных путей) свидетельствует о высокой эффективности антибиотика в 93,4 % при минимальном количестве отрицательных побочных реакций [15].
Включение макролидов в перечень препаратов выбора при пневмониях у детей связано с возрастанием этиологической роли микоплазменной и хламидофильной инфекции. В остальных случаях — при ангинах, фарингитах, рецидивирующих бронхитах, а также при пневмониях макролиды рассматриваются как альтернативные антибактериальные средства, которые могут быть назначены в случае отсутствия эффекта от стартовой терапии, а также при развитии побочных и нежелательных явлений, связанных с применением препаратов первого ряда.
Таким образом, применение макролидов, в частности АзитроСандоз, показано детям при заболеваниях бактериальной этиологии (стрептококки, стафилококки, гемофильная палочка, хламидии, микоплазма) как верхних дыхательных путей и ЛОР-органов (тонзиллофарингит, синусит, отит), дифтерии, коклюше, так и нижних (рецидивирующий бронхит, пневмония).
1. Острые респираторные заболевания у детей: лечение и профилактика. Научно-практическая программа Союза педиатров России. — М.: Международный Фонд охраны здоровья матери и ребенка, 2002. — 69 с.
2. Юлиш Е.И., Коринева Л.С. Изменение этиологической структуры возбудителей внебольничных пневмоний и их чувствительности к антибиотикам у детей в течение пяти лет (2001–2006 гг.) // Здоровье ребенка. — 2006. — № 2. — С. 11-16.
3. American Thoracic Society. Guidelines for the management of adults with comrnunityacquired pneumonia. Diagnosis, assessent of severity, antimicrobial therapy, and prevention // Am. J. Respir. Crit. Care. Med. — 2001. — № 163. — P. 1730-1754.
4. Михайлов И.Б., Маркова И.В. Антибактериальная терапия заболеваний дыхательных путей в детской амбулаторной практике. — СПб.: Санкт-Петербургское медицинское издательство, 2002. — 17 с.
5. Таточенко В.К., Середа Е.В., Федоров А.М., Катосова Л.К., Самсыгина Г.А., Дементьева Г.М., Страчунский Л.С. Антибактериальная терапия пневмоний у детей // Антибиотики и химиотерапия. — 2000. — 5. — 33-40.
6. Bartlett J.G. Management of respiratory tract infection. — 3rd еd. — Philadelphia, 2001. — 178-82.
7. Хенд В.Л., Хенд Д.Л. Механизмы накопления и выброса азитромицина в полиморфноядерных лейкоцитах человека // Антибиотики и химиотерапия. — 2002. — № 7 (47). — C. 6-12.
8. Руководство по лечению пневмоний у детей // Therapia — Український медичний вісник. — 2007. — № 1. — С. 5-8.
9. Захарова Н.В. Кларитромицин — стандартный компонент антихеликобактерной терапии // Экспериментальная и клиническая гастроэнтерология (Материалы 10-го Российского национального конгресса «Человек и лекарство», апрель 2003). — 2003. — С. 10-12.
10. Brown R.B., Iannini P., Gross P. et al. Impact of initial antibiotic choice on clinical outcomes on community-acquired pneumonia: analysis of a hospital claims-made database // Chest. — 2003. — 123. — 1503-1511.
11. Tahan F., Ozcan A., Koc N. Clarithromycin in the treatment of RSV bronchiolitis: A double-blind, randomized, placebo-controlled trial // Eur. Respir. J. — 2006.
12. Langtry H., Balfour J. Azithromycin, a review of its use in paediatric infectious diseases // Drugs. — 1998. — 56. — 273-297.
13. Kadota J., Mizunoe S., Kishi K. et al. Antibiotic-induced apoptosis in human activated peripheral lymphocytes // Int. J. Antimicrob. Agents. — 2005. — 25 (3). — 216-20.
14. Kolling U.K., Hansen F., Braun J. et al. Leucocyte response and anti-inflammatory cytokines in community-aquired pneumonia // Thorax. — 2001. — 56. — 121-5.
15. Охотникова Е.Н., Поночевная Е.В., Усова Е.И. и др. Азитро Сандоз в лечении заболеваний респираторной системы у детей // Здоровье Украины. — 2010. — № 1. — С. 41.