Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Клінічні особливості та фактори ризику розвитку хелікобактерної інфекції в дітей залежно від імунної відповіді дитини
Авторы: Абатуров О.Є., Герасименко О.М., Степанова Ю.Ю. Дніпропетровська державна медична академія
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті наведені дані щодо клініко-ендоскопічних особливостей хронічної H.pylori-асоційованої гастродуоденальної патології та медико-біологічні фактори ризику формування хелікобактерної інфекції в дітей залежно від імунної відповіді макроорганізму. Використано послідовний аналіз Вальда, на основі якого розроблено математичну модель прогнозу ймовірності розвитку хелікобактерної інфекції в дітей.
Хелікобактерна інфекція, діти, прогноз ймовірності розвитку, фактори ризику.
Вступ
Відкриття в 1983 р. австралійськими вченими R. Warren і B. Marshall мікроорганізму Helicobacter pylori (HP) радикально змінило науковий погляд на патогенез як гастродуоденальних, так і позагастральних захворювань людини [3, 8]. На сьогодні доведено роль HP у розвитку й прогресуванні ряду захворювань, а численні епідеміологічні дослідження свідчать про високу поширеність хелікобактерної інфекції, насамперед у дітей. Бактерія НР має розвинені складні захисні механізми, що дозволяють їй уникати агресивного впливу шлункового соку, виживати в слизовій оболонці шлунку (СОШ), прикріплятися до шлункового епітелію і взаємодіяти як з ним, так і з імунними клітинами господаря [1, 7, 8]. Клінічний перебіг хелікобактерної інфекції залежить як від наявності і особливості цитотоксичних генів штамів збудника, так і від відповідної реакції макроорганізму на інфікування. Найбільш вивченим фактором патогенності НР є «острівець» патогенності генів (Сag-PAI), вбудований у геном найбільш вірулентних штамів НP, та його маркер — цитотоксин-асоційований ген A (cytotoxic-associated gene) — СagА [3, 8]. Реакція організму на інвазію НР супроводжується продукцією специфічних анти-CagA-IgA, M, G антитіл, що зумовлюють розвиток механізмів запального процесу. У розвитку конкретної нозологічної форми хелікобактерної інфекції беруть участь не лише фактори патогенності НР, велику роль також відіграють медико-біологічні та інші фактори організму інфікованого господаря. Цим пояснюється розвиток широкого спектра Н.pylori-асоційованих захворювань — починаючи від безсимптомного носійства і закінчуючи розвитком злоякісних пухлин шлунка, стравоходу і дванадцятипалої кишки (ДПК), позагастральних проявів [2, 7].
Мета дослідження: визначення клінічних особливостей та інформаційної значущості медико-біологічних факторів ризику формування хелікобактерної інфекції в дітей залежно від імунної відповіді макроорганізму.
Матеріали та методи дослідження
Під спостереженням перебувало 217 дітей віком від 4 до 17 років із хронічною асоційованою з НР гастродуоденальною патологією в стадії загострення. Усім хворим дітям для верифікації діагнозу поряд із з’ясуванням скарг і анамнезу захворювання, фізикальним оглядом, загальноклінічним лабораторним обстеженням проведено ендоскопічне дослідження стравоходу, шлунка та дванадцятипалої кишки (ФЕГДС) апаратом Pentax FG-15W (Японія) за загальноприйнятою методикою з узяттям біоптатів (2) слизової оболонки антрального відділу шлунка. При проведенні ФЕГДС вираженість змін у стравоході, шлунку, ДПК оцінювали залежно від поширеності гіперемії слизової оболонки шлунка та ДПК (вогнищева або дифузна), наявності пастозності або набряку, дефектів слизової оболонки, рубцево-виразкової деформації цибулини ДПК, гастроезофагеального і дуоденогастрального рефлюксів, а також оцінювали тонус кардіального сфінктера, воротаря. Визначення в сироватці венозної крові сумарних імуноглобулінів (IgМ, IgA, IgG) до антигену (Ag) СаgА білка HР проводили методом імуноферментного аналізу (ІФА). Використовували діагностичні тест-системи «ХелікоБест-антитіла» компанії «Вектор-Бест» (Росія). Результати ІФА реєструвалися за допомогою спектрофотометра, вимірювалася оптична щільність (ОЩ) у двохвильовому режимі. Оцінку результатів ІФА проводили з врахуванням ОЩ сироватки крові і титру антитіл за схемою: від 0 до 0,05 — менше 1 : 5 (сумнівний); від 0,05 до 2 — 1 : 5 (слабопозитивний); від 2 до 3 — 1 : 10 (позитивний); від 3 до 6 — 1 : 20 (позитивний); від 6 до 9 — 1 : 40 (різко позитивний); більше 9 — 1 : 80 (різко позитивний).
Статистична обробка отриманих даних була проведена за допомогою статистичних програм Statgraf, Matstat, послідовного аналізу Вальда. За допомогою математичної програми нами були оброблені 76 параметрів, які включали медико-біологічні та соціально-гігієнічні показники розвитку дитини у перинатальному та постнатальному періодах, показники фізичного розвитку, фонові стани раннього віку, наявність хронічних вогнищ інфекції (аденоїдні вегетації, тонзиліт та ін.), клінічні прояви та результати ендоскопічного дослідження. При вивченні значущості відмінностей статистичних вибірок використовувались параметричні і непараметричні критерії. Критерій відносного ризику (ВР) визначали за формулою: ВР = fб(1 – – fл)/fк(1 – fб), де fб — частота зустрічальності ознаки в пацієнтів із CagA«+» штамами НР, f — частота зустрічальності ознаки у пацієнтів з CagA«–» штамами HР. Вірогідність розходжень оцінювалася за допомогою t-критерію Стьюдента для даних із нормальним розподілом. При розподілі, відмінному від нормального, використовували критерій Манна — Уїтні [4–6].
Результати дослідження та їх обговорення
Усі діти, які знаходились під наглядом і були обрані методом випадкових чисел, були розподілені на дві групи залежно від показників сумарних анти-CagA-IgA, M, G HР. Основна група — 112 (51,6 %) дітей, які мали в крові високі позитивні титри сумарних анти-CagA-IgA, M, G HР в діагностичній концентрації (1 : 5–1 : 80) і були інфіковані токсигенними, асоційованими з CagA«+» штамами HР. У групу порівняння увійшли 105 (48,4 %) пацієнтів, у яких антитіла до CagA Ag НР були присутні в дуже низьких титрах (< 1 : 5).
За статтю та віком відмінностей в основній та групі порівняння не відзначалося. Хлопчики в основній групі дітей склали 56,3 %, у групі порівняння — 53,3 %; дівчатка — відповідно 43,7 і 46,7 %. Середній вік дітей у групі з високими позитивними титрами анти-CagA-IgA, M, G склав 13,48 ± 0,62 року, у групі порівняння — 12,76 ± 0,38 року. У той же час відзначено зростання ризику інфікування CagА«+» штамами HP віком 12,7–17,0 року (ВР = 1,42).
Максимальна частота загострень хронічної гастродуоденальної патології у групі дітей з високими позитивними титрами антитіл до CagA Ag НР реєструвалася взимку (52,0 %), практично з однаковою частотою навесні (20 %), влітку (16 %) і восени (12 %). У групі порівняння найбільша питома вага загострень відзначалася в осінньо-зимово-весняні періоди (33,9; 27,4; 25,85 % відповідно), мінімальна — влітку (12,9 %). У той же час значний ризик формування хелікобактерної інфекції виявлявся в тих дітей, у яких хронічна гастродуоденальна патологія реєструвалася влітку (ВР = 4,25).
Клінічні особливості гастродуоденальної патології у дітей були взаємопов’язані з рівнем анти-CagA-IgA, M, G та проявлялися різноманітно — від різкого частого болю в животі до розлитого, без чіткої локалізації з вираженими диспептичними явищами (нудота, відрижка, тяжкість у шлунку після їжі та ін.), астеновегетативною дисфункцією до малосимптомного перебігу. Проте наявність виразковоподібного характеру болю навіть при відсутності ерозивного ураження СОШ або ДПК та інтенсивність больового синдрому були більш вираженими в дітей із високими позитивними титрами анти-CagA-IgA, M, G на відміну від групи порівняння, діти якої частіше скаржилися не на біль, а на тяжкість, відчуття розпирання, дискомфорту в епігастральній ділянці. Так, серед дітей основної групи біль був вираженим або дуже вираженим у 67 (59,8 %), помірним — у 26 (23,2 %), мінімальним — у 19 (17,0 %) пацієнтів на відміну від дітей із низькими титрами анти-CagA-IgA, M, G (у 9 (8,6 %), 63 (60,0 %) та 33 (31,4 %) дітей відповідно). Диспептичні симптоми були також більш вираженими в дітей основної групи: частіше зустрічалися такі ознаки диспепсії, як зниження апетиту, відрижка кислим, печія і нестійкість випорожнень — чергування запору і послаблення. Високо позитивні титри анти-CagA-IgA, M, G (1 : 40–1 : 80) при проведенні кореляційного аналізу асоціювалися з тривалістю і тяжкістю больового і диспептичного синдромів (r = 0,35 і r = 0,40 відповідно).
Ендоскопічні особливості хелікобактер-асоційованої гастродуоденальної патології також були взаємопов’язані з рівнем антитіл до CagA Ag НР: чим вищим був титр анти-CagA-IgA, M, G (1 : 40–1 : 80), тим більш вираженим був запальний процес в СОШ та ДПК Так, у групі дітей із високими позитивними титрами антитіл до CagA Ag НР частіше зустрічались виразково-деструктивні зміни слизової оболонки шлунка та ДПК — гастрит ерозивний та гастрит дифузний поверхневий (r = 0,35), бульбіт ерозивний та бульбіт дифузний поверхневий (r = 0,36); лімфофолікулярна гіперплазія та наявність каламутного слизу в просвіті шлунка.
Висока питома вага інвазії лямбліями відзначена у 52,7 % дітей основної групи на відміну від групи порівняння — 13,3 %. Наявність лямбліозу знаходилась у прямому кореляційному зв’язку з різко позитивними (1 : 40) титрами анти-CagA-IgA, M, G дітей (r = 0,46), і прогностичне значення даного паразитоза для формування хелікобактерної інфекції у дітей було значним, відносний ризик склав 2,52. Позитивні титри антитіл до CagA Ag НР супроводжувались більш низьким рівнем еритроцитів та Hb (r = –0,39)
Встановлено медико-біологічні та соціально-гігієнічні фактори, що визначають ризик розвитку хелікобактерної інфекції у дітей.
Найбільший відносний ризик розвитку хелікобактерної інфекції спостерігався в дітей, які народилися недоношеними (ВР = 5,62), з масою тіла менше 3000 г (ВР = 1,51), були на штучному вигодовуванні (ВР = 2,81). Однак при тривалому грудному вигодовуванні (24,3–36,0 місяця) ВР розвитку хелікобактеріозу становив 3,15. Спадкова обтяженість за гастроентерологічною хронічною патологією, особливо по лінії матері, аномалії конституції, такі як ексудативно-катаральний і лімфатичний діатез, що проявляються на першому році життя, прояви алергічної реакції в анамнезі на алергени рослин збільшують надалі в цих дітей ризик формування хелікобактерної інфекції (відносний ризик 1,50; 1,30 і 2,36 відповідно).
Значний ризик формування в дитини надалі хелікобактерної інфекції визначали перенесені раніше оперативні втручання (ВР = 5,67), хронічний тонзиліт (ВР = 3,64), дизметаболічна нефропатія (ВР = 3,54).
Висока частота перинатального ураження ЦНС (ПУЦНС) відзначалася як у групі дітей із високими позитивними титрами антитіл до CagA Ag НР (83,3 %), так і в групі порівняння (91,7 %), однак впливу на ризик розвитку хелікобактерної інфекції ПУЦНС практично не мало (ВР = 0,87).
Велику питому вагу серед соціальних факторів ризику мали професійні шкідливості батьків (11,5 %) і куріння (38,8 % батьків і 14,3 % матерів) без вірогідного розходження в групах дітей як із високими, так і з низькими позитивними титрами антитіл до CagA Ag НР. Конфліктна ситуація спостерігалася в сім’ях у 39,6 % дітей практично з однаковою частотою як у дітей із високими позитивними титрами антитіл до CagA Ag НР, так і в групі порівняння. Певний вплив на ризик формування хелікобактерної інфекції в дітей мали освіта батьків, матеріально-побутові умови сім’ї, метраж квартирної площі. Так, відносний ризик формування хелікобактерної інфекції становив 1,48 за наявності 2,0–4,6 м2 житлової площі на людину, а за наявності 8,0–10,0 м2 ВР = 0,60.
Для прогнозування вірогідності розвитку хелікобактерної інфекції у дітей нами були використані розрахункові методи, які добре себе зарекомендували [1, 2, 4], зокрема послідовний аналіз Вальда (табл. 1). У таблицю прогнозу увійшли тільки показники, що мають високоінформативне навантаження. Принцип роботи з прогностичною таблицею полягає в складанні прогностичних коефіцієнтів (ПК), відповідних виявленим ознаками у даного пацієнта. Коли сума ПК досягає рівня 6 балів, ймовірність формування хелікобактерної інфекції у дітей дорівнює 80 %, 9,5 бала — 90 %, 13 балів — 95 %.
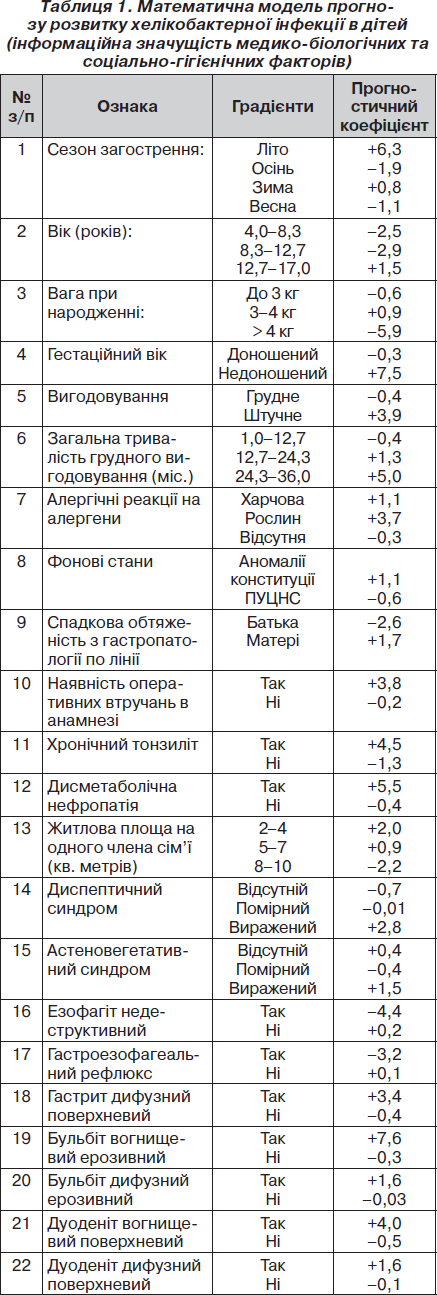
При проведенні випробувань математичної моделі прогнозу розвитку хелікобактерної інфекції у дітей, що відбувались за рекомендаціями В.В. Двойріна, А.А. Кліменкова [6], були отримані наступні значення показників її ефективності: чутливість — 89,4 %, специфічність — 86,3 %, тест прогнозування позитивного результату — 85,1 %, тест прогнозування негативного результату — 85,3 %.
Висновки
1. Інтенсивність клінічних ознак і тяжкість запальних змін у слизовій оболонці шлунка і дванадцятипалої кишки при хелікобактерній інфекції в дітей асоційована з рівнем специфічної імунної відповіді на фактор вірулентності СаgA Helicobacter pylori.
2. Високі показники чутливості, специфічності, прогнозу позитивного і негативного результату розробленої математичної моделі для прогнозування ймовірності розвитку хелікобактерної інфекції у дітей, простота використання, що не потребує додаткового забезпечення, дозволяють рекомендувати її для використання в практичній діяльності лікарів-педіатрів
1. Абатуров О.Є., Герасименко О.М. Клініко-ендоскопічні особливості гастродуоденальної патології, асоційованої з СagА-позитивними штамами Helicobacter pylori, у дітей // Сучасні медичні технології. — 2009. — № 3. — С. 5-10.
2. Абатуров О.Є., Герасименко О.М. Медико-біологічні фактори ризику розвитку хелікобактерної інфекції у дітей // Современная педиатрия. — 2010. — № 1. — С. 117-120.
3. Абатуров О.Є., Герасименко О.М. Чинник вірулентності CagA Helicobacter pylori і перебіг хронічної гастродуоденальної патології у дітей // ПАГ. — 2009. — № 5(435). — С. 5 (Матеріали VI конгресу педіатрів України «Сучасні проблеми клінічної педіатрії», 14–16 жовтня 2009 р., м. Київ).
4. Гублер Е.В. Математические методы анализа и распознавания патологических процессов. — Л.: Медицина, 1978. — 294 с.
5. Гублер Е.Н., Генкин А.А. Применение непараметрических методов статистики в медико-биологических исследованиях. — Л.: Медицина, 1973. — 141 с.
6. Двойрин В.В., Клименков А.А. Методика контролируемых испытаний. — М.: Медицина, 1985. — 144 с.
7. Мишкина Т.В., Александрова В.А., Суворов А.Н. Влияние различных генотипов Нelicobacter pylori на клинико-эндоскопические и морфологические проявления хронических гастродуоденальных заболеваний у детей и подростков // Педиатрия. — 2007. –Т. 86, № 5. — С. 28-32
8. Manuel R. Amieva, Emad M. El-Omar. Нelicobacter pylori. Взаимодействие хозяина и инфекции // Клиническая гастроэнтерология и гепатология. Украинское издание. — 2008. — Т. 1, № 2. — С. 91-107.
