Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Ротавирусная инфекция: эпидемиология и профилактика
Авторы: Крамарев С.А., Закордонец Л.В. Национальный медицинский университет имени А.А. Богомольца, г. Киев
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье приведены эпидемиологические данные, касающиеся ротавирусной инфекции, сделан акцент на применении вакцин в качестве приоритетного направления профилактики. В настоящее время в мире существует две вакцины против ротавирусов: пентавалентная живая ослабленная вакцина (RotaTeq, Merck) и моновалентная живая ослабленная вакцина (Rotarix™, GlaxoSmithKline). В Украине зарегистрирована вакцина Ротарикс™. Она обеспечивает защиту на 73–89 % против ротавирусных гастроэнтеритов и на 86–100 % против развития тяжелых форм заболевания.
Ротавирусная инфекция, профилактика, вакцина, Ротарикс™.
Острые кишечные инфекции (ОКИ) занимают ведущее место в структуре детской заболеваемости и смертности. Ежегодно в мире ОКИ являются причиной смерти более 1 миллиона детей [14]. Сегодня ротавирусы рассматриваются как основной этиологический фактор возникновения ОКИ, особенно у детей раннего возраста. По данным ВОЗ, ежегодно в мире регистрируется около 138 миллионов случаев ротавирусной инфекции. Летальность от ротавирусной инфекции колеблется от 454 до 705 тысяч случаев в год и в среднем составляет 611 тысяч случаев [13].
Наивысшая летальность регистрируется в странах Южной Азии, Индии, Африки, Латинской Америки — 360 800 случаев, что составляет 82 % от общего количества летальных случаев. В развитых странах Европы, Южной Америки, Австралии летальность от ротавирусной инфекции в последние годы снижается, однако уровень заболеваемости остается достаточно высоким.
Большая часть случаев ротавирусной инфекции протекает в легкой форме, однако при отсутствии адекватных лечебных мероприятий состояние детей может быстро ухудшаться и закончиться смертью.
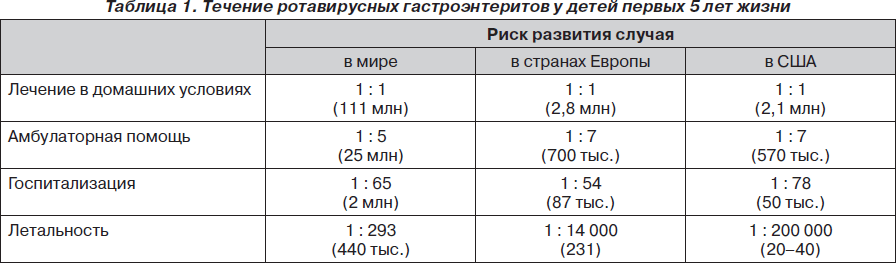
В мире 111 миллионов эпизодов заболевания имеют легкое течение, и дети лечатся дома, 25 миллионов случаев имеют течение средней тяжести, и дети нуждаются в амбулаторной помощи, 2 миллиона случаев протекают в тяжелой форме с необходимостью госпитализации детей.
В странах Европы ежегодно регистрируется до 3,6 миллиона случаев ротавирусной инфекции среди детей младше 5 лет. В домашних условиях получают лечение 2,8 миллиона детей, 700 тысяч требуют амбулаторной помощи и 87 тысяч детей с ротавирусным гастроэнтеритом нуждаются в госпитализации в связи с тяжелым течением заболевания. Летальный исход наблюдался у 231 ребенка.
В США ежегодно регистрируется 2 700 000 случаев ротавирусной инфекции у детей раннего возраста, из них в 50 000 случаев проводится госпитализация, и смертельный исход наблюдается у 20–40 детей. Особенности течения ротавирусных гастроэнтеритов у детей первых 5 лет жизни в мире, странах Европы и США приведены в табл. 1 (по данным M. Soriano-Gabarro, 2006).
Как видно из табл. 1, летальность вследствие ротавирусной инфекции в странах Европы значительно меньше в сравнении со средним уровнем летальности в мире, что обусловлено доступностью регидратационной терапии и медицинской помощи. Летальные исходы у детей в странах Европы наблюдались, когда дети в течение 3–4 дней получали регидратационную терапию дома, однако ее интенсивность была неадекватной, а тяжесть состояния детей не была оценена своевременно [16]. Низкий уровень летальности в США объясняют критериями регистрации случаев: не учитывались случаи смерти дома и до начала лечения в стационаре [15].
На протяжении последних лет наблюдается увеличение соотношения ротавирусов в структуре причин ОКИ среди госпитализированных детей [3, 13]. По данным U. Рarashar, 2006, в мире за период с 1986 по 1999 г. ротавирусы обнаруживали у 22 % госпитализированных детей с ОКИ, а на протяжении 2000–2004 годов — у 39 % детей. Распространению ротавирусной инфекции способствует устойчивость возбудителя во внешней среде, невозможность влиять на его распространение санитарно-гигиеническими методами, отсутствие специфической этиотропной терапии. Иногда увеличение выявляемости вируса среди причин ОКИ объясняют улучшением лабораторной диагностики [3].
В Украине статистический учет случаев ротавирусной инфекции начал проводится лишь в начале 90-х годов ХХ века [2]. Показатели заболеваемости в отдельные годы колебались от 0,94 до 3,18 на 100 тысяч населения. Однако реальная заболеваемость ротавирусными гастроэнтеритами значительно превышает эти показатели вследствие ограничений вирусологической диагностики, а при смешанных вирусно-бактериальных инфекциях обычно ограничиваются определением только бактериального возбудителя [2].
Вирусологические и санитарно-вирусологические исследования, проведенные в разных регионах Украины, России и Белоруссии, свидетельствуют об увеличении загрязнения природных вод, а также питьевой воды в водопроводной сети ротавирусами, что является одной из ведущих причин увеличения заболеваемости населения ОКИ и возникновения водных вспышек ротавирусной инфекции, с вовлечением в эпидемический процесс большого количества людей разных возрастных групп [2].
В Киеве заболеваемость ротавирусной инфекцией носит спорадический характер. За последние 5 лет показатели заболеваемости колебались от 0 (в годы, когда лабораторные исследования не проводились) до 6,1 случая на 100 тысяч населения (когда вирусологическое обследование больных ОКИ проводилось в достаточном объеме). В такие годы уровни заболеваемости были выше, чем в целом по Украине. Заболеваемость среди детей значительно превышала заболеваемость ротавирусной инфекцией у взрослого населения. Показатели заболеваемости среди детей города Киева в разные годы колебалась в пределах от 0,2 до 30,7 на 100 тысяч населения, с наибольшим уровнем среди детей до 2 лет (от 0,9 до 163,2 на 100 тысяч детей этой возрастной группы).
Наибольший уровень заболеваемости ротавирусной инфекцией во всех странах наблюдается у детей в возрасте от 6 месяцев до 2 лет жизни [2, 15]. До 90,0 % детей в возрасте 3 лет имеют антитела против ротавирусов. После перенесенного заболевания выделение вирусов может сохраняться до 25–27 дней. Описаны также случаи длительной ротавирусной инфекции [1]. Дети с длительной незначительно выраженной диареей выделяли возбудителя до 66–450 дней. Это связано с реинфекцией и недостаточностью лактозы у детей, которые перенесли ротавирусный гастроэнтерит [1].
Ротавирусы — наиболее частая причина внутрибольничной инфекции, особенно у детей раннего возраста. От 9,6 до 69 % нозокомиальных ОКИ связывают с ротавирусами [1, 3, 11]. До 50–70 % новорожденных детей выделяют ротавирусы [1–3]. Частота внутрибольничной ротавирусной инфекции объясняется высокой устойчивостью возбудителя к обычным дезинфектантам, легкостью передачи через загрязненные руки, игрушки, медицинский инструментарий, низкой дозой, необходимой для инфицирования (10–100 вирусных частиц) [14]. Инфицированию детей, особенно новорожденных, способствует вирусоносительство среди медицинского персонала (до 20 % персонала выделяют ротавирусы), среди беременных женщин (у 25 % из них выделяют ротавирусы в фекалиях и у 8,8 % — в цервикальном секрете) и других детей (25–50 % детей в возрасте до 24 месяцев жизни, госпитализированных с разной патологией, выделяют ротавирусы при отсутствии нарушений со стороны кишечника) [1, 3].
Сезонное увеличение заболеваемости ротавирусными гастроэнтеритами приходится на зимний период. В этом периоде также увеличивается количество детей с бронхиолитами и гриппом, что представляет дополнительные трудности для медицинских работников и может способствовать возникновению внутрибольничных вспышек ротавирусной инфекции [16].
Длительность лечения больных ротавирусной инфекцией в стационаре колеблется от 3 до 10 дней. T. Vesikari считает, что регидратацию лучше проводить амбулаторно, в условиях стационара сразу после стабилизации состояния больного выписывать домой. Это должно уменьшить риск возникновения внутрибольничного инфицирования неинфицированных детей [17].
По группоспецифическому антигену (VP6) все ротавирусы распределяются на 7 серогрупп (A, B, C, D, E, F, G) [5]. До 98 % ротавирусных диарей у детей вызываются ротавирусами серогруппы А [4, 5]. Внутри группы А различают подгруппы (по строению VP7) и серотипы (по строению VP4) [4]. Происходит постоянная смена антигенного строения вируса между сезонами и между разными регионами. Наиболее частой причиной ротавирусного гастроэнтерита в развитых странах являются серотипы G1, G2, G3, G4, серотип G9 встречается в развитых и развивающихся странах [9].
От повторных случаев заболевания защищают вирус-специфические антитела, которые образовываются в организме ребенка при попадании возбудителя. Вирус-специфические секреторные антитела IgA сохраняются в организме до 2 лет после перенесенного заболевания, с последующим снижением уровня. Секреция вирус-специфических IgA и IgM зависит от возраста ребенка и лишь частично снижает тяжесть повторных случаев заболевания. Высокий уровень IgG в плазме крови надежно предупреждает развитие тяжелых форм ротавирусных диарей у детей в будущем [19].
После первого эпизода ротавирусной инфекции у ребенка формируется частичная защита против повторных инфекций на 1–2 года. Гетерогенность ротавирусов и нестойкий уровень иммунитета объясняют появление повторных случаев заболевания. Вероятность повторного заражения ребенка на первом году жизни составляет до 30 % [3]. Случаи реинфицирования одним серотипом ротавируса на протяжении одного сезона не описаны. А через год после перенесенной первичной инфекции регистрировались случаи ротавирусной диареи, которые были вызваны тем же самым серотипом [6]. Существует зависимость между уровнем напряжения иммунитета и формой заболевания. При перенесенном заболевании в средней или среднетяжелой форме 100% защита от повторных заражений формируется уже после второго случая. От первого до третьего эпизода ротавирусной диареи в легкой форме защита от реинфекции увеличивается от 73 до 99 %. После первого случая бессимптомной инфекции защита обеспечивается лишь на 38 %, а после третьего эпизода — на 74 % [6]. Таким образом, реинфекция обеспечивает формирование напряженного иммунитета с защитой против ротавирусной инфекции в будущем. Взрослое население если и болеет ротавирусной инфекцией, то лишь в легкой форме.
С 1980 г. для диагностики ротавирусной инфекции используется метод иммуноферментного анализа (ИФА), который позволяет определить антигены капсида ротавируса. Этот метод экспресс-диагностики позволяет быстро определить тип возбудителя с минимальными финансовыми затратами [18]. Более чувствительным методом диагностики ротавирусной инфекции является метод полимеразной цепной реакции (ПЦР), благодаря которому возможно определение не только наличия вируса, но и его серотипа [12].
Профилактика ротавирусной инфекции заключается в популяризации грудного вскармливания, обеспечении населения чистой питьевой водой, проведении санитарных и гигиенических мероприятий [8]. Однако, учитывая высокий уровень заболеваемости ротавирусной инфекцией, даже в странах с высоким уровнем гигиены, высокую летальность, отсутствие специфического лечения, сложность в предупреждении распространения заболевания, приоритетным направлением профилактики инфекции является вакцинопрофилактика.
Разработки по созданию первых вакцин против ротавирусной инфекции начались в 1970 г., с момента идентификации возбудителя. Сначала вакцины создавались на основе серотипов ротавирусов животных, так как было найдено много общего в антигенной структуре ротавируса человека и животного. В 1998 г. первая пероральная живая атенуированная вакцина против ротавирусной инфекции была создана в США. Вакцина содержала 4 серотипа ротавирусов быка и была рекомендована к применению у детей в возрасте 2, 4 и 6 месяцев [10]. Вакцина применялась в период с октября 1998 по май 1999 г. у 1 200 000 детей. В октябре 1999 г. использование вакцины было остановлено вследствие увеличения риска возникновения инвагинаций кишечника [7].
В результате этого опыта были определены новые стандарты для оценки безопасности вакцин против ротавирусной инфекции, и в дальнейшем уже две кандидатные вакцины в мире разрабатывались исходя из этих параметров [11].
В настоящее время в мире существует две вакцины против ротавирусов: пентавалентная живая ослабленная вакцина (RotaTeq, Merck) и моновалентная живая ослабленная вакцина (Rotarix™, GlaxoSmithKline).
Сегодня в Украине зарегистрирована вакцина Ротарикс™. Несмотря на то, что вакцина содержит 1 штамм ротавируса человека, в исследованиях были получены доказательства эффективности Ротарикс™ против различных серотипов ротавирусов, которые являются наиболее частой причиной ротавирусных гастроэнтеритов. Вакцинация против ротавирусов показана всем детям в возрасте от 6 до 24 недель жизни. Для завершения полного курса вакцинации необходимо ввести 2 дозы вакцины с минимальным интервалом в 4 недели. Вакцина Ротарикс™ обеспечивает защиту на 73–89 % против ротавирусных гастроэнтеритов и на 86–100 % против развития тяжелых форм заболевания [7].
Статья подготовлена при поддержке компании «ГлаксоСмитКляйн»
1. Васильев Б.Я., Васильева Р.И., Лобзин Ю.В. Острые кишечные заболевания. Ротавирусы и ротавирусная инфекция. — СПб.: Лань, 2000. — 272 с.
2. Дзюблик І.В. Ротавірусна інфекція у дітей: особливості етіології, патоімуногенезу та епідеміології // Ваше здоров’я. — 2004. — № 41 (767).
3. Ключарева А.А., Раевнев А.Е., Малявко Д.В., Панько О.А. Ротавирусная инфекция у детей // Медицинские новости. — 2002.
4. Новикова Н.А., Новиков В.В., Добротина Н.А., Мазе па В.Н. Вирусология: Учеб. пособие. — Нижний Новгород: Изд-во ННГУ им. Н.И. Лобачевского, 2002.
5. Слободкін В.І., Дзюблик І.В., Трохименко О.П., Максимчук М.М., Левицька В.М. Профілактика ротавірусних інфекцій, пов’язаних з харчовим чинником передачі збудників // Проблеми харчування. — 2005. — №2. — С. 15-18.
6. Arista S. Protective efficacy of the immune response to rotavirus infections // European Rotavirus Journal. — 2006. — Vol. 2. — P. 8-10.
7. Desselberger U. Vaccination against rotavirus disease // European Rotavirus Journal. — 2005. — Vol. 1 (Suppl. 2). — P. 8-11.
8. Dennehy P.H. Transmission of rotavirus and other enteric pathogens in the home // Pediatr. Infect. Dis. J. — 2000. — V. 19 (Suppl. 10). — S. 103-105.
9. Gentsch J.R. et al. Review of G and P typing results from a global collection of rotavirus strains // J. Infect. Dis. — 1996. — V. 74 (Suppl. 1). — S. 30-36.
10. Glass R.I. et al. Rotavirus vaccines // J. Infect. Dis. — 2005. — V. 92 (Suppl. 1). — S. 160-166.
11. Offit P.A. The future of rotavirus vaccines // Semin. Pediatr. Infect. Dis. — 2002. — V. 13(3). — 190-195.
12. Parashar U.D., Gentsch J.R., Glass R.I. Rotavirus // Emerg. Infect. Dis. — 1998. — V. 4 (4). — S. 561-570.
13. Parashar U.D., Gibson C.J., Bresee J.S., Glass R.I. Rotavirus and severе childhood diarrhea // Emer. Infect. Diseases. — 2006. — Vol. 12, № 2. — P. 304-306.
14. Parez N. Rotaviruses: the clinical impact // European Rotavirus Journal. — 2005. — V. 1, Issue 1. — P. 8-9.
15. Soriano-Gabarro M., Mrukowicz J., Vesikari T. Burden of rotavirus disease in European Union countries // J. Pediatr. Infect. Disease. — 2006. — Vol. 25, № 1. — P. 7-11.
16. Vesikari T. The worldwide burden from rotavirus disease // European Rotavirus Journal. — 2005. — Vol. 1. — P.4-7.
17. Vesikari T., Rautanen T., Von Bondsdorff C.H. Rotavirus gastroenteritis in Finland: burden of disease and epidemiological features // Acta Paediatr Suppl. — 1999. — Vol. 88. — P. 24-30.
18. Ward R.L. et al. Protection against rotavirus disease after natural rotavirus infection. US Rotavirus Vaccine Efficacy Group // J. Infect. Dis. — 1994. — V. 169(4). — S. 900-904.
19. Xu J., Dennehy P. et al. Serum antibody responses in children with rotavirus diarrhea can serve as for protection // Clin. Diag. Lab. Immunol. — 2005. — № 12. — P. 273-279.