Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Сумамед® — антибактериальный препарат выбора при лечении острых респираторных заболеваний у детей
Авторы: Абатуров А.Е.1, Костюченко А.С.2, Квитницкая Т.П.2, Ивашина В.И.2 1Днепропетровская государственная медицинская академия 2КУ «Городская детская клиническая больница № 1», г. Днепропетровск
Рубрики: Педиатрия/Неонатология
Версия для печати
В научном обзоре представлены данные, позволяющие считать, что азитромицин (Сумамед®) является эффективным антибиотическим средством с выраженным бактериостатическим действием. Сумамед® в связи с наличием детских форм препарата, высоким уровнем безопасности и комплайентности терапии может быть рекомендован в качестве стартового препарата для лечения острых инфекционных заболеваний как верхних, так и нижних дыхательных путей у детей.
Острые респираторные инфекции, макролиды, азитромицин, Сумамед®, дети.
Введение
Наблюдаемый в последнее время выраженный рост распространенности острых инфекционных заболеваний респираторного тракта, вызванных резистентными штаммами к антибиотикам пенициллиновой группы и внутриклеточными патогенными бактериями, среди детской популяции предопределил широкое применение макролидов в педиатрической практике. Структурной основой молекулы антибиотиков группы макролидов является макроциклическое лактонное кольцо, которое связано с углеродными остатками. В зависимости от числа атомов углерода в лактонном кольце различают три основных подкласса макролидов — с 14-членным (эритромицин, кларитромицин, рокситромицин, диритромицин), с 15-членным (азитромицин) и с 16-членным лактонным кольцом (спирамицин, джозамицин, мидекамицин) [4, 13].
Первым представителем подкласса макролидов с 15-членным лактонным кольцом (азалидов) является полусинтетический антибиотик азитромицин — 9-Деоксо-9а-аза-9а-метил-9а-гомоэритромицин А (C38H72N2O12). Азитромицин был синтезирован в 1981 году группой ученых Gabrijela Kobrehel, Zrinka Tamburasev и Gorjana Radobolja-Lazarevski, работавших в компании «Плива» под руководством доктора Slobodan Dokic [27].
Химическая структура молекулы азитромицина
Азитромицин был получен путем включения азотистого остатка NH3 в 14-членное лактонное кольцо между 9-м и 10-м атомами углерода (рис. 1).
Механизм действия
Антибактериальный
Азитромицин, взаимодействуя с 50S-субъединицей рибосомы, ингибирует пептидтранслоказу на стадии трансляции и подавляет опосредованный мРНК биосинтез белка, замедляя рост и размножение бактерий [20, 24]. По отношению к b-гемолитическому стрептококку и пневмококку азитромицин (Сумамед®) может оказывать и бактерицидный эффект [4]. Азитромицин препятствует адгезии Р.аеruginosa к слизистой оболочке респираторного тракта, подавляет образование биопленки. Установлено, что азитромицин ингибирует продукцию аутоиндукторов у Р.aеruginosa, обеспечивающих работу механизма quorum-sensing [15].
Противомикробная активность
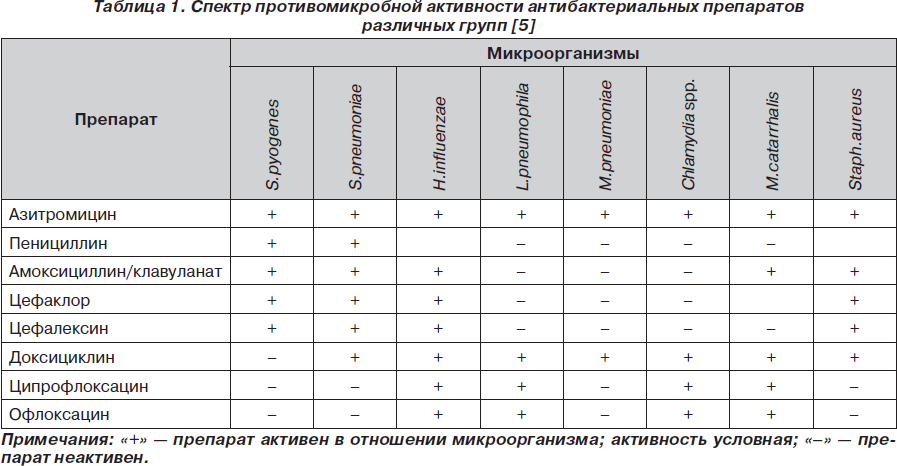
К азитромицину (Сумамед®) чувствительны грамположительные кокки: Streptococcus pneumoniae, St.pyogenes, St.agalactiae, Staphylococcus aureus, St.viridans; грамотрицательные бактерии: Haemophilus influenzae, Moraxella catarrhalis, Bordetella pertussis, B.parapertussis, Legionella pneumophila, H.ducrei, Campylobacter jejuni, Neisseria gonorrhoeae и Gardnerella vaginalis; некоторые анаэробные микроорганизмы: Bacteroides bivius, Clostridium perfringens, Peptostreptococcus spp.; а также Chlamydia trachomatis, Mycoplasma pneumoniae, Ureaplasma urealyticum, Treponema pallidum, Borrelia burgdoferi. Азитромицин является самым активным среди макролидов против H.influenzae, включая бета-лактамазопродуцирующие штаммы. По эффективности в отношении данного патогена он в 2–8 раз превосходит эритромицин. Азитромицин превосходит кларитромицин по активности против С.burnetii — риккетсий, вызывающих атипичную пневмонию. В отличие от эритромицина азитромицин активен против T.gondii, причем действует и на цисты. В экспериментальных исследованиях выявлено, что азитромицин действует на Cryptosporidium spp. Азитромицин не активен в отношении грамположительных бактерий, устойчивых к эритромицину. Азитромицин, как и все препараты группы макролидов, не активен по отношению к энтерококкам [2, 7, 17, 22]. Сравнительная противомикробная активность азитромицина и других антибиотиков приведена в табл. 1 [5].
Постантибиотический эффект
Азитромицин (Сумамед®) проявляет постантибиотический эффект против таких микроорганизмов, как S.pyogenes, S.pneumoniae, H.influenzae, L.pneumophila, причем по продолжительности постантибиотического эффекта на гемофильную палочку и легионеллы он превосходит кларитромицин [7].
Модулирующее действие на воспалительный процесс
Азитромицин обладает бифазным действием на неспецифические механизмы защиты. В первую фазу действия азитромицин стимулирует дегрануляцию нейтрофилов и оксидативный взрыв, усиливая антибактериальный эффект, а во вторую фазу — по достижении эрадикации бактерий — ингибирует продукцию IL-8 и активирует апоптоз нейтрофилов, подавляя активность воспалительного процесса [3, 18].
Фармакокинетика и фармакодинамика
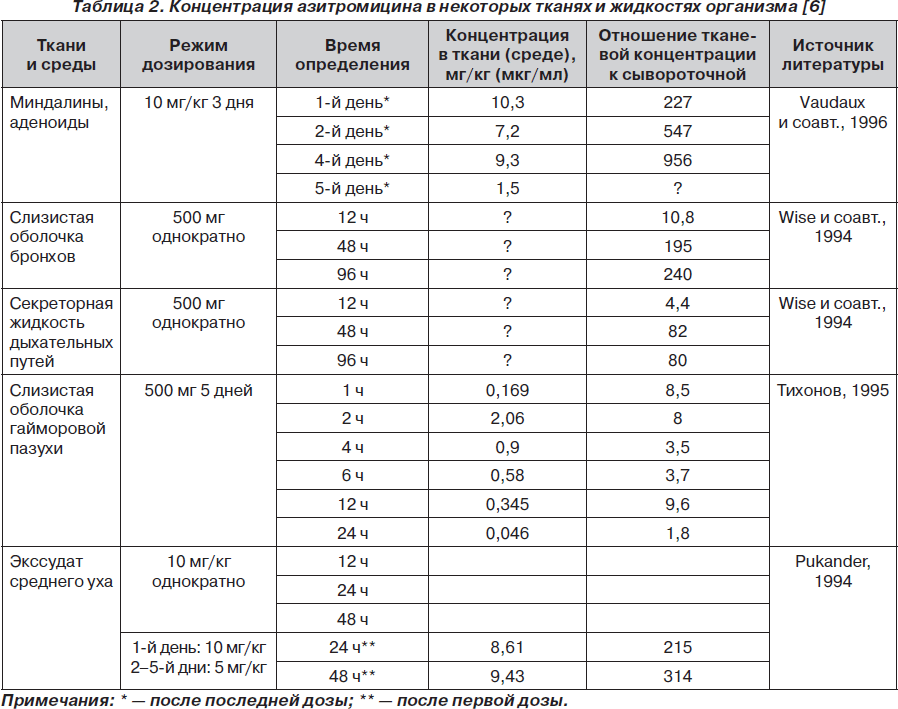
Азитромицин быстро всасывается в пищеварительном тракте — после приема внутрь 500 мг азитромицина площадь под фармакокинетической кривой «концентрация — время» (ПФК0–72) составляет 4,3 мг • ч/л, максимальная концентрация азитромицина (Сумамед®) Сmах — 0,5 мкг/мл в плазме крови достигается уже через 2,5–2,96 ч. Биодоступность азитромицина (Сумамед®) — 38 %. Одновременный прием азитромицина и пищи сопровождается снижением величины Сmах на 52–56 %. Поэтому азитромицин рекомендуется принимать за один час до или через 2 часа после приема пищи. В кровеносном русле азитромицин связывается белками плазмы и транслоцируется в ткани, где накапливается в концентрациях, которые значительно превышают уровень его содержания в плазме. В связи с этим азитромицин считается тканевым антибиотиком и не может быть использован независимо от способа введения препарата при состояниях, патогенетической основой которых является бактериемия. В очаге воспаления азитромицин сохраняется в бактерицидных концентрациях в течение 5–7 дней после приема последней дозы, что позволяет применять короткие курсы лечения. Концентрация азитромицина в жидкости, омывающей альвеолы, и в альвеолярных макрофагах достигает максимума 3,12 ± ± 0,93 мкг/мл, 464 ± 65 мкг/мл соответственно к 5-м суткам лечения. Высокая концентрация азитромицина в жидкости, омывающей альвеолы, и в тканевых макрофагах сохраняется на 7-е и 21-е сутки после начала лечения. Период полувыведения составляет в среднем 68 часов. Распределение азитромицина в тканях и жидкостях организма человека представлено в табл. 2. Длительный период полувыведения азитромицина (ТЅ — 35–50 часов) позволяет назначать Сумамед® 1 раз в сутки, что обеспечивает высокую комплайентность лечения. В печени азитромицин деметилируется, теряя активность, 50 % выводится с желчью в неизмененном виде и около 6 % экскретируется с мочой [1, 12, 16, 19, 26; 27].
Профиль безопасности
Азитромицин (Сумамед®) относится к группе наиболее безопасных препаратов. Наиболее частыенежелательные явления — диарея (6 %), боли в животе (1–4 %), тошнота (0,5–2 %), рвота (1–6 %). Уровень безопасности азитромицина (Сумамед®) таков, что позволяет назначать препарат и недоношенным детям. Азитромицин не оказывает токсического действия на плод [7, 23, 25].
Эффективность терапии азитромицином респираторных инфекций
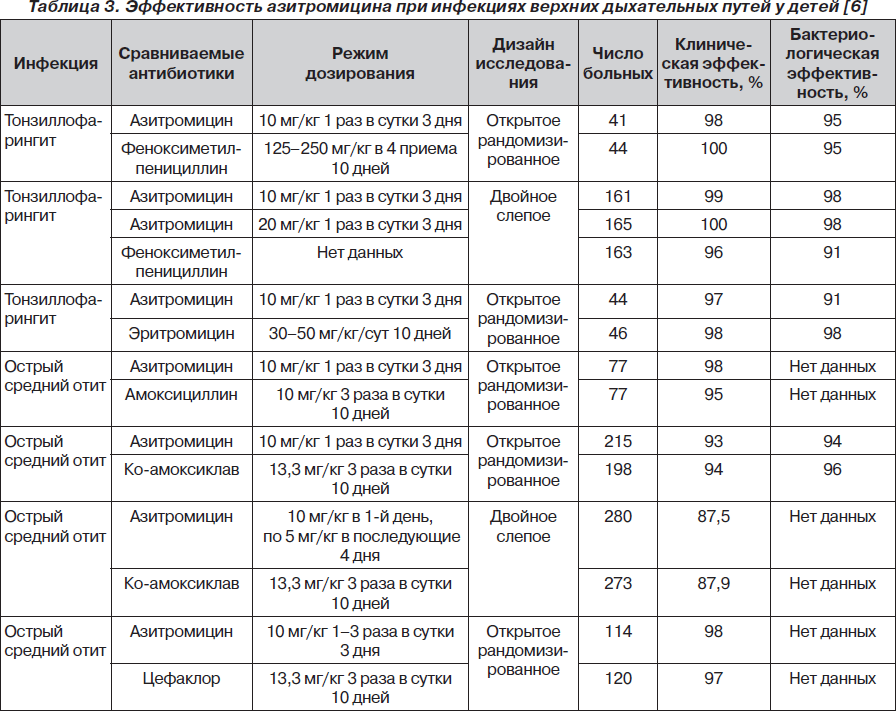
Международные, российские и украинские формуляры антибактериальной терапии рекомендуют азитромицин в качестве одного из препаратов первого ряда для лечения острых инфекционных заболеваний респираторного тракта у взрослых и детей [8]. В многочисленных многоцентровых контролируемых исследованиях была продемонстрирована высокая эффективность терапии азитромицином (Сумамед®) острых респираторных инфекций у детей. Показано, что лечение азитромицином (Сумамед®) детей, больных острым отитом, тонзиллофарингитом, синуситом, достигает практически 100% клинической эффективности. С учетом свойственного азитромицину постантибиотического эффекта сроки применения этого антибиотика обычно сокращены — в большинстве рекомендаций они определены в 3–5 суток.
Особенности действия азитромицина (Сумамед®) обусловливают возможность применения и очень коротких схем лечения. Так, было показано, что однократное назначение азитромицина в дозе 60 мг/кг при остром среднем отите по эффективности не уступает десятидневной терапии амоксициллином c клавулановой кислотой в суточной дозе 90/6,4 мг/кг [10]. Подобные результаты были получены при сравнительном анализе результатов лечения однократной дозой азитромицина 378 пациентов и амоксициллином с клавулановой кислотой на протяжении 10 суток 371 пациента с острым синуситом [11]. Двойное слепое рандомизированное исследование терапии короткими курсами азитромицина больных с острыми тонзиллофарингитами, которые вызваны b-гемолитическим стрептококком группы А, показало, что ее эффективность составляет 96–99 % [14].
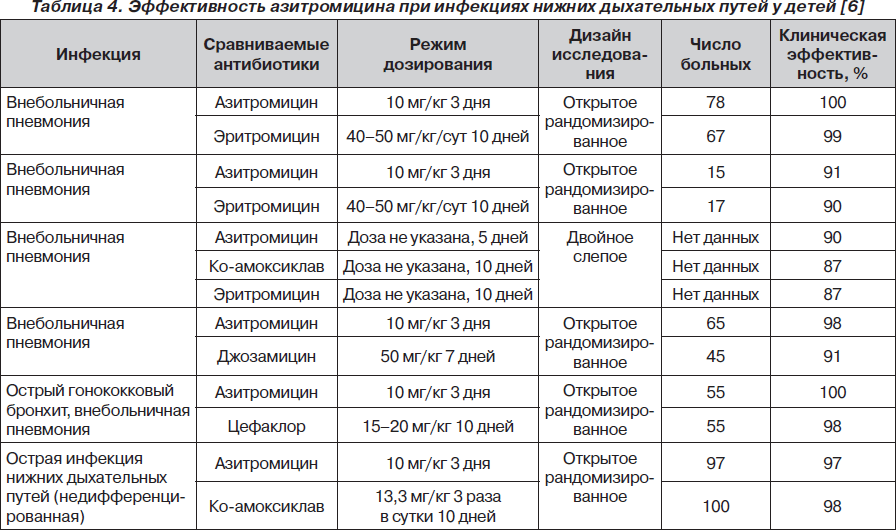
На основании данных метаанализа R. Panpanich и соавт. [11] показали, что при лечении острых бронхитов и внебольничных пневмоний назначение азитромицина по эффективности превосходит применение амоксициллина или амоксициллина/клавуланата.
Эффективность терапии азитромицином при инфекциях верхних и нижних дыхательных путей у детей представлена в табл. 3, 4 соответственно.
Заключение
Таким образом, Сумамед® является эффективным антибиотическим средством с выраженным бактериостатическим и для некоторых бактериальных штаммов бактерицидным действием. В связи с наличием детских форм препарата, а также высокого уровня безопасности и комплайентности терапии антибиотик Сумамед® может быть рекомендован как стартовый препарат для этиологического лечения острых бактериальных инфекционных заболеваний как верхних, так и нижних дыхательных путей у детей.
1. Белобородов В.Б. Внебольничная пневмония и макролиды // РМЖ. — 2009. — № 19. — 1209.
2. Веселов А.В., Козлов Р.С. Азитромицин: современные аспекты клинического применения // Клин. микробиол. антимикроб. химиотер. — 2006. — Т. 8, № 1. — С. 18-32.
3. Волосовец А.П., Кривопустов С.П. Макролиды в практике современной педиатрии. — К.: Четверта хвиля, 2009. — 192 с.
4. Жаркова Н.Е. Опыт применения азитромицина в лечении инфекций дыхательных путей // Новости медицины и фармации. — 2010. — № 343. — С. 31-35.
5. Запруднов А.М., Григорьев К.И. Азитромицин в педиатрической практике // Российский вестник перинатологии и педиатрии. — 1999. — № 1. — С. 44-50.
6. Лукьянов С.В. Фармакология и клиническое применение азитромицина у детей // Consilium medicum. — 2005. — Т. 7, № 1.
7. Митрохин С.Д. Азитромицин: обоснованность применения в терапии различной инфекционной патологии // Новости медицины и фармации. — 2010. — № 310.
8. Новиков В.Е. Некоторые аспекты антибиотикотерапии бронхолегочных заболеваний // Новости медицины и фармации. — 2010. — № 343. — С. 48-50.
9. Новиков В.Е. Некоторые аспекты антибиотикотерапии бронхолегочных инфекций // РМЖ. — 2010. — № 7. — 416.
10. Arguedas A., Soley C., Kamicker B.J., Jorgensen D.M. Single-dose extended-release azithromycin versus a 10-day regimen of amoxicillin/clavulanate for the treatment of children with acute otitis media // Int. J. Infect. Dis. — 2011 Jan 24.
11. Azithromycin extended release vs amoxicillin/clavulanate: symptom resolution in acute sinusitis / B.F. Marple, C.S. Roberts, J.R. Frytak, V.F. Schabert, J.C. Wegner, H. Bhattacharyya, J.F. Piccirillo, S.P. Sanchez // Am. J. Otolaryngol. — 2010. — Vol. 31, № 1. — P. 1-8.
12. Bioavailability and pharmacokinetic comparison between generic and branded azithromycin capsule: a randomized, double-blind, 2-way crossover in healthy male Thai volunteers / J. Boonleang, K. Panrat, C. Tantana, S. Krittathanmakul, W. Jintapakorn // Clin. Ther. — 2007. — Vol. 29. — P. 703-710.
13. Hernando-Sastre V. Macrolide antibiotics in the treatment of asthma. An update // Allergol. Immunopathol (Madr). — 2010. — Vol. 38, № 2. — P. 92-98.
14. Jorgensen D.M. Single-dose extended-release oral azithromycin vs. 3-day azithromycin for the treatment of group A beta-haemolytic streptococcal pharyngitis/tonsillitis in adults and adolescents: a double-blind, double-dummy study // Clin. Microbiol. Infect. — 2009. — Vol. 15, № 12. — P. 1103-1110.
15. Kцhler T., Perron G.G., Buckling A., van Delden C. Quorum sensing inhibition selects for virulence and cooperation in Pseudomonas aeruginosa // PLoS Pathog. — 2010. — Vol. 6, № 5. — P. e1000883.
16. Luke D.R., Foulds G. Disposition of oral azithromycin in humans // Clin. Pharmacol. Ther. — 1997. — Vol. 61. — P. 641-648.
17. Mazzei T., Mini E., Novelli A., Penti P. Chemistry and mode of action of macrolides // J. Antimicrob. Chemother. — 1993. — Vol. 31(Suppl. C). — P. 1-9.
18. McDonald P.J., Pruul H. Macrolides and the immune system // Scand. J. Infect. Dis. Suppl. — 1992. — Vol. 83. — P. 34-40.
19. Muto C., Liu P., Chiba K., Suwa T. Pharmacokinetic-pharmacodynamic analysis of azithromycin extended release in Japanese patients with common respiratory tract infectious disease // J. Antimicrob. Chemother. — 2011. — Vol. 66, № 1. — P. 165-174.
20. Omura S., editor. Macrolide Antibiotiotics. — 2nd edition. — Academic Press, 2002.
21. Panpanich R., Lerttrakarnnon P., Laopaiboon M. Azithromycin for acute lower respiratory tract infections // Cochrane Database Syst. Rev. — 2008. — Vol. 23, № 1. — CD001954.
22. Peters D.H., Friedel H.A., McTavish D. Azithromycin. A review of its antimicrobial activity, pharmacokinetic properties and clinical efficacy // Drugs. — 1992. — Vol. 44, № 5. — P. 750-799.
23. Pharmacokinetics, Safety, and Biologic Effects of Azithromycin in Extremely Preterm Infants at Risk for Ureaplasma Colonization and Bronchopulmonary Dysplasia / H.E. Hassan, A.A. Othman, N.D. Eddington, L. Duffy, L. Xiao, K.B. Waites, D.A. Kaufman, K.D. Fairchild, M.L. Terrin, R.M. Viscardi // J. Clin. Pharmacol. — 2010.
24. Sбnchez F., Sбnchez J. Antibiуticos macrуlidos (antualizaciу) // Medicine. — 2006. — Vol. 9. — P. 3591-3596.
25. The safety of macrolides during lactation / L.H. Goldstein, M. Berlin, L. Tsur, O. Bortnik, L. Binyamini, M. Berkovitch // Breastfeed. Med. — 2009. — Vol. 4, № 4. — P. 197- 200.
26. Zhang X.Y., Wang Y.R., Zhang Q., Lu W. Population pharmacokinetics study of azithromycin oral formulations using NONMEM // Int. J. Clin. Pharmacol. Ther. — 2010. — Vol. 48, № 10. — P. 662-669.
27. Zithromax U.S. physician prescribing information. — New York, NY.: Pfizer Labs, 2009.