Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Гіпоплазія легень як основна причина незадовільних результатів лікування новонароджених із природженими діафрагмальними грижами
Авторы: Слєпов О.К., Пономаренко О.П., Гордієнко І.Ю., Задорожня Т.Д., Сорока В.П., Муквіч О.М., Луценко С.В., Джам О.П., Журавель А.О. ДУ «Інститут педіатрії, акушерства та гінекології» АМН України, відділення хірургічної корекції природжених вад розвитку в дітей, м. Київ
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті наведено результати дослідження 58 новонароджених (53 живонароджених і 5 мертвонароджених) із природженими діафрагмальними грижами (ПДГ). Визначено тяжкість і поширеність гіпоплазії легень як предиктора виживання у новонароджених із ПДГ. На основі отриманих даних вперше розроблено класифікацію гіпоплазії легень при ПДГ у новонароджених. Установлено частоту виявлення і вплив на виживання гіпоплазії серця, фетальних комунікацій та інших вад серця у новонароджених із ПДГ.
Природжена діафрагмальна грижа, гіпоплазія легень, новонароджені діти.
Гіпоплазія легень(-і), — недорозвиток усіх структурних елементів органу, виникає при природженій діафрагмальній грижі (ПДГ) у внутрішньоутробному періоді в результаті здавлення легень(-і) грижовим умістом грудної клітки (тонкою і товстою кишкою, шлунком, печінкою, селезінкою тощо), а також серцем як на боці ураження, так і на протилежному. Тому й іпсилатеральна, і контралатеральна легені можуть бути гіпоплазованими [1]. Патологогістологічне вивчення тварин і новонароджених дітей, які померли постнатально, продемонструвало, що при ПДГ обидві легені гіпоплазовані, але в іпсилатеральній легені ураження значно більш виражене [1, 2]. Проте вираженість гіпоплазії контралатеральної легені, на думку деяких авторів, відіграє вирішальну роль у виживанні новонароджених із ПДГ [3]. Рівень смертності при ПДГ дотепер залишається високим. Основною причиною летальності при ізольованій ПДГ є гіпоплазія легені та легенева гіпертензія, що призводить до відновлення фетального типу циркуляції крові, з її шунтуванням справа наліво [4]. Смертність у цій групі новонароджених із ПДГ є дуже високою і сягає 79–80 % [5–7].
З метою прогнозування постнатального результату лікування деякі дослідники з США, Об’єднаної Європи, Японії визначають в антенатальному періоді при УЗД ступінь гіпоплазії легень і подальший ризик респіраторних ускладнень за допомогою легенево-краніального коефіцієнту [8, 9]; вимірювання загального об’єму легень за допомогою 3-вимірної сонографії чи МРТ [10, 11]; 2-вимірного визначення площі або 3-вимірного об’єму контралатеральної легені [12], легенево-торакального коефіцієнта [4]. Проте ці дослідження і, зокрема, визначення легенево-краніального коефіцієнта, не витримали перевірки часом як надійного прогностичного індикатора виживання новонароджених із ПДГ [4, 13, 14].
У цілому проблема гіпоплазії легень, і особливо в постнатальному періоді, в науковій літературі мало висвітлена, і лише частково, в поодиноких роботах, описуються гістологічні і морфологічні зміни легень при ПДГ [15]. Відсутня класифікація при даній патології, яка б відображала глибину недорозвитку легень при ПДГ. Це погіршує прогнозування результатів лікування при ПДГ, призводить до численних помилок при розробці лікувальної тактики та високої смертності.
Мета дослідження: вивчити частоту і глибину ураження легень при їх гіпоплазії, а також наявність патології серця у новонароджених із ПДГ.
Матеріал та методи дослідження
З 1982 по 2009 рр. проаналізовано історії хвороби (53) та протоколи автопсій (35) у 58 новонароджених із ПДГ. Серед них 5 мертвонароджених і 53 живонароджених, які знаходились на обстеженні та лікуванні в акушерських та дитячих клініках ДУ «ІПАГ» АМН України. В акушерських клініках інституту народились 39 (67,2 %) немовлят із ПДГ. В інших пологових будинках м. Києва, Київської області та інших областей України народились 19 (32,8 %) новонароджених із ПДГ, які були направлені на лікування у відділення хірургічної корекції природжених вад розвитку у дітей інституту. Хлопчиків було 36 (62,1 %), дівчаток — 22 (37,9 %). Як ізольована вада розвитку ПДГ була у 40 (68,9 %) пацієнтів. Асоційовані вади розвитку спостерігались у 18 (31,0 %) новонароджених, серед них множинні — у 15 (25,9 %). Серед них: природжені вади серця (n = 10; 55,5 %) (дефекти міжшлуночкової (n = 6) та міжпередсердної (n = 3) перегородок, загальний артеріальний стовбур (n = 2), транспозиція магістральних судин (n = 1), стеноз легеневої артерії (n = 1), аномалія Епштейна (n = 1); сечостатевої системи (n = 7; 38,9 %) (агенезія однієї нирки (n = 6), двобічний абдомінальний крипторхізм (n = 3) та гіпоспадія (n = 2); опорно-рухового апарату (n = 9; 50,0 %) (полідактилія (n = 3), синдактилія (n = 1), гіпоплазія ребер та грудини (n = 2), аплазія променевої кістки (n = 1), двобічна косорукість (n = 1), укорочення усіх кінцівок (n = 1), вальґусна деформація стоп (n = 1); аномалія центральної нервової системи (n = 2; 11,1%) (черепно-мозкова грижа (n = 2), гіпоплазія мозочка (n = 1), полімікрогірія великих напівкуль (n = 1) тощо (омфалоцеле (n = 1), гемангіома кінцівки (n = 1), хромосомна патологія (n = 2; 11,1%) — синдром Патау — Смітта (n = 1), хвороба Дауна (n = 1).
Гестаційний вік новонароджених становив від 32 до 42 тижнів, у середньому 38,4 ± 0,5 тижня, маса тіла варіювала від 1500,0 до 4600,0 г, у середньому 2917,2 ± 162,3 г. Доношеними народились 48 (82,8 %) немовлят, недоношеними — 10 (17,2 %). У 10 (17,2 %) новонароджених була внутрішньоутробна гіпотрофія, ще у 10 (17,2 %) — незрілість. Вік матерів коливався від 19 до 42 років, у середньому 27,1 ± ± 1,2 року. У 37 (63,8 %) матерів перебіг вагітності був ускладненим, у 11 (18,9 %) — пологи шляхом кесарського розтину.
Усіх новонароджених із ПДГ (n = 58; 100 %) розподілено на дві групи. До I групи увійшли немовлята з природним перебігом вади, яким не було проведено хірургічного втручання (n = 23; 39,6 %). До II групи було включено новонароджених, яким було проведено хірургічну корекцію вади (n = 35; 60,3 %). Кожну групу розподілено на дві підгрупи. До IА підгрупи увійшли мертвонароджені діти з ПДГ (n = 5; 8,6 %), до IБ підгрупи — новонароджені діти з ПДГ, які померли без операції в перші хвилини, години або доби після народження (n = 18; 31,0 %). До IIА підгрупи включено пацієнтів із ПДГ, які померли після хірургічної корекції вади (n = 14; 24,1 %), до IIБ підгрупи — немовлят, які вижили після операції (n = 21; 36,2 %).
Оцінку стану зрілості легень проводили під час автопсії у померлих дітей I групи і IIА підгрупи. Оцінювали розміри легень, їх колір, консистенцію, повітряність, повнокрів’я, в тому числі при розрізі цих органів. Визначали масу легені на боці діафрагмальної грижі, протилежної легені, обох легень та вимірювали запропонований нами легенево-корпоральний індекс (ЛКІ) як відношення маси легень до маси тіла дитини. У фізіологічних умовах цей індекс становить 1,6. Отримані результати порівнювали з нормальними (фізіологічними) показниками маси легень у новонароджених відповідних терміну гестації і маси тіла [16]. Повітряність легень, крім візуальної оцінки, визначали за допомогою водної проби. З цією метою в склянку з водою занурювали послідовно легеню на боці діафрагмальної грижі, а потім — протилежну. При відсутності повітряності легеня повністю занурювалась у воду і тонула. При наявності часткової повітряності легені остання не повністю занурювалась у воду і частково виступала над її поверхнею.
Про наявність у новонародженого при житті високої легеневої гіпертензії і шунтування крові справа наліво на рівні серця, з відновленням фетального кровообігу (фетальних комунікацій), судили за наявності відкритого артеріального протоку та/або овального вікна, які функціонували прижиттєво. Крім цього, визначали супутні вади серця, що поглиблювали гемодинамічні розлади серцево-судинної системи як на рівні малого, так і великого кіл кровообігу.
Наявність гіпоплазії легень підтверджували на основі їх морфологічного, гістологічного дослідження. Матеріалом для цього були шматочки обох легень. Їх фіксували у 10% розчині нейтрального формаліну протягом 24–48 годин, потім проводили крізь спирти зростаючої міцності і заливали парафіном. Із приготованих парафінових блоків робили зрізи товщиною 0,4–0,6 мкм, які потім забарвлювали спеціальними барвниками і проводили морфологічний аналіз отриманого матеріалу. Для забарвлення усіх клітинних і неклітинних структур використовували гематоксилін та еозин. Забарвлені зрізи досліджували під бімануальним світловим мікроскопом МБИ‑13 з використанням різних збільшень (від ґ 40 до ґ 400 ).
Розрахункова і статистична обробка результатів дослідження виконана за допомогою програми Microsoft Office Excel 2003, на персональному комп’ютері Pentium II. При клінічній характеристиці обстежених хворих для оцінки відносних величин та їхньої достовірності між окремими групами користувалися критерієм j (кутове перетворення Фішера). Також визначали параметри середньої арифметичної величини (м), середньоквадратичного відхилення (s), середньої арифметичної (m), рівень значення розбіжностей (р) порівнюваних групових середніх за допомогою t-критерію Стьюдента.
Результати дослідження
Під час автопсії у померлих дітей підгруп ІА, ІБ і ІІА проводили візуальну оцінку гіпоплазованої (гіпоплазованих) легені(-нь). Гіпоплазована легеня значно зменшена в розмірах, знаходиться у куполі плеври і підтиснута в медіальному напрямку до хребта. Легеня в стані ателектазу, безповітряна, темно-вишневого кольору, м’ясиста, щільна на дотик. При аплазії легені і в деяких випадках при її гіпоплазії (особливо глибокій) відзначається відсутність розділення органа між частковими борознами на частки. На розрізі гіпоплазована легеня є повнокровною і безповітряною. Водна проба при цьому позитивна, тобто легеня повністю занурюється у воду і тоне, що підтверджує її без повітряність.
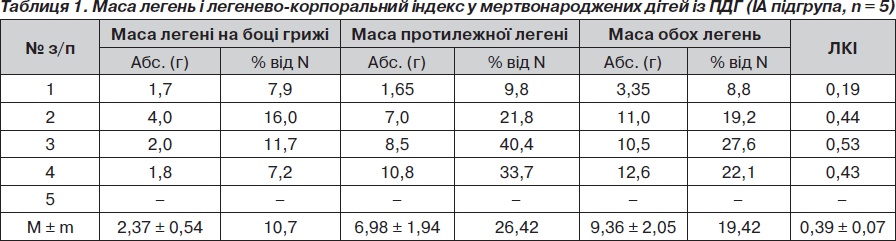
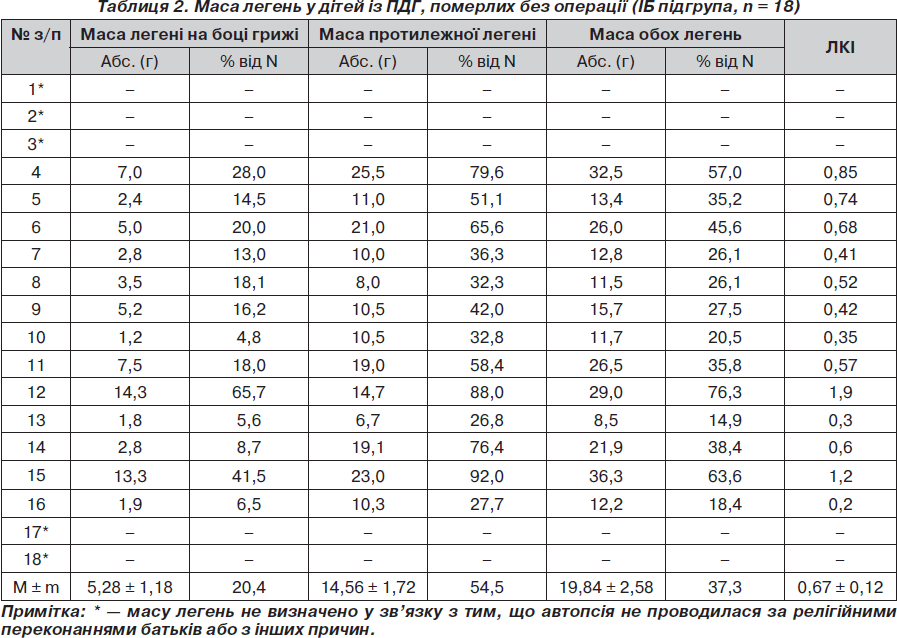
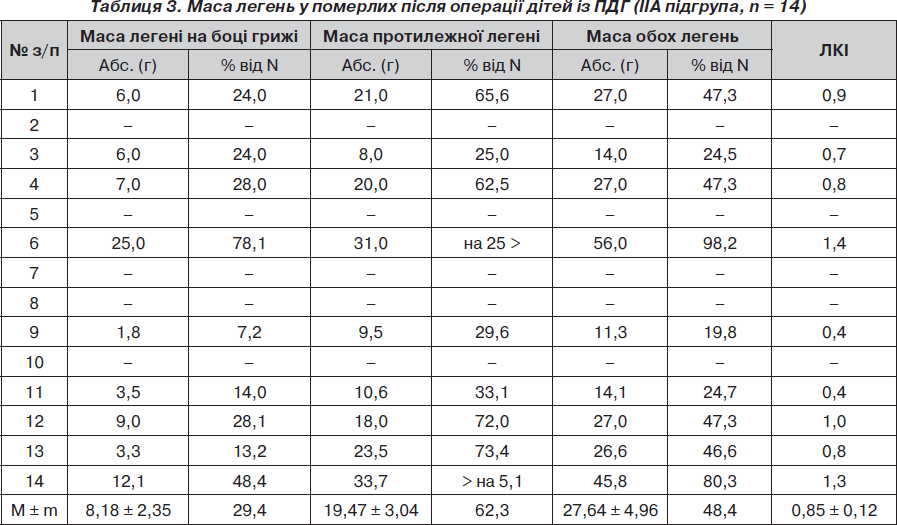
З метою визначення частоти і глибини гіпоплазії легень у новонароджених із ПДГ проведено дослідження маси легені на боці грижі та протилежному, маси обох легень та їх співвідношення із масою тіла (легенево-корпоральний індекс) у померлих дітей підгруп ІА, ІБ і ІІА (табл. 1–3).
У 3 випадках виявлено аплазію легені на боці грижі та в одному з них — двобічну. У двох із цих дітей аплазія легені поєднувалася з помірною або глибокою (n = 1) гіпоплазією протилежної легені. Ще у 2 мертвонароджених дітей була двобічна глибока гіпоплазія легень. При цьому аплазія легені характеризувалась масою органа 2 г і менше (або 1/10; 10 % і більше) маси нормальної легені) та відсутністю розділення її на частки. Глибокою гіпоплазію вважали при масі легені, що дорівнює або менша 1/3 (33,3 %) від маси нормальної легені при відповідних гестаційному віці і масі тіла. Помірну гіпоплазію визначали при масі легені, більшій за 1/3 від маси нормальної легені. В усіх 5 випадках легені були нежиттєздатними, безповітряними і повністю занурились під воду та потонули (100% позитивна водна проба).
У IБ підгрупі померлих без операції дітей виявлено: однобічну гіпоплазію легень (n = 4; 22,2 %), двобічну гіпоплазію легень (n = 2; 11,1 %), глибоку гіпоплазію однієї та гіпоплазію другої легені (n = 6; 33,3 %), глибоку гіпоплазію обох легень (n = 2; 11,1 %), аплазію однієї легені з гіпоплазією другої (n = 1; 5,5 %), або з глибокою гіпоплазією протилежної легені (n = 3; 16,7 %). Із 17 досліджень позитивна водна проба для обох легень була у 13 (76,5 %) хворих, у 4 (23,5 %) вона була позитивною для однієї і негативною для другої легені (при однобічній гіпоплазії легень).
У ІІА підгрупі гіпоплазію легень виявлено в усіх 14 (100 %) новонароджених. Серед них: гіпоплазію однієї легені на боці грижі у 7 (50 %) дітей і двобічну — у 7 (50 %). При двобічному ураженні виявлено глибоку гіпоплазію однієї і помірну гіпоплазію другої легені (n = 4; 28,6 %), глибоку гіпоплазію обох легень (n = 2; 14,3 %) і аплазію однієї і глибоку гіпоплазію другої легені (n = 1; 7,1 %).
При двобічній гіпоплазії легень позитивна водна проба була в усіх 7 (100 %) випадках. При однобічній гіпоплазії занурювалась під воду в усіх 7 (100 %) випадках тільки гіпоплазована легеня і в одному — протилежна, що була в ателектазі з крововиливами.
У ІІБ підгрупі гіпоплазію легень виявили у 20 (95,2 %) хворих. В одному випадку (4,8 %) гіпоплазії легень не було. Однобічну гіпоплазію легені діагностовано у 12 (57,1 %) пацієнтів, у 8 (38,1 %) — процес був двобічним: помірна гіпоплазія обох легень (n = 6; 28,6 %) і глибока гіпоплазія однієї та помірна гіпоплазія другої легені (n = 2; 9,5 %).
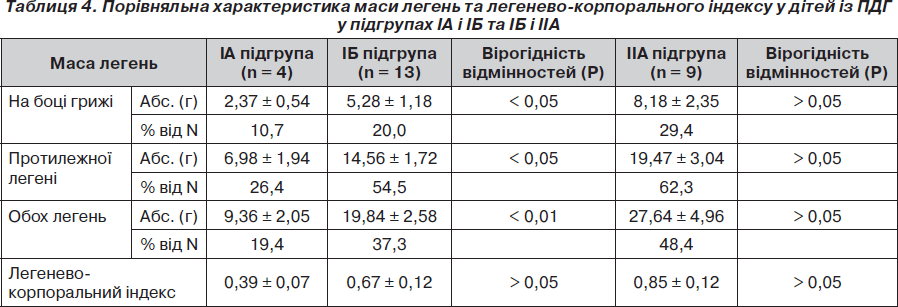
Нами проведено порівняльний аналіз маси легень та ЛКІ у трьох підгрупах померлих дітей із ПДГ (мертвонароджені (ІА підгрупа), померлих без операції (ІБ підгрупа) та після операції (ІІА підгрупа) (табл. 4).
При порівняльному аналізі абсолютної маси легень у мертвонароджених (IА підгрупа) і живонароджених, але померлих без операції, дітей із ПДГ, отримано вірогідну різницю у масі легені на боці діафрагмальної грижі, протилежної легені, а також обох легень. Це свідчить про те, що абсолютна критична маса легень у дітей IА підгрупи несумісна із життям. Абсолютна ж маса легень дітей із ПДГ IБ підгрупи вірогідно менш критична, ніж у IА підгрупі, що дає можливість народитися дітям живими, проте недостатня для їх життєздатності і призводить до смерті в найближчий час після народження. Відсутність вірогідної різниці у показниках легенево-корпорального індексу у цих двох підгрупах свідчить про надзвичайно малу масу легень в обох підгрупах і таке їх співвідношення з масою тіла, що не сумісне з життям (як в IA, так і IБ підгрупі).
Відсутність вірогідної різниці в абсолютній масі легень і легенево-корпоральному індексі у живонароджених, але померлих без операції чи після операції, дітей (IБ і IIА підгрупи) свідчить також про глибокий недорозвиток легень і їх малу масу у дітей IIА підгрупи, що є причиною (у більшості випадків) нежиттєздатності таких дітей, навіть після хірургічної корекції вади.
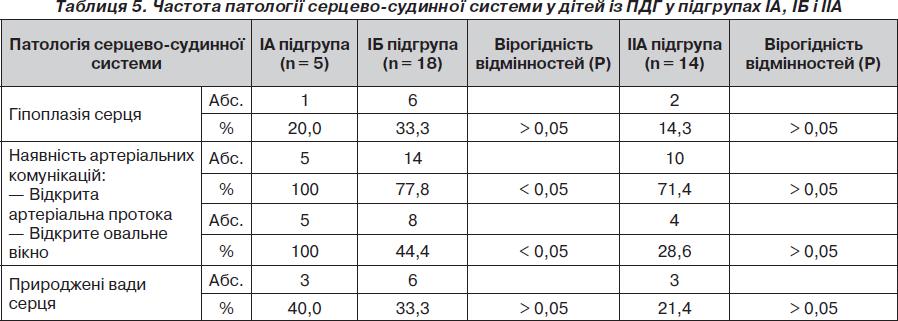
Нами також проведено порівняльний аналіз частоти патологічних змін серцево-судинної системи у дітей із ПДГ — мертвонароджених (ІА підгрупа), а також живонароджених, але померлих без операції (ІБ підгрупа), та після операції (підгрупа ІІА) (табл. 5).
Таким чином, у 37 дітей із ПДГ перших трьох підгруп (ІА, ІБ і ІІА) виявлено таку патологію серцево-судинної системи: гіпоплазія серця (n = 9; 24,3 %), відкриті фетальні комунікації (відкрита артеріальна протока (n = 29; 78,4 %) та відкрите овальне вікно (n = 17; 45,9 %); супутні природжені вади серця (n = 11; 29,7 %). Серед них: дефект міжшлуночкової перегородки (n = 5; 1*), дефект міжпередсердної перегородки (n = 1; 2*), загальний артеріальний стовбур (n = 2), транспозиція магістральних судин (n = 1), стеноз устя аорти (n = 1), аномалія Ебштейна (n = 1).
Гіпоплазія серця, як і легень, розвивалася внутрішньоутробно в результаті компресії його грижовим умістом, особливо паренхіматозними органами, такими як печінка. Гіпоплазія серця корелює з наявністю печінки в грижовому вмісті. Відсутність вірогідної різниці в частоті гіпоплазії серця в підгрупах мертвонароджених і двох підгрупах живонароджених дітей, які померли без операції або після неї, свідчить про надзвичайну тяжкість цієї патології та її фатальний вплив на виживання дітей (гіпоплазію серця діагностовано тільки у померлих дітей із ПДГ, тобто вона при ПДГ не сумісна з життям).
Частота відкритих фетальних комунікацій у мертвонароджених дітей (100% була вірогідно більшою, ніж у живонароджених дітей, померлих без операції). Це пов’язано зі 100% функціонуванням цих комунікацій внутрішньоутробно завдяки фетальному кровообігу. У живонароджених дітей із ПДГ частина цих фетальних комунікацій закривається, а частина залишається функціонувати, що свідчить про відновлення фетального кровообігу через них із напрямком скидання крові справа наліво. Це свідчить про високу 100% легеневу гіпертензію, характеризує глибину гіпоплазії легень, тяжкість перебігу та прогнозу при ПДГ.
Відсутність вірогідної різниці в частоті наявності відкритих фетальних комунікацій у живонароджених дітей, але померлих без операції (ІБ підгрупа) та після неї (ІІА підгрупа), свідчить про частоту і тяжкість легеневої гіпертензії в обох підгрупах і її фатальний вплив на виживання дітей із ПДГ.
Слід зазначити, що в перших трьох підгрупах — ІА, ІБ і ІІА — не було вірогідної різниці в частоті супутніх вад серця, які, безумовно, негативно впливали на гемодинаміку: перебіг і прогноз при ПДГ. Проте в підгрупах ІА (мертвонароджені) і ІБ (померлі діти без операції) серед вад серця переважали високолетальні або несумісні з життям природжені вади серця (загальний артеріальний стовбур, транспозиція магістральних судин, аномалія Ебштейна з дефектом міжшлуночкової перегородки тощо).
Таким чином, патологія серцево-судинної системи у новонароджених із ПДГ, а саме гіпоплазія серця, функціонуючі фетальні комунікації, супутні природжені вади серця, свідчить про надзвичайну тяжкість перебігу щодо виживання цих критичних хворих.
На основі клініко-морфологічного дослідження легень при ПДГ у новонароджених нами розроблено робочу класифікацію гіпоплазії легень при ПДГ:
І. За наявності гіпоплазії легень:
а) ПДГ без гіпоплазії легень;
б) ПДГ, ускладнена гіпоплазією легень.
ІІ. За поширеністю гіпоплазії:
а) гіпоплазія однієї легені (однобічна);
б) гіпоплазія обох легень (двобічна).
ІІІ. За тяжкістю гіпоплазії:
а) гіпоплазія обох легень;
б) глибока гіпоплазія однієї і гіпоплазія другої легені;
в) глибока гіпоплазія обох легень;
г) аплазія однієї легені і гіпоплазія другої;
д) аплазія однієї легені і глибока гіпоплазія другої;
е) аплазія обох легень.
При гістологічному дослідженні гіпоплазованої(‑их) легені(-нь) виявлено ознаки незрілості та структурних змін усіх складових елементів органу: судин, бронхіального дерева та респіраторної паренхіми. Судини зберігають ембріональний (фетальний) тип будови. Різко виражене повнокрів’я капілярів і судин іншого калібру.
Відсутність серії послідовних (проміжних) генерацій бронхів, недорозвиток м’язових і хрящових структур у стінках бронхів. У сегментарних бронхах — відсутність м’язових структур і фрагментація хрящів, перибронхіальний фіброз. Просвіт бронхів щілиноподібно звужений. В окремих випадках відзначається кістозне розширення бронхів. У просвіті бронхів є кров.
Виражені ознаки незрілості та аномального розвитку респіраторної паренхіми легень, зменшення кількості альвеол. Респіраторна паренхіма на всьому протязі у стані ателектазу з гіпоплазією альвеолярних структур. У просвіті альвеолярних ходів і альвеол наявні крововиливи. Міжальвеолярні перегородки стовщені, з явищами фіброзу і набряку.
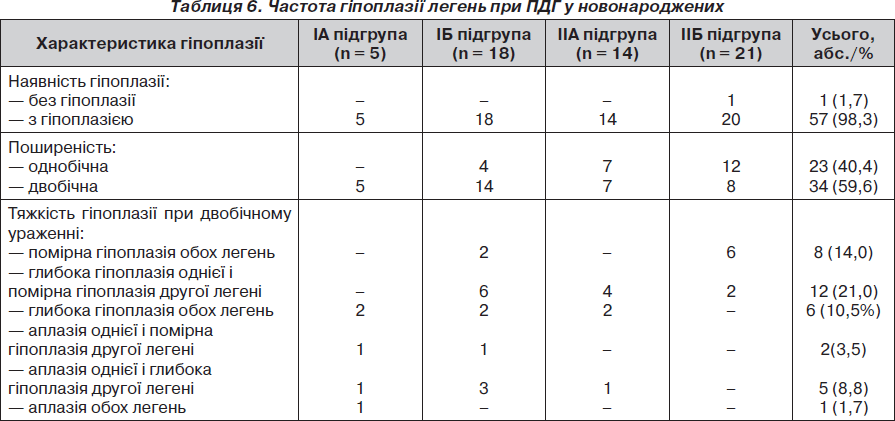
Згідно з класифікацією нами наведено загальну таблицю частоти гіпоплазії легень у новонароджених із ПДГ (табл. 6).
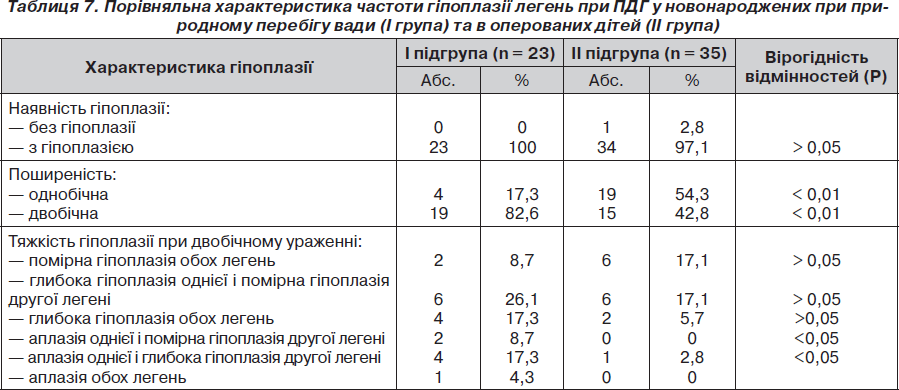
У табл. 7 наведено частоту гіпоплазії легень при ПДГ у нвонароджених при природженому перебігу вади (І група) і в оперованих дітей (ІІ група).
Висновки
1. Гіпоплазія легень діагностується у 98,3 % новонароджених із ПДГ, ускладнюючи перебіг цієї вади розвитку. Вона є однобічною (на боці грижі) у 40,4 % пацієнтів і двобічною — у 59,6 %. Тяжкість і поширеність гіпоплазії легень визначає прогноз щодо виживання у новонароджених із ПДГ.
2. Абсолютна критична маса легень у мертвонароджених немовлят із ПДГ не сумісна з життям, а у новонароджених, померлих без операції, вона вірогідно менш критична, що дає можливість народитися дітям живими, проте недостатня для їх життєдіяльності, і призводить до смерті в найближчий час після народження. Вірогідної різниці в абсолютній масі легень і легенево-корпоральному індексі у живонароджених, але померлих без операції або після неї дітей немає, що засвідчує факт глибокого недорозвитку легень, їх малу масу в оперованих немовлят із ПДГ і є основною причиною нежиттєздатності таких пацієнтів навіть після хірургічної корекції вади.
3. Гістологічне дослідження гіпоплазованих легень померлих новонароджених із ПДГ свідчить про глибокий недорозвиток усіх структурних елементів органу, судин, бронхіального дерева, респіраторної паренхіми, що пояснює їх нежиттєздатність.
5. Розроблено робочу класифікацію гіпоплазії легень у новонароджених із ПДГ, що дає змогу деталізувати цю патологію, визначаючи оптимальну лікувальну тактику та прогноз.
4. У померлих новонароджених із ПДГ у 24,3 % випадків виявлено гіпоплазію серця, у 78,4 % — відкриті фетальні комунікації: відкриту артеріальну протоку (78,4 %) та відкрите овальне вікно (45,9 %), а також супутні вади серця (29,7 %).
1. Harrison M.R. The fetus with diaphragmatic hernia // Pediatr. Surg. Int. — 1988. — Vol. 3. — P. 15-22.
2. Nakamura Y. Pulmonary acinar development in diaphragmatic hernia // Arch. Pathol. Lab. Med. — 1991. — Vol. 115. — P. 372-376.
3. Bahlmann F., Merz E., Hallermann C. et al. Congenital diaphragmatic hernia: ultrasonic measurement of fetal lungs to predict pulmonary hypoplasia // Ultrasound Obstet. Gynecol. — 1999. — Vol. 14. — P. 162-168.
4. Tsukimorі K., Masumoto K., Morokuma S. et al. The lung-to-thorax transverse area ratio at term and near term correlates with survival in isolated congenital diaphragmatic hernia // J. Ultrasound Med. — 2008. — № 27. — P. 707-713.
5. Boloker J., Bateman D., Wung J. et al. Congenital diaphragmatic hernia in 120 infant treated consecutively with permissive hypercapnea / spontaneous respiration/elective repair // J. Pediatr. Surg. — 2002. — Vol. 37. — P. 357-366.
6. Stege G., Fenton F., Jaffray B. Nigilism in the 1990s: the true mortality of congenital diaphragmatic hernia // Pediatrics. — 2003. — Vol. 112. — P. 532-535.
7. Wilson J.M., Lund D.L., Lillehei C.W. et al. Delayed repair and preoperative ECMO does not improve survival in high-risk congenital diaphragmatic hernia // J. Pediatr. Surg. — 1992. — Vol. 27. — P. 368-375.
8. Laundy J.A.M., Van Gucht M., Van Dooren M.F. et al. Congenital diaphragmatic hernia: an evaluation of the prognostic value of the lung-to-head ratio and other parameters // J. Prenatal. Diagn. — 2003. — Vol. 23. — P. 634-639.
9. Jani J., Keller R.L., Benachi A. et al. Prenatal prediction of survival in isolated left-sided diaphragmatic hernia // Ultrasound Obstet. Gynecol. — 2006. — Vol. 27. — P. 18-22.
10. Ruano R., Benachi A., Jobin L. et al. Thre-dimensional ultrasonographic assessment of fetal lung volume as prognostic factor in isolated congenital diaphragmatic hernia // BJOG. — 2004. — Vol. 111. — P. 423-429.
11. Jani J., Nicolaides K.H., Keller R.L. et al. Observed to expected lung area to head circumference ratio in the prediction of survival in fetuses with isolated diaphragmatic hernia // Ultrasound Obstet. Gynecol. — 2007. — Vol. 30. — P. 67-71.
12. Gerards F., Twisk J., Tibboel D. et al. Congenital diaphragmatic hernia: 2D lung area and 3D lung volume measurements of the contralateral lung to predict postnatal outcome // Fetal Diagn. Ther. — 2008. — Vol. 24. — P. 271-276.
13. Sbragia L., Paek B.W., Filly R.A. et al. Congenital diaphragmatic hernia without hernitaion of the liver: does the lung-to-head ratio predict survival? // Ultrasound Med. — 2000. — Vol. 19. — P. 845-848.
14. Hedrick H., Danzer E., Merchant A. et al. Liver position and lung-to-head ratio for prediction of extracorporeal membrane oxygenation and survival in isolated left congenital diaphragmatic hernia // Am. J. Obstet. Gynecol. — 2007. — Vol. 197. — P. 422.e1-422.e4.
15. Ковальчук В.С., Муслимова М.С. Изменения легких при диафрагмальных грыжах у новорожденных // Частные вопросы онкоморфологии. Труды ленинского научного общества патологоанатомов. — 1986. — ХХVII. — C. 845-848.
16. Сорокин А.Ф. Таблицы массы и размеров органов у детей. Методические рекомендации для патологоанатомов педиатрического профиля. — М.: 2-й МОЛГМИ им. Пирогова, 1980. — 54 с.