Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Новое в дефиниции патогенеза бронхолегочной дисплазии у новорожденных
Авторы: Клименко Т.М., Агашков В.С. Кафедра неонатологии Харьковской медицинской академии последипломного образования Харьковский городской клинический родильный дом с неонатологическим стационаром
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье обосновано новое перспективное направление в неонатологии — поиск ранних диагностических и прогностических критериев бронхолегочной дисплазии у недоношенных новорожденных с тяжелыми дыхательными нарушениями, требующими проведения искусственной вентиляции легких. Обоснована детерминирующая роль противовоспалительного цитокина — трансформирующего фактора роста b1 — как главного вторичного фактора в устойчивости, организации и компенсации структурно-функциональных изменений легких при тяжелых дыхательных нарушениях и формировании бронхолегочной дисплазии в раннем неонатальном периоде у недоношенных новорожденных различного срока гестации.
Недоношенные новорожденные, бронхолегочная дисплазия, цитокин TGF-b1.
Бронхолегочная дисплазия (БЛД) за последнее десятилетие становится все более актуальной проблемой во всем мире. Внедрение современных технологий выхаживания недоношенных новорожденных, высокотехнологичных и максимально щадящих методик искусственной вентиляции легких (ИВЛ), использование экзогенного сурфактанта привели к увеличению выживаемости недоношенных новорожденных, что, в свою очередь, повлияло на увеличение частоты БЛД. Значимость бронхолегочной дисплазии выходит за пределы неонатологии и рассматривается как хроническая обструктивная болезнь детей раннего возраста, приобретая при этом форму медико-социальной проблемы.
По данным американских авторов, частота БЛД среди недоношенных детей с очень низкой массой тела колеблется в пределах 6,7–49 % [1, 2].
Согласно японским данным, собранным на большой популяции недоношенных детей (4964 ребенка) за 5 лет, частота БЛД зависит от массы тела при рождении и составляет 5,7 % у детей с массой тела 1250–1499 г, 18,6 % при массе 1000–1249 г, 36,2 % при массе 900–999 г и возрастает до 77,8 % при массе < 500 г [3]. Изученная в рамках исследования частота БЛД по харьковскому перинатальному центру в среднем соответствовала мировым показателям и составила в группе новорожденных, требующих проведения ИВЛ, со сроком гестации (СГ) 22–24 недели 100 %; 25–27 недель — 59,6 %; 28–30 недель — 18,4 %; СГ > 30 недель — 1,8 %.
Своевременная диагностика БЛД позволяет значительно снизить летальность на 1–2-м году жизни, улучшить прогноз заболевания на 2–3-м году [4].
Цель исследования: усовершенствование прогнозирования и диагностики БЛД на основании изучения повреждающего действия трансформирующего фактора роста b1 (TGF-b1) в раннем неонатальном периоде.
Материалы и методы
В соответствии с поставленными целями и задачами научной работы мы обследовали 110 новорожденных, родившихся в период с 05.10.2006 по 25.12.2009 в роддомах г. Харькова и Харьковской области, находившихся на стационарном лечении в отделении интенсивной терапии новорожденных городского клинического родильного дома с неонатологическим стационаром г. Харькова.
Для решения поставленных задач были сформированы альтернативные группы: а) основная группа (n = 60), включающая новорожденных с дыхательными расстройствами, находившихся по этому поводу на ИВЛ, у которых в дальнейшем сформировалась БЛД: мальчиков — 31, девочек — 29; б) контрольная группа (n = 40), включающая новорожденных с дыхательными расстройствами на ИВЛ, у которых не отмечено формирование БЛД: мальчиков — 23, девочек — 17; в) группа практически здоровых новорожденных (n = 10) с гладким течением раннего неонатального периода: мальчиков — 5, девочек — 5.
В сформированных группах ретроспективно произведена оценка клинико-анамнестических, лабораторных, инструментальных и терапевтических показателей в неонатальном периоде. Учитывая, что большинство признаков носило качественный характер, в качестве критерия достоверности значений показателей между группами, наряду с параметрическим критерием t Стьюдента, применялся непараметрический критерий j Фишера (Е.В. Гублер, 1978) [13].
Результаты и их обсуждение
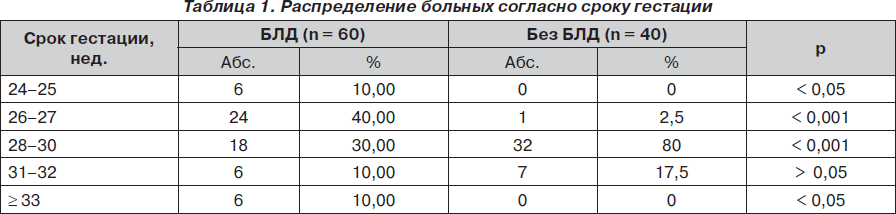
Важным патогенетическим фактором БЛД является незрелость легких недоношенного ребенка. Сопоставление распределения больных в группах согласно гестационному возрасту показало (табл. 1), что очень низкий (Ј 25 недель) срок гестации был специфичен для БЛД (р < 0,05).
При увеличении срока гестации до 31–32 недель отмечена тенденция, не достигающая уровня значимости (р > 0,05) и проявляющаяся доминированием числа больных контрольной группы (17,5 %) по сравнению с больными БЛД (10 %).
Таким образом, между БЛД и гестационным возрастом новорожденного выявлена нелинейная зависимость, сущность которой заключалась в том, что патогенетическая значимость была характерна для срока гестации Ј 27 недель. Это связано с незрелостью анатомических структур легкого, системы сурфактанта и созревающей одновременно с ней антиоксидантной системы легких, что предрасполагает к баротравме, волюмотравме и повреждению кислородом [5–7].
Тесно коррелирует с гестационным сроком масса тела новорожденного. Так, очень низкие значения (Ј 999 г) массы тела были специфичны для больных БЛД, так как определялись только среди них (56,67 %) и не встречались в контрольной группе (р < 0,001).
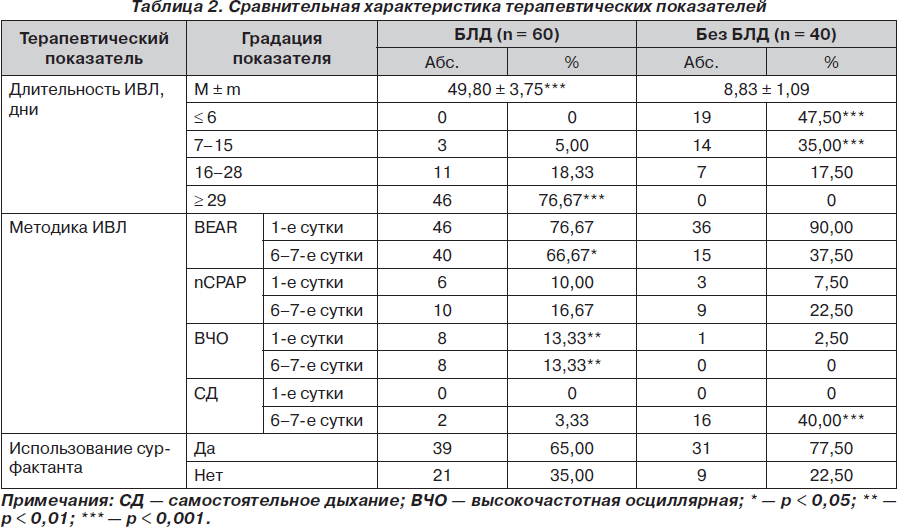
Полученные результаты свидетельствуют, что незрелость легких недоношенного ребенка, маркерами которой выступают гестационный срок и масса тела новорожденного, является важным, но недостаточно патогенетическим фактором БЛД. Пусковой причиной развитии БЛД являются повреждающие легкие новорожденного факторы под влиянием ИВЛ (табл. 2).
Данные табл. 2 свидетельствуют о том, что имеется точная прямая зависимость между частотой развития БЛД и длительностью ИВЛ.
Так, при длительности ИВЛ до 6 дней не отмечено развития БЛД, в интервале 7–15 дней выявлено 5 % больных БЛД, в интервале 16–28 дней — 18,33 %, а при длительности ИВЛ свыше 28 дней формируется основной контингент (76,67 %) больных БЛД (р < 0,001).
Полученные результаты согласуются с данными литературы. Доказано, что токсическое действие высоких концентраций кислорода во вдыхаемой смеси приводит к повреждению эпителиального и эндотелиального барьеров и развитию протеинсодержащего отека легочной ткани, что сопровождается снижением растяжимости альвеол, уже нарушенной вследствие дефицита сурфактанта. Это вызывает усугубление нарушения соотношения между вентиляцией и легочным кровотоком, что требует использования более высоких параметров ИВЛ [7–9].
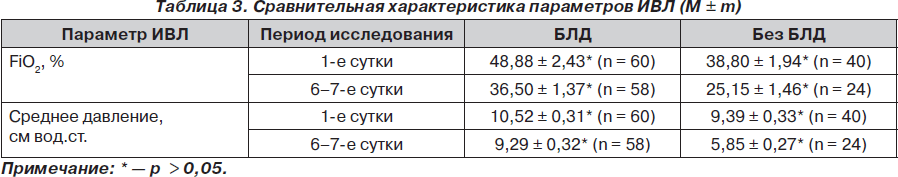
Для сравнения параметров ИВЛ в альтернативных группах были проанализированы значения концентрации кислорода во вдыхаемой смеси и среднее давление как основные повреждающие факторы. Сравнительная характеристика параметров ИВЛ представлена в табл. 3.
Данные табл. 3 свидетельствуют о том, что достоверных отличий в сравниваемых группах нет (р > 0,05), отмечена только тенденция к более быстрому снижению концентрации кислорода во вдыхаемой смеси при проведении ИВЛ и среднего давления в группе контроля, что можно интерпретировать как меньшее повреждение легких в раннем неонатальном периоде в этой группе новорожденных по сравнению с основной группой, в которой в дальнейшем формировалась БЛД.
Изучение роли внутриутробной пневмонии в развитии БЛД показало, что почти у всех детей с БЛД (93,33 %) была диагностирована внутриутробная пневмония, у больных без БЛД частота обнаружения пневмонии (65 %) была существенно ниже (р < 0,001). Внутриутробная пневмония маскирует начало формирования БЛД, являясь при этом важным разрешающим патогенетическим фактором БЛД.
Значение роли диспластических процессов соединительной ткани в формировании БЛД определяется тем, что синдром соединительнотканной дисплазии отмечался исключительно у больных БЛД (8,33 %) и не определялся в контрольной группе (р < 0,05). Наследственно обусловленные особенности синтеза и деградации коллагена в сочетании с воспалительным процессом в бронхоальвеолярной системе способствуют ускоренной и избыточной инициации фибропластических процессов в легких и легочных сосудах.
Изучалась сопутствующая патология, которая может выступать в качестве потенциатора основных патогенетических факторов. Была выявлена тенденция к более частому обнаружению у больных БЛД постнатальной анемии, внутрижелудочковых кровоизлияний (ВЖК) 3–4-й степени, перивентрикулярных ишемий, легочной гипертензии (ЛГ) 1–2-й степени, гемодинамически значимого открытого артериального протока (ОАП), ретинопатии недоношенных и иммунодефицитных состояний (р > 0,05). А постнатальная гипотрофия выявлена только среди больных БЛД (11,67 %; р < 0,05).
В связи с тем что одним из важных патоморфологических субстратов БЛД является гиперактивация фибропластических процессов в бронхолегочной системе, нами изучено содержание в сыворотке крови у больных и здоровых новорожденных трансформирующего фактора роста b1, который участвует в регуляции процессов пролиферации и стимулирует продукцию коллагена и митогенез фибробластов (табл. 4) [10–12].
Из данных табл. 4 следует, что у больных обеих групп отмечено достоверное повышение уровня TGF-b1 по сравнению со здоровыми новорожденными. Однако если у больных без БЛД оно составило 10 % (р < 0,05), то у больных БЛД — 85,5 % (р < 0,001).
Достоверные отличия выявлены и между группами больных: у больных БЛД уровень TGF-β1 был выше на 68,8 % (р < 0,001), чем у больных без БЛД.
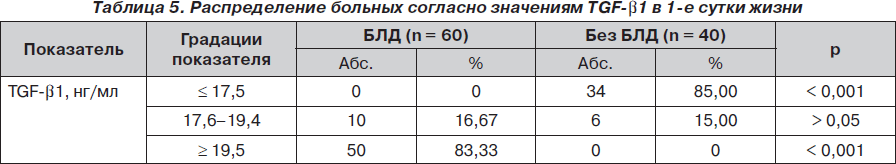
Для выяснения патогенетических пороговых значений TGF-b1 было проведено сопоставление частоты распределения больных БЛД и без БЛД согласно значениям TGF-b1 (табл. 5). Из табл. 5 следует, что относительно низкие значения TGF-b1 (Ј 17,5 нг/мл) были специфичными для больных без БЛД, так как выявлялись только среди этой группы (85 %; р < 0,001).
Интервал значений показателя 17,6–19,4 нг/мл был неспецифичен, ибо равномерно отмечался как среди больных БЛД (16,67 %), так и в контрольной группе (15 %; р > 0,05).
Высокие уровни TGF-b1 (і 19,5нг/мл) были характерными (специфичными) для БЛД и выявлялись только среди больных БЛД (83,33 %; р < 0,001). Следовательно, для новорожденных, находящихся на ИВЛ по поводу дыхательных расстройств, характерно повышение уровня TGF-b1 в плазме крови. Однако у пациентов, у которых формируется БЛД, отмечается более значительный подъем содержания TGF-b1, чем у больных без БЛД.
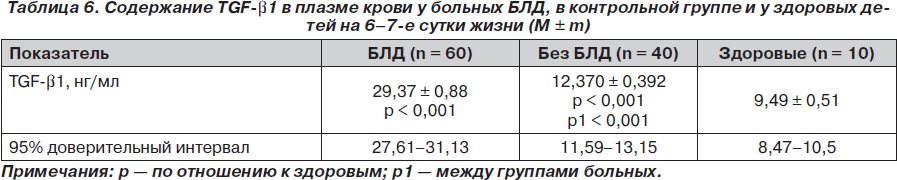
Учитывая, что у больных без БЛД отмечено относительно незначительное повышение уровня TGF-b1, это следует расценить как нормокомпенсацию метаболизма этого противовоспалительного цитокина, а у больных БЛД — как гиперкомпенсацию. Исследование содержания TGF-b1 в плазме крови на 6–7-е сутки жизни больных представлено в табл. 6.
Данные табл. 6 свидетельствуют о том, что закономерности, выявленные в 1-е сутки жизни новорожденных, остаются неизменными и на 6–7-е сутки их жизни. Так, у больных без БЛД отмечено повышение уровня TGF-b1 на 30,5 % (р < 0,001), а у больных БЛД — на 209,4% (р < 0,001). Между группами больных также выявлены значимые различия. При этом у больных БЛД содержание этого противовоспалительного цитокина было выше, чем в группе без БЛД, на 137 % (р < 0,001).
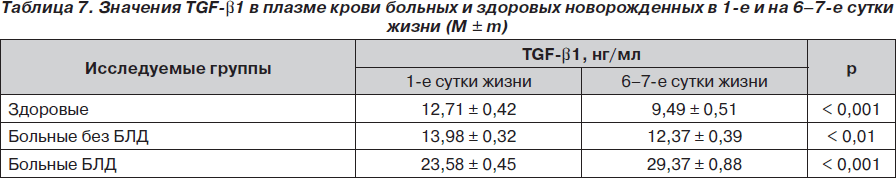
При сравнении динамики значений TGF-b1 в 1-е и 6–7-е сутки жизни детей в рассматриваемых группах установлено (табл. 7), что у здоровых и больных без БЛД имело место достоверное снижение уровня TGF-b1. У здоровых эта динамика более выражена (на 25,4 %; р < 0,001), чем у больных без БЛД (11,4 %; р < 0,01). У больных БЛД, наоборот, отмечено достоверное увеличение (на 24,6 %; р < 0,001) уровня этого цитокина.
Выявленные различия объясняются тем, что у больных без БЛД проводимая терапия приводит к реконвалесценции, а значит, к ослаблению воспалительного процесса в бронхиальной системе и снижению уровня TGF-b1. У больных БЛД, наоборот, на 6–7-е сутки отмечается нарастание морфологических нарушений, что сочетается с адекватным увеличением фактора, противостоящего клеточной альтерации — фактору активации фибропластических процессов (TGF-b1).
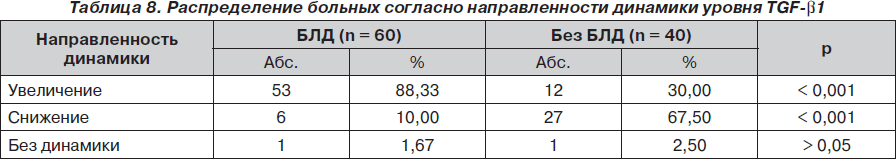
При анализе доли больных, у которых отмечен тот или иной вектор динамики показателя (табл. 8), выявлено, что у больных БЛД в подавляющем числе имело место увеличение уровня TGF-b1 на 6–7-е сутки, в то время как среди пациентов без БЛД доля таких больных составила лишь 1/3 (30 %). Наоборот, доля больных со снижением содержания TGF-b1 на 6–7-е сутки в 6,7 раза чаще наблюдалась среди больных без БЛД (67,5 % против 10 % у больных БЛД; р < 0,001). Что касается больных без динамики показателя, то их частота в группах была очень низкой (1,67 % у больных БЛД и 2,5 % у больных без БЛД) и существенной разницы не имела (р > 0,05).
Таким образом, не только абсолютные значения TGF-b1, но и направленность динамики этого признака на 6–7-е сутки жизни ребенка могут служить надежным критерием прогноза развития БЛД.
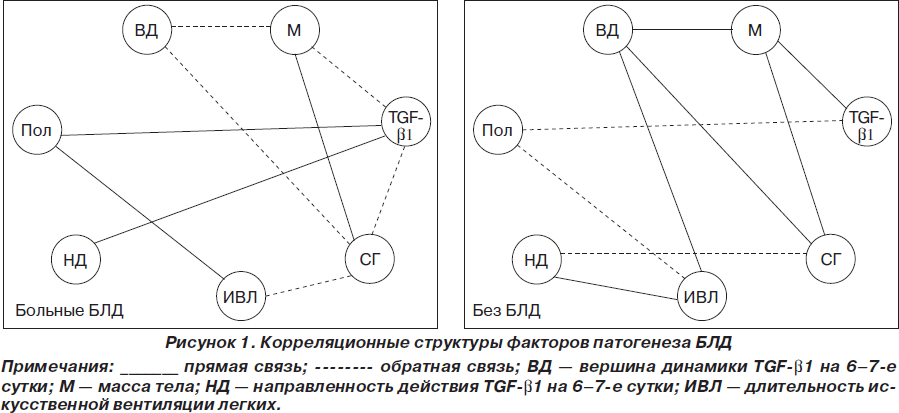
Учитывая, что между TGF-b1 и другими патогенетическими факторами БЛД возникают взаимодействия, были проведены интеркорреляции между ними и осуществлен системный анализ методом корреляционных структур (А.М. Зосимов, В.П. Голік, 2009) [13].
Из рис. 1 следует, что корреляционные структуры больных БЛД и без БЛД по характеру связей принципиально отличаются друг от друга. При этом показатель корреляционного различия (ПКР), который учитывает степень «портретных» различий корреляционных структур, приближался к максимальному значению (ПКР = 92,31 %). Это означает, что у больных БЛД возникает принципиально иная (на 92,31 %), чем у больных без БЛД, патогенетическая доминанта, которая и формирует БЛД.
При этом у больных БЛД TGF-b1 выявил обратные связи с массой тела и сроком гестации. Это означает, что по мере снижения СГ и массы тела новорожденного повышается уровень TGF-b1. Кроме того, TGF-b1 выявил прямые корреляции с полом новорожденного и направленностью динамики TGF-b1 на 6–7-е сутки. Отсюда следует, что у мальчиков отмечаются более высокие значения TGF-b1, чем у девочек, а также то, что чем выше уровень TGF-b1 в 1-е сутки жизни, тем выше вероятность увеличения исходного значения TGF-b1 на 6–7-е сутки жизни. Описанный характер связей носит декомпенсаторную значимость, что и определяет формирование БЛД.
У больных без БЛД TGF-b1 выявил в 2 раза меньшую интеграцию с другими факторами (две связи). При этом TGF-b1 прямо коррелировал с массой тела и обратно — с полом. Такой характер связей имеет компенсаторную значимость. Это объясняется тем, что у больных без БЛД повышение уровня TGF-b1 носит нормокомпенсаторный характер, и поэтому чем более зрелый гестационный возраст новорожденного, а значит, и большая его масса тела, тем более качественный ответ организма отмечается на воспалительный процесс в виде повышения уровня TGF-b1. Обращает на себя внимание и различие связей в группах такого показателя, как длительность ИВЛ у больных БЛД. Этот фактор выявил прямую связь с полом ребенка и обратную — с СГ. Это означает, что у мальчиков вероятность формирования БЛД выше при более длительных сроках ИВЛ. Кроме того, срок гестации определяет длительность ИВЛ, а именно: чем меньше срок гестации, тем более длительные сроки ИВЛ. У больных без БЛД длительность ИВЛ выявила прямые корреляции с направленностью и величиной динамики уровня TGF-b1 на 6–7-е сутки жизни и обратную связь с полом ребенка. Из указанного характера связей вытекает, что чем выше увеличение уровня TGF-b1 на 6–7-е сутки жизни ребенка, тем более длительно применяется ИВЛ больному, и наоборот, снижение содержания TGF-b1 на 6–7-е сутки является благоприятным клиническим моментом, так как требует меньшего срока ИВЛ.
Учитывая, что сила связей между патогенетическими факторами у больных БЛД различна, это дает возможность с помощью метода максимального корреляционного пути (А.М. Зосимов; В.П. Голик, 2009) построить патогенетический паттерн БЛД (рис. 2) [13].
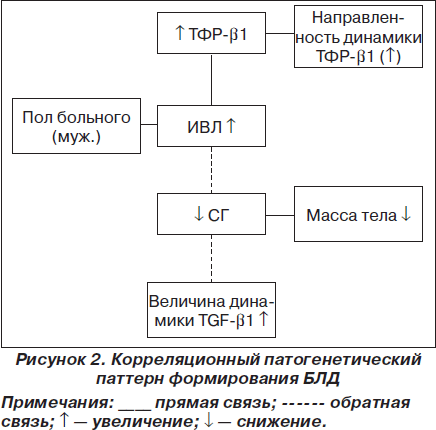
Из рис. 2 следует, что увеличение содержания TGF-b1 связано с повышением длительности ИВЛ, а это, в свою очередь, сочетается с малым сроком гестации и через боковую (второстепенную) ветвь паттерна — с низкой массой тела. Незрелость легочной ткани (СГ) способствует более выраженному возрастанию TGF-b1 на 6–7-е сутки жизни ребенка. В свою очередь, через боковые ветви паттерна пол ребенка прямо связан с длительностью ИВЛ, а увеличение TGF-b1 — с направленностью его динамики, то есть с повышением TGF-b1 на 6–7-е сутки жизни больного.
Выводы
1. Проведенное исследование установило, что в патогенезе БЛД задействовано множество факторов, которые во временном порядке можно разделить на первичные, пусковые и вторичные. В качестве первичных факторов патогенеза выступают: наследственные особенности синтеза и деградации коллагена, пол, незрелость легочной ткани. Пусковой причиной развития БЛД является инфекция в виде пневмонии и ИВЛ, триггирующие воспаление в легких.
2. В качестве главного вторичного фактора патогенеза выступает гиперпродукция цитокина TGF-b1, вызывающего формирование гиперпластических и фиброзирующих процессов в бронхиальной системе и интиме легочных сосудов. При этом важным прогностическим фактором является нарастание уровня TGF-b1 на 6–7-е сутки жизни новорожденного.
3. Модуляторами патогенеза БЛД, то есть второстепенными факторами, которые проявляют свое действие только при наличии главных факторов и потенцируют их действие, явились постнатальная анемия, постнатальная гипотрофия, а также факторы, которые потенциально могут влиять на длительность ИВЛ: ЛГ, постгипоксическая кардиомиопатия, гемодинамически значимый ОАП, ВЖК 3–4-й ст. и постгеморрагическая гидроцефалия, чаще наблюдавшиеся в группе новорожденных с БЛД.
Выявленное принципиальное различие патогенетических матриц у больных с БЛД и без БЛД является научным обоснованием для разработки высоконадежных критериев прогнозирования развития БЛД.
1. Deulofeut R., Critz A., Adams-Chapman I. et al. Avoiding hyperoxia in infants 1250 g is associated with improved short- and long-term outcomes // J. Perinatology. — 2006. — Vol. 26, № 3. — P. 700-705.
2. Mulrooney N., Champion Z., Moss T.J. et al. Surfactant and physiologic responses of preterm lambs to continuous positive airway pressure // J. Respir. Crit. Care Med. — 2005. — Vol. 171, № 5. — P. 488-493.
3. Ichiba H., Saito M., Yamano T. Amniotic fluid transforming growth factor-beta(1) and the risk for the development of neonatal bronchopulmonary dysplasia // Neonatology. — 2009. — Vol. 96, № 4. — P. 156-161.
4. Богданова А.В., Попов С.Д., Нариманбеков Э.О. Ранние морфологические признаки хронической обструктивной болезни легких (бронхолегочной дисплазии) у детей раннего возраста // Тезисы 9-го Национального конгресса по болезням органов дыхания. — М., 2002. — C. 13-14.
5. Богданова А.В., Бойцова Е.В., Старевская С.В. Клинические особенности и течение бронхолегочной дисплазии // Пульмонология. — 2002. — № 1. — С. 28-32.
6. Розенберг О.А., Оссовских В.В., Гранов Д.А. Сурфактант-терапия дыхательной недостаточности критических состояний и других заболеваний легких. — СПб.: ВНИГРИ, 2002. — 132 с.
7. Сафонов И.В., Гребенников В.А. Респираторный дистресс-синдром новорожденных: профилактика и методы терапии (лекция) // Рос. журнал анестезиологии и интенсивной терапии. — 2000. — № 1. — С. 69-80.
8. Harris W.T., Muhlebach M.S., Oster R.A. Transforming growth factor-beta(1) in bronchoalveolar lavage fluid from children with cystic fibrosis // J. Pediatr. Pulmonol. — 2009. — Vol. 44, № 11. — Р. 1057-1064.
9. Lee C.G., Cho S.J., Kang M.J. Early Growth Response Gene 1-mediated Apoptosis Is Essential for Transforming Growth Factor b1-induced Pulmonary Fibrosis // J. Exp. Med. — 2004. — Vol. 32, № 3. — P. 377-389.
10. Lecart C., Cayabyab R., Buckley S. Bioactive transforming growth factor-β in the lungs of extremely low birth weight neonates predicts the need for home oxygen supplementation // Biol. Neonate. — 2000. — Vol. 77, № 4. — Р. 217-223.
11. Jonsson B., Li Y.H., Noack G. et al. Downregulatory cytokines in tracheobronchial aspirate fluid from infants with chronic lung disease of prematurity // J. Acta Paediatr. — 2000. — Vol. 89, № 11. — Р. 1375-1380.
12. Kwinta P., Bik-Multanowski M., Mitkowska Z. et al. Genetic risk factors of bronchopulmonary dysplasia // J. Pediatr. Res. — 2008. — Vol. 64, № 5. — Р. 682-688.
13. Петри А., Сэбин К. Наглядная медицинская статистика: Пер. с англ. — 2-е изд. — М.: Гэотар-Медиа, 2009. — 564 с.