Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Анализ выдыхаемого воздуха как маркер биохимических процессов в организме
Авторы: Клименко В.А., Криворотько Д.Н. Кафедра пропедевтики педиатрии № 2, Харьковский национальный медицинский университет
Рубрики: Педиатрия/Неонатология
Версия для печати
В обзоре литературы отображены основные исторические этапы развития исследований выдыхаемого воздуха и современные представления о биомаркерах конденсата выдыхаемого воздуха у человека.
Диагностика, выдыхаемый воздух, биомаркеры, конденсат.
В здоровом теле — здоровый выдох!
В.А. Скрупский
Одним из важных направлений современной медицины является неинвазивная диагностика. Актуальность проблемы обусловлена щадящими методическими приемами забора материала для анализа, когда пациенту не приходится испытывать боль, физический и эмоциональный дискомфорт; безопасностью исследований ввиду невозможности заражения инфекциями, передающимися через кровь или инструментарий. Неинвазивные методы диагностики могут применяться, с одной стороны, в амбулаторных условиях, что обеспечивает их широкое распространение; с другой стороны — у пациентов в реанимационном отделении, т.к. тяжесть состоянии больного не является противопоказанием для их выполнения. В последнее время в мире возрос интерес к исследованию выдыхаемого воздуха (ВВ) как неинвазивному методу диагностики бронхолегочных, сердечно-сосудистых, желудочно-кишечных и других заболеваний.
Известно, что функциями легких, помимо респираторной, являются метаболическая и выделительная. Именно в легких подвергаются ферментативной трансформации такие вещества, как серотонин, ацетилхолин и, в меньшей степени, норадреналин. Легкие обладают самой мощной ферментной системой, разрушающей брадикинин (80 % брадикинина, введенного в легочный кровоток, инактивируются при однократном прохождении крови через легкие). В эндотелии легочных сосудов синтезируются тромбоксан В2 и простагландины, а 90–95 % простагландинов группы Е и Fа инактивируются также в легких. На внутренней поверхности легочных капилляров локализуется большое количество ангиотензин-конвертирующего фермента, который катализирует превращение ангиотензина I в ангиотензин II. Легкие играют важную роль в регуляции агрегатного состояния крови благодаря своей способности синтезировать факторы свертывающей и противосвертывающей систем (тромбопластин, факторы VII, VIII, гепарин). Через легкие выделяются летучие химические соединения, образующиеся в ходе реакций обмена, происходящих как в легочной ткани, так и во всем организме человека. Так, например, ацетон выделяется в реакциях окисления жиров, аммиак и сероводород — при обмене аминокислот, предельные углеводороды — в ходе перекисного окисления ненасыщенных жирных кислот. По изменению количества и соотношения выделяемых при дыхании веществ можно делать выводы об изменениях обмена веществ и наличии болезни.
С древних времен для диагностики заболеваний учитывался состав ароматических летучих веществ, выделяемых больным при дыхании и через кожу (т.е. запахи, исходящие от пациента). Продолжая традиции античной медицины, известный клиницист начала ХХ века М.Я. Мудров писал: «Обоняние твое да будет чувствительным не к масти благовоний для влас твоих, не к ароматам, из одежды твоей испаряемым, а к запертому и зловонному воздуху, окружающему больного, к заразительному его дыханию, поту и ко всем его извержениям» [1]. Анализ выделяемых человеком ароматических химических веществ имеет для диагностики столь важное значение, что многие запахи описаны как патогномоничные симптомы заболеваний: например, сладковатый «печеночный» запах (выделение метилмеркаптана — метаболита метионина) при печеночной коме, запах ацетона у больного в кетоацидотической коме или запах аммиака при уремии.
Длительный период анализ ВВ носил субъективный и описательный характер, но с 1784 года в его изучении наступил новый этап — назовем его условно «параклинический» или «лабораторный». В этом году французский естествоиспытатель Антуан Лоран Лавуазье вместе с известным физиком и математиком Симоном Лапласом провели первое лабораторное исследование выдыхаемого воздуха у морских свинок. Они установили, что выдыхаемый воздух состоит из удушливой части, дающей угольную кислоту, и инертной части, которая выходит из легких без изменений. Эти части позже назвали углекислым газом и азотом [2, 3]. «Из всех явлений жизни нет более поразительного и заслуживающего внимания, чем дыхание», — пророчески писал А.Л. Лавуазье.
Долгое время (ХVIII–ХIХ века) анализ ВВ проводился химическими методами. Концентрации веществ в ВВ низкие, поэтому для их выявления требовалось пропускание больших объемов воздуха через поглотители и растворы.
В середине XIX века немецкий врач А. Небельтау впервые использовал исследование ВВ для диагностики заболевания — в частности, нарушения обмена углеводов. Он разработал способ определения малых концентраций ацетона в ВВ. Больному предлагалось выдыхать в трубку, опущенную в раствор йодата натрия. Ацетон, содержащийся в воздухе, восстанавливал йод, при этом изменялся цвет раствора, по которому А. Небельтау довольно точно определял концентрацию ацетона [4].
В конце ХІХ — начале ХХ века количество исследований по изучению состава ВВ резко возросло, что было связано, прежде всего, с потребностями военно-промышленного комплекса. В 1914 году в Германии была спущена на воду первая подводная лодка «Лолиго», что стимулировало поиск новых способов получения искусственного воздуха для дыхания под водой. Фриц Хабер, разрабатывая химическое оружие (первые отравляющие газы) с осени 1914 г., параллельно разрабатывал защитную маску с фильтром. Первая газовая атака на фронтах Первой мировой войны 22 апреля 1915 года привела к изобретению в том же году противогаза. Развитие авиации и артиллерии сопровождалось строительством бомбоубежищ с принудительной вентиляцией. В дальнейшем изобретение ядерного оружия стимулировало проектировку бункеров для длительного пребывания в условиях ядерной зимы, а развитие космической науки требовало создания новых поколений систем жизнеобеспечения с искусственной атмосферой. Все эти задачи по разработке технических устройств, обеспечивающих нормальное дыхание в замкнутых пространствах, могли быть решены только при условии изучения состава вдыхаемого и выдыхаемого воздуха. Это та ситуация, когда «не было бы счастья, да несчастье помогло». Помимо углекислого газа, кислорода и азота, в ВВ были обнаружены пары воды, ацетон, этан, аммиак, сероводород, окись углерода и некоторые другие вещества. Anstie в 1874 г. выделил этанол в ВВ — этот метод и сегодня используется в дыхательном тесте на алкоголь [5].
Но качественный прорыв в изучении состава ВВ был сделан только в начале ХХ века, когда начали применяться масс-спектрография (МС) (Томпсон, 1912) и хроматография. Эти аналитические методы позволяли определять вещества, находящиеся в низких концентрациях, и не требовали больших объемов воздуха для выполнения анализа. Хроматография была впервые применена русским ученым-ботаником Михаилом Семеновичем Цветом в 1900 году, но метод был незаслуженно забыт и практически не развивался до 1930-х годов. Возрождение хроматографии связано с именами английских ученых Арчера Мартина и Ричарда Синга, которые в 1941 г. разработали метод распределительной хроматографии, за что им в 1952 году была присуждена Нобелевская премия в области химии [6]. С середины XX века и до наших дней хроматография и масс-спектрография являются одними из наиболее широко применяемых аналитических методов для изучения ВВ. Этими методами в ВВ было определено около 400 летучих метаболитов, многие из которых используются как маркеры воспаления, определены их специфичность и чувствительность для диагностики многих заболеваний. Описание веществ, выявленных в ВВ при различных нозологических формах, в данной статье нецелесообразно, т.к. даже их простое перечисление займет многие страницы. Применительно к анализу летучих веществ ВВ необходимо сделать акцент на трех моментах.
Во-первых, анализ летучих веществ ВВ уже «вышел» из лабораторий и сегодня имеет не только научный и теоретический интерес, но и сугубо практическое значение. Примером являются капнографы (приборы, регистрирующие уровень углекислого газа). С 1943 г. (когда Luft создал первый прибор для регистрации СО2) капнограф — обязательный компонент аппаратов ИВЛ и анестезиологической аппаратуры. Другой пример — определение оксида азота (NO). Впервые его содержание в ВВ было измерено в 1991 г. L. Gustafsson и соавт. у кроликов, морских свинок и людей [7]. В последующем потребовалась одна пятилетка, чтобы значение этого вещества как маркера воспаления было доказано. В 1996 г. группой ведущих исследователей созданы единые рекомендации по стандартизации измерений и оценки выдыхаемого NO — Exhaled and nasal nitric oxide measurements: recommendations [8]. А в 2003 г. получено разрешение FDA и начато промышленное производство детекторов NO [9]. В развитых странах определение оксида азота в ВВ широко применяется в рутинной практике пульмонологами, аллергологами как маркер воспаления дыхательных путей у стероид-наивных пациентов и для оценки эффективности противовоспалительной топической терапии у больных с хроническими обструктивными заболеваниями легких [10–12].
Во-вторых, наибольшая диагностическая значимость анализа ВВ отмечена при заболеваниях органов дыхания — описаны достоверные изменения состава ВВ при бронхиальной астме, ОРВИ, бронхоэктатической болезни, фиброзирующем альвеолите, туберкулезе, реакции отторжения легочного трансплантата, саркоидозе, хроническом бронхите, поражении легких при системной красной волчанке, аллергическом рините и др. [13].
В-третьих, при некоторых нозологических формах анализ ВВ позволяет выявить патологию на той стадии развития, когда другие методы диагностики малочувствительны, неспецифичны и неинформативны. Например, обнаружение алканов и монометилированных алканов в ВВ позволяет диагностировать рак легких на ранних стадиях (Gordon et al., 1985) [14], в то время как стандартные скрининг-исследования при опухоли легких (рентгенография и цитология мокроты) еще не информативны [15]. Исследование данной проблемы было продолжено Phillips et al., в 1999 г. ими определено в ВВ 22 летучих органических вещества (преимущественно алканы и производные бензола), содержание которых было достоверно выше у больных с опухолью легких [16]. Ученые из Италии (Diana Poli et al., 2005) показали возможность использования стиролов (с молекулярной массой 10–12 M) и изопренов (10–9 M) в ВВ как биомаркеров опухолевого процесса — диагноз был корректно установлен у 80 % больных [17].
Таким образом, исследование ВВ продолжается достаточно активно по многим направлениям, и изучение литературы по данной проблеме вселяет в нас уверенность, что в будущем анализ ВВ для диагностики заболеваний станет столь же рутинным методом, как контроль уровня алкоголя в ВВ у водителя транспортного средства работником ГАИ.
Новый этап изучения свойств ВВ начался в конце 70-х годов прошлого века — нобелевский лауреат Linus Pauling (Лайнус Полинг) предложил анализировать конденсат ВВ (КВВ). Используя методы газовой и жидкостной хроматографии, ему удалось идентифицировать до 250 веществ [18], а современные методики позволяют определить до 1000 (!) субстанций в КВВ [19].
С физической точки зрения ВВ представляет собой аэрозоль, состоящий из газообразной среды и взвешенных в ней жидких частиц. ВВ насыщен водяными парами, количество которых составляет примерно 7 мл/кг массы тела в сутки. Взрослый человек выделяет через легкие около 400 мл воды в сутки, но суммарный объем экспиратов зависит от многих внешних (влажность, давление окружающей среды) и внутренних (состояние организма) факторов. Так, при обструктивных заболеваниях легких (бронхиальная астма, хронический обструктивный бронхит) объем экспиратов уменьшается, а при остром бронхите, пневмонии — увеличивается; гидробалластная функция легких уменьшается с возрастом — на 20 % каждые 10 лет, зависит от физической нагрузки и т.д. [20, 21]. Увлажнение ВВ также определяется бронхиальным кровообращением [22]. Водяные пары служат переносчиками многих летучих и нелетучих соединений посредством растворения молекул (согласно коэффициентам растворения) и образования новых химических веществ внутри аэрозольной частицы [23].
Известны два основных метода формирования аэрозольных частиц:
1. Конденсационный — от малого к большому — образование капель жидкости из молекул перенасыщенного пара.
2. Диспергационный — от большого к малому — измельчение бронхоальвеолярной жидкости, выстилающей респираторный тракт, при турбулентном потоке воздуха в дыхательных путях [24, 25].
Средний диаметр аэрозольных частиц в норме при нормальном дыхании у взрослого человека составляет 0,3 мкм, а количество — 0,1–4 частицы в 1 см2 [26]. При охлаждении воздуха водяные пары и содержащиеся в них вещества конденсируются, что делает возможным их количественный анализ.
Таким образом, диагностические возможности исследования КВВ базируются на гипотезе, что изменения концентрации химических веществ в КВВ, сыворотке крови, легочной ткани и бронхоальвеолярной лаважной жидкости однонаправлены [19, 27].
Для получения КВВ используют приборы как серийного производства (EcoScreen® — Jaeger Tonnies Hoechberg, Германия; R Tube® — Respiratory Research, Inc., США), так и самодельные. Принцип действия всех устройств единый: пациент совершает форсированные выдохи в емкость (сосуд, колбу, трубку), в которой водяные пары, содержащиеся в воздухе, конденсируются при охлаждении. Охлаждение осуществляется жидким или сухим льдом, реже — жидким азотом. Для улучшения конденсации водяных паров в емкости для сбора КВВ создается турбулентный поток воздуха (изогнутая трубка, изменение диаметров сосуда). Подобные устройства позволяют собрать у детей старшего возраста и взрослых до 5 мл конденсата за 10–15 мин дыхания. На кафедре пропедевтики педиатрии № 2 ХНМУ (В.А. Клименко, Д.Н. Криворотько, 2009) создано устройство для получения КВВ у детей раннего возраста (заявка подана, № приоритета U 2010 05878 от 10 мая 2010 г.). Устройство состоит из стеклянной изогнутой трубки, помещенной в сосуд с жидким льдом, системы клапанов (вдоха/выдоха) и маски для дыхания. Для сбора конденсата не требуется активного сознательного участия пациента, что делает возможным применение методики с периода новорожденности. За 45 мин спокойного дыхания у новорожденных с пневмонией удается получить 0,1–0,3 мл конденсата.
Большинство биологически активных веществ могут быть исследованы в конденсате, собранном при помощи самодельных приборов. Исключение составляют лейкотриены — учитывая их быстрый метаболизм и нестабильность, они могут быть определены только в замороженных образцах, полученных приборами серийного производства. Например, в устройстве EcoScreen создается температура до –10 °С, что обеспечивает быструю заморозку конденсата.
На состав КВВ может влиять материал, из которого изготовлен контейнер. Так, при исследовании производных липидов прибор должен быть изготовлен из полипропилена и рекомендуется избегать контакта КВВ с полистиреном, который может абсорбировать липиды, влияя на точность измерений [29, 30].
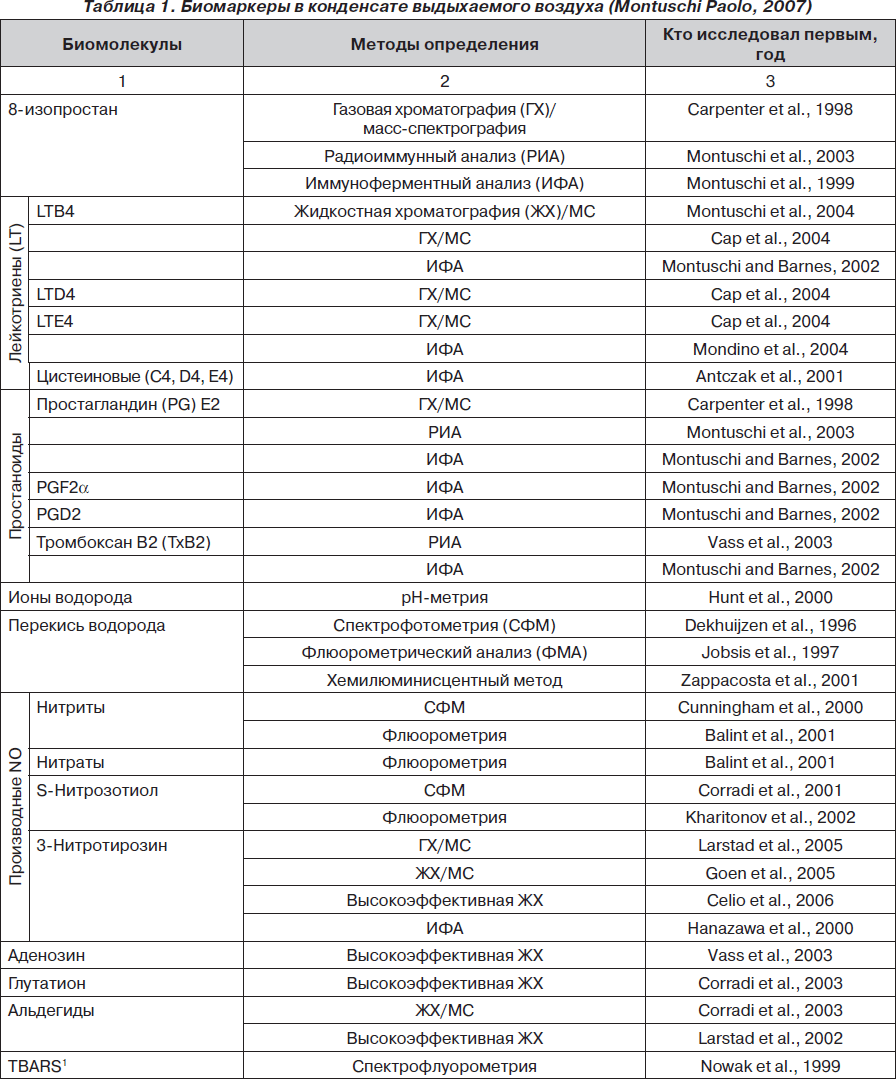
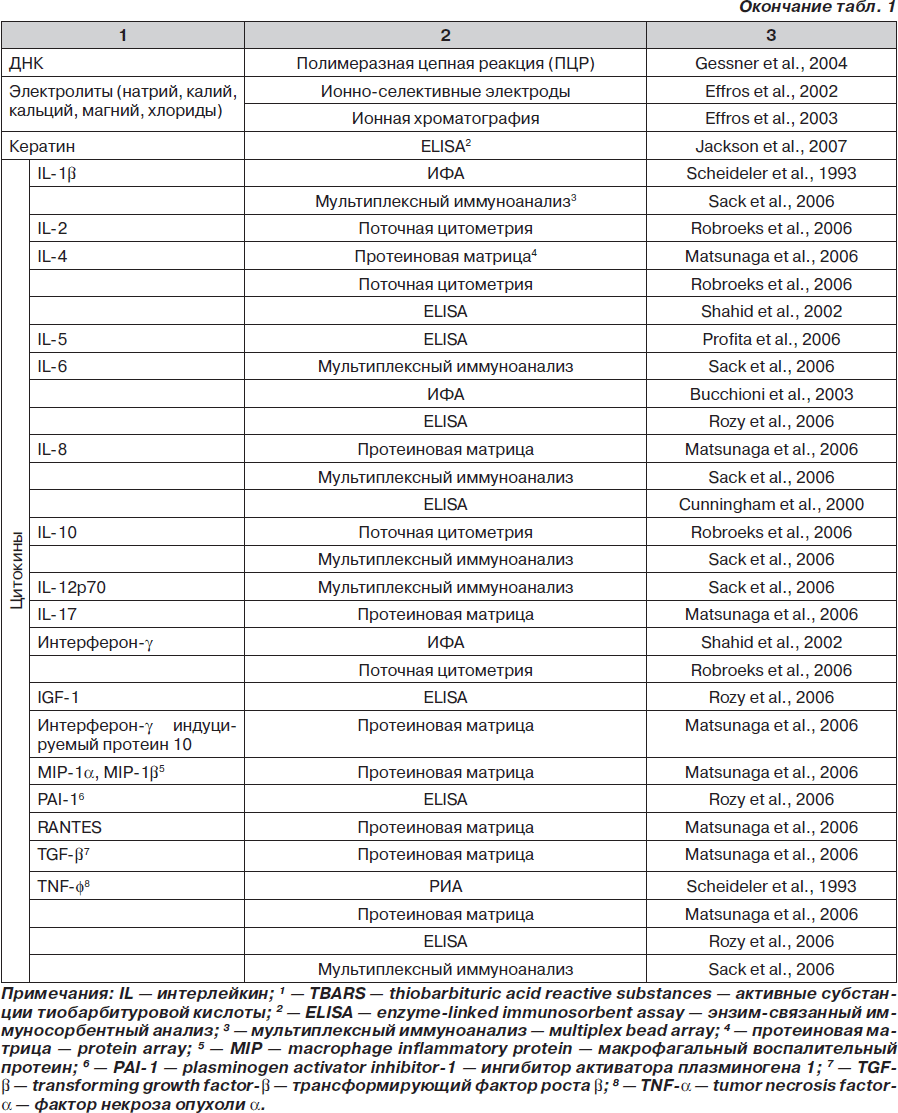
Какие биомаркеры сегодня определены в КВВ? Наиболее полный ответ на этот вопрос содержится в обзоре, выполненном Montuschi Paolo (отделение фармакологии медицинского факультета Католического университета Святого Сердца, Рим, Италия). Обзор опубликован в 2007 году в журнале Therapeutic Advances in Respiratory Disease [31], данные представлены в табл. 1.
Таким образом, конденсат выдыхаемого воздуха является биологической средой, по изменению состава которой можно судить о морфофункциональном состоянии, прежде всего респираторного тракта, а также других систем организма. Сбор и исследование конденсата представляют собой новое перспективное направление современных научных исследований.
1. Чем пахнут болезни // Feldcher. Информационный сайт скорой помощи; http://www.feldsher.ru/news-view-1258.html.
2. Открытие газов // Аllchem. Мы знаем о химии все; http://allchem.ru/pages/history/97.
3. Лавуазье Антуан Лоран. Раздел Наука и техника: Химия / Кругосвет. Энциклопедия online; http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/LAVUAZE_ANTUAN_LORAN.html.
4. Hubbard R.S. Determination of acetone in expired air // J. Biol. Chem. — 1920. — № 43. — Р. 57-65.
5. Baldwin A.D. Anstie’s alcohol limit: Francis Edmund Anstie 1833–1874 // Am. J. Public Health. — 1977. — № 67. — Р. 679-681.
6. Хроматография - Википедия; http://ru.wikipedia.org/wiki.
7. Gustafsson L.E., Leone A.M., Persson M.G., Wiklund N.P., Moncada S. Endogenous nitric oxide is present in the exhaled air of rabbits, guinea pigs and humans // Biochem. Biophys. Res. Commun. — 1991. — № 181. — Р. 852-857.
8. Kharitonov S.A., Alving K., Barnes P.J. Exhaled and nasal nitric oxide measurements: recommendations // Eur. Resp. J. — 1997. — № 10. — Р. l683-1693.
9. Gill M., Graff G.R., Adler A.J., Dweik R.A. Validation study of fractional exhaled nitric oxide measurements using a handheld monitoring device // J. Asthma. — 2006. — № 43. — Р. 731-734.
10. Franklin P.J., Turner S.W., Mutch R.C. Measuring exhaled NO in infants during tidal breathing; methodological issues // Pediat. Pulmol. — 2004. — № 37(1). — Р. 24-30.
11. Strunk R.S. Relationship of exhaled nitric oxide to clinical and inflammatory markers of persistent asthma in children // J. Allergy Clin. Immunol. — 2003. — № 112. — Р. 883-892.
12. Цыпленкова С.Э. Оксид азота в выдыхаемом воздухе: клинико-функциональные параллели при бронхиальной астме у детей // Аллергология: научно-практический журнал. — 2006. — № 2. — С. 48-53.
13. Hunt J. Exhaled breath condensate: an evolving tool for non-invasive evaluation of lung disease // J. Allergy Clin. Immunol. — 2002. — Vol. 110. — P. 28-34.
14. Gordon S.M., Szidon J.P., Krotoszynski B.K., Gibbons R.D., O’Neill H.J. Volatile organic compounds in exhaled air from patients with lung cancer // Clin. Chem. — 1985. — № 31. — Р. 1278-1282.
15. Humphrey L.L., Teutsch S., Johnson M., U.S. Preventive Services Task Force: Lung cancer screening with sputum cytologic examination, chest radiography, and computed tomography: an update for the U.S. Preventive Services Task Force // Ann. Intern. Med. — 2004. — № 140. — Р. 740-753.
16. Phillips M., Gleeson K., Hughes J.M., Greenberg J., Cataneo R.N., Baker L., Mc.Vay W.P. Volatile organic compounds in breath as markers of lung cancer: a cross-sectional study // Lancet. — 1999. — № 353. — Р. 1930-1933.
17. Diana Poli, Paolo Carbognani, Massimo Corradi, Matteo Goldoni, Olga Acampa, Bruno Balbi, Luca Bianchi, Michele Rusca and Antonio Mutti. Exhaled volatile organic compounds in patients with non-small cell lung cancer: cross sectional and nested short-term follow-up study // J. Respiratory Research. — 2005. — № 6(71). — Р. 1186-1465; http://respiratory-research.com/content/6/1/71.
18. Pauling L., Robinson A.B., Teranishi R., Cary P. Quantitative analysis of urine vapor and breath by gas-liquid partition chromatography // Proc. Natl. Acad. Sci. USA. — 1971. — № 68. — Р. 2374-2376.
19. Raed A. Dweik, Anton Amann. Exhaled breath analysis: the new frontier in medical testing // J. Breath Res. — 2008. — № 2; doi: 10.1088/1752-7163/2/3/030301.
20. Mc.Cafferty J.B., Bradshow T.A., Tate S. et al. Effects of breathing pattern and inspired air condition onbreath condensate volume, pH, nitrite and protin concentration // Torax. — 2004. — № 59. — P. 694-698.
21. Яковлева О.А., Баяк Н.Ю., Зорин С.М. Патогенетическое значение конденсата выдыхаемого воздуха в патологии органов дыхания. Нереспираторные функции легких // Сборник научных трудов ВНИИ пульмонологии. — Ленинград, 1988. — С. 67-70.
22. Mc.Fadden E.R. Respiratory heat and water exchange: physiologycal and clinical implications // J. Appl. Physiol. — 1983. — № 54. — P. 326-331.
23. Климанов И.А. Механизмы формирования конденсата выдыхаемого воздуха и маркеры оксидативного стресса при патологиях респираторного тракта // Пульмонология. — 2009. — № 2. — С. 113-119.
24. Климанов И.А., Соодаева С.К., Лисица А.В., Кудрявцев В.Б., Чучалин А.Г. Стандартизация преаналитического этапа исследования конденсата выдыхаемого воздуха // Пульмонология. — 2006. — № 2. — С. 53-55.
25. Райст П. Аэрозоли. Введение в теорию / Под ред. Б.Ф. Садовского. — М.: Мир, 1987. — С. 278.
26. Fairchild C.D., Stempfer J.E. Particle concentration in exhaled breath // Am. Industr. Hyg. Assoc. J. — 1987. — № 48. — P. 948-949.
27. Щербакова Н.В., Начаров П.В., Янов Ю.К. Анализ газового состава выдыхаемого воздуха в диагностике заболеваний // Российская отоларингология. — 2005. — № 4(17). — С. 126-132; http://scholar.google.com/scholar_host?q=info:178WcfHgA20J.
28. Патент № 13276 МГЖ7 G 01 N 33/497. Украина. Лабораторний прилад для отримання конденсату повітря, що видихають / Одинець Ю.В., Наконечна М.О., Наконечна Ю.О.; заявник та патентовласник Харьківський державний медичний університет, № 200509876; Заявл. 20.10.05; Опубл. 15.03.06, Бюл. № 3.
29. Анаев Э.Х., Чучалин А.Г. Исследование конденсата выдыхаемого воздуха в пульмоногии (обзор зарубежной литературы) // Пульмонология. — 2002. — № 2. — С. 57-65.
30. Rosias P.P. et al. Breath condenser coatings affect measurement of biomarkers in exhaled breath condensate // Eur. Respir. J. — 2006. — № 28. — Р. 1036-1041.
31. Montuschi Paolo. Analysis of exhaled breath condensate in respiratory medicine: methodological aspects and potential clinical applications // Therapeutic Advances in Respiratory Disease. — 2007. — Vol. 1(1). — P. 5-23. DOI: 10.1177/ 1753465807082373.