Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Опсонирующая сеть протеинов системы неспецифической защиты респираторного тракта 3. Коллектины: белки сурфактанта (часть 1)
Авторы: Абатуров А.Е. Днепропетровская государственная медицинская академия
Рубрики: Педиатрия/Неонатология
Версия для печати
Введение
Патологоанатом Peter Gruenwald в 1947 году, развивая направление исследований немецкого физиолога Kurt von Neergaard, предположил наличие в легких особого поверхностно-активного вещества, позже названного сурфактантом, которое существенно влияет на эластичность ткани легкого. Термин «сурфактант» является аббревиатурой словосочетания surface active agents (англ.) — поверхностно-активные вещества. А несколько лет спустя, в 1959 году, Mary Ellen Avery и Jere Mead установили, что в основе гиалиновой болезни новорожденного лежит дефицит сурфактанта. Первоначально сурфактант был описан как сложная смесь фосфолипидов и протеинов, которая образует пленку и располагается в альвеолах легких на границе раздела фаз «воздух — жидкость», обусловливая снижение поверхностного натяжения и альвеолярную стабильность. Продукция сурфактанта начинается с 24-й недели внутриутробной жизни, его продуцентами являются альвеолоциты II типа [4, 14, 17, 31, 55]. Приблизительно 10 % массы сурфактанта составляют белки (SP). Они играют определяющую роль в поддержании структурной организации сурфактанта, процессе ремоделирования легких, защите макроорганизма от интервенции инфекционных агентов [70, 92, 112].
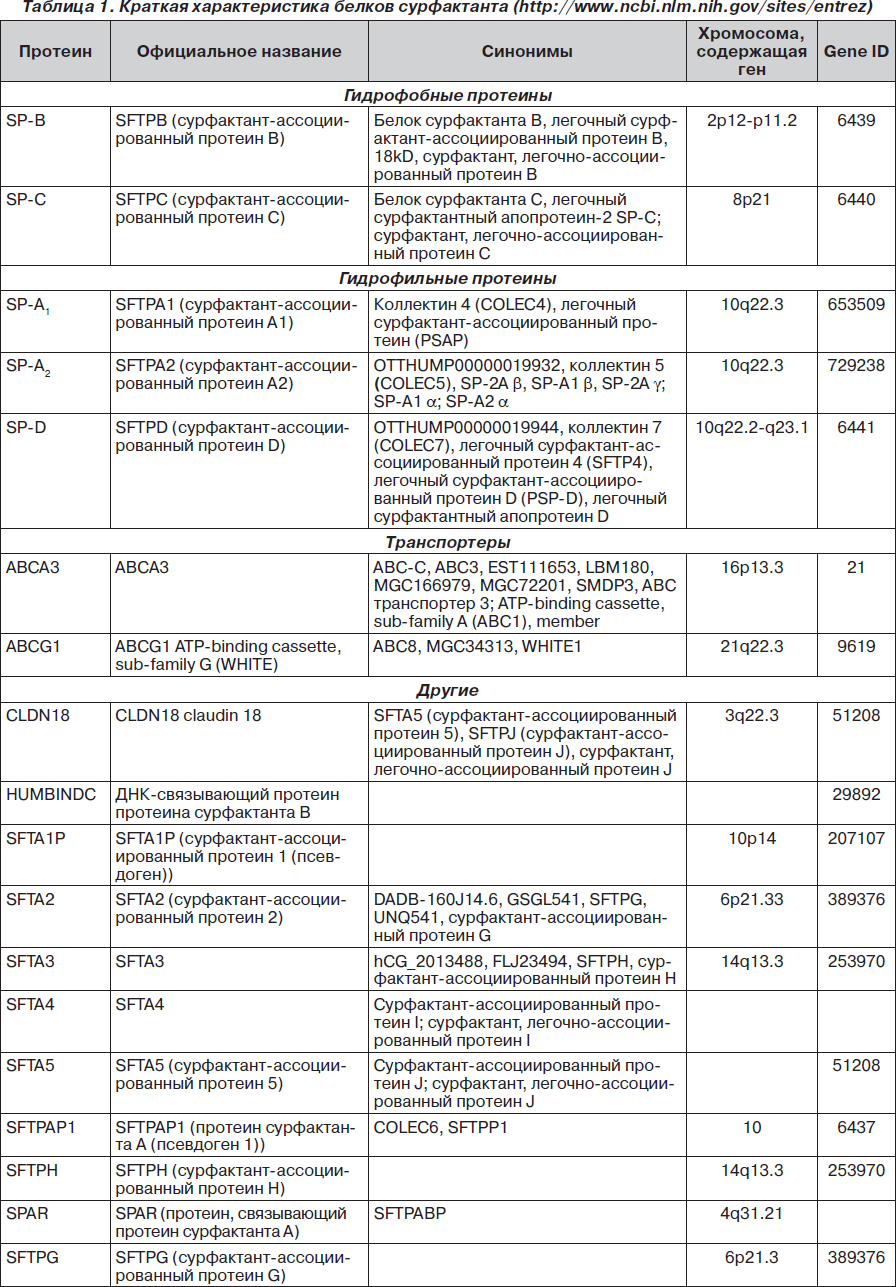
Краткая характеристика белков сурфактанта
Белки сурфактанта относятся к семейству коллектинов и представлены двумя группами — основными (гидрофобными SP-B, SP-C, гидрофильными SP-А, SP-D) и другими (табл. 1) [54, 129].
Гидрофобные SP являются важнейшими компонентами процесса адсорбции и поверхностного распределения фосфолипидов. Сурфактантный протеин SP-B участвует в формировании трубчатого миелина, а SP-C стабилизирует организацию поверхностной пленки [17, 127]. Показано, что выраженное изменение продукции белков сурфактанта сопровождается развитием различных заболеваний легких. Нарушение продукции белков сурфактанта — наиболее важных участников процесса поддержания его гомеостаза (SP-B, SP-C и ABCA3) — приводит к поражению интерстиция легких.
Так, аутосомно-рецессивно наследуемый дефицит SP‑B, который обусловлен мутацией в 121ins2 гена SFTP-B, сопровождается развитием легочного альвеолярного протеиноза с фатальным исходом [75, 128].
Аутосомно-доминантный или спорадический дефицит SP-С приводит к интерстициальному поражению легких в виде хронического пневмонита детей первого года жизни или неспецифического интерстициального пневмонита [64, 128]. Аутосомно-рецессивно наследуемый дефицит протеина ABCA3 (АТФ-связанного транспортера липидов) обусловливает возникновение различных поражений интерстиция легких — легочного альвеолярного протеиноза, десквамативного или неспецифического интерстициального пневмонита [4, 64, 128].
Гидрофильные белки сурфактанта SP-A и SP-D, являясь представителями collagen-like-lectin семейства (группа III лектинов С-типа), активно участвуют в ранней противоинфекционной защите респираторного тракта [29, 119]. Показано, что мыши с нокаутным геном SP-A отличаются высокой восприимчивостью к бактериальным и вирусным инфекционным агентам и развитием выраженного воспалительного процесса в легочной ткани в ответ на разнообразные внешние раздражители [89]. Даже умеренное снижение концентрации SP-D в бронхоальвеолярной жидкости сопровождается увеличением частоты респираторных инфекций у детей, а избыток SP-D является фактором риска развития аллергических заболеваний респираторного тракта [12]. Отсутствие SP-D бронхоальвеолярной жидкости увеличивает риск бактериальной колонизации верхних и нижних дыхательных путей и способствует возникновению бактериемии [123]. В связи с этим данный обзор посвящен белкам сурфактанта SP-A и SP-D как одним из ключевых компонентов неспецифической защиты респираторного тракта.
Белки сурфактанта SP-A и SP-D
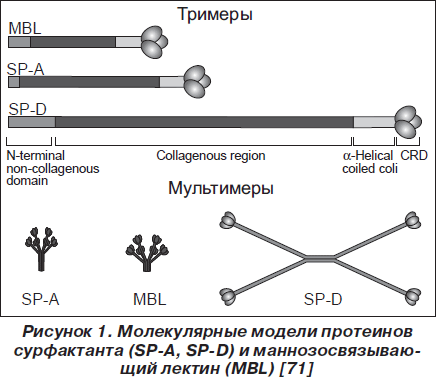
Мультимеры (октодекамеры) SP-A1 и биологически более активный SP-A2 (26–36 kDa) состоят из шести тримеров, связанных дисульфидными связями. Их пространственная организация напоминает букет цветов [25, 62, 117]. Гены SP-A1 и SP-A2 гомологичны на 94 % [71, 78]. Молекула SP-D (43 kDa) состоит из четырех коллагеновых тримеров, связанных дисульфидными связями. Ее форма имеет своеобразную крестообразную структуру (рис. 1) [20].
В респираторном тракте SP-А и SP-D продуцируются альвеолоцитами II типа, клетками Клара, эпителиоцитами слизистой оболочки трахеи и бронхов [20, 95, 125]. Экстрапульмональный синтез SP-А отмечен в ткани матки мыши, в слуховом ходе свиней; SP-D — в многочисленных органах и тканях человека. В частности, в поджелудочной, молочной, щитовидной, слезных, слюнных, потовых железах, в пищеводе, ротовой полости, тонком кишечнике, во внутрипеченочных желчных ходах, мочевом пузыре, почках, в простате, матке, яичках, плаценте, сердце, мозге [23, 56, 76, 124, 129].
У здоровых людей SP-А находится преимущественно в связанном с фосфолипидами состоянии и только 1 % — в свободном виде. Его концентрация в бронхоальвеолярной жидкости в среднем составляет 2000–3000 нг/мл. Концентрация SP-D колеблется приблизительно на уровне 250–600 нг/мл, а у детей раннего возраста — 303 ± 68 нг/мл. Причем концентрация как SP-А, так и SP-D в бронхоальвеолярной жидкости достоверно ниже, чем в бронхиальном секрете [6, 13, 27, 72, 108]. SP-D присутствует и в сыворотке крови, его концентрация у здоровых людей в среднем составляет 40 ± 51 нг/мл [102].
Усиление продукции SP-А и SP-D в респираторном тракте обусловлено индуцирующим влиянием патоген-ассоциированных молекулярных структур (РАМР) инфекционных агентов, аллергенов и других факторов, которое сопровождается активацией эпителиоцитов респираторного тракта. Также индукторами продукции данных SP являются фактор роста кератиноцитов и IL-4 [30, 74, 108, 111]. По мнению J. Van de Wetering и соавт. [125], SP-А и SP-D являются местными аналогами острофазовых белков, уровень концентрации которых резко повышается в острый период заболевания. Затяжное и хроническое течение воспалительного процесса респираторного тракта сопровождается снижением концентрации SP в бронхоальвеолярной жидкости, которая, вероятно, обусловлена ингибицией синтеза, усиленным протеолизом нейтрофильными сериновыми протеазами (катепсином G, эластазой, протеиназой 3) или повышенным потреблением SP-A, SP-D в процессе фагоцитоза [9, 62, 66, 87].
Механизм действия
Белки сурфактанта SP-A, SP-D принимают участие во множестве пато- и физиологических процессов.
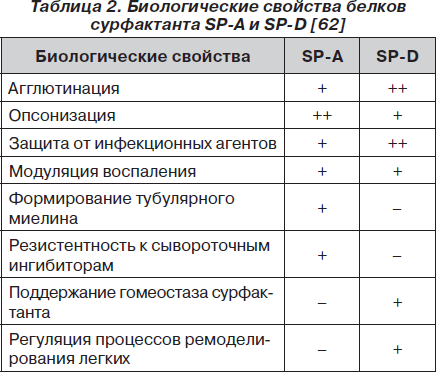
В системе регуляции гомеостаза сурфактанта SP-А является определенно важным компонентом, который влияет на организацию и стабилизацию трубчатого миелина, на секрецию, адсорбцию и поглощение фосфолипидов альвеолоцитами II типа [131]. Он повышает резистентность сурфактанта к ингибирующему действию сывороточных протеинов. SP-А инактивирует 1a-антитрипсин, таким образом участвуя в регуляции процесса эластолиза [93]. Сурфактантный протеин D принимает участие в регуляции процессов ремоделирования легких, поддержании стабильности структуры сурфактанта [62].
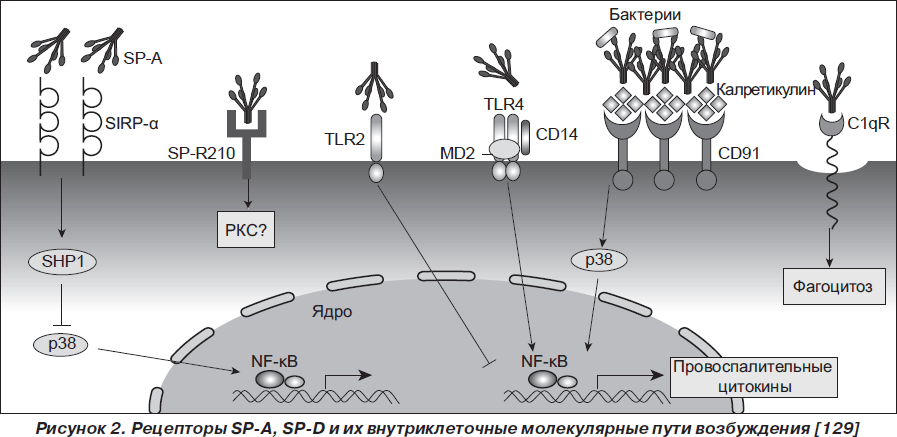
Белки сурфактанта SP-A, SP-D реализуют свое влияние на клетки макроорганизма через взаимодействие с несколькими рецепторами — C1qR, рецептором SP-A 210-kD (SP-R210), гликопротеином gp 340, CD91, коингибиторным сигнал-ингибирующим трансмембранным регуляторным белком А (SIRP-a). SP-A, SP-D обладают способностью модулировать активность трансмембранных Toll-подобных рецепторов (TLR2, TLR4) (рис. 2) [5, 91, 121, 129].
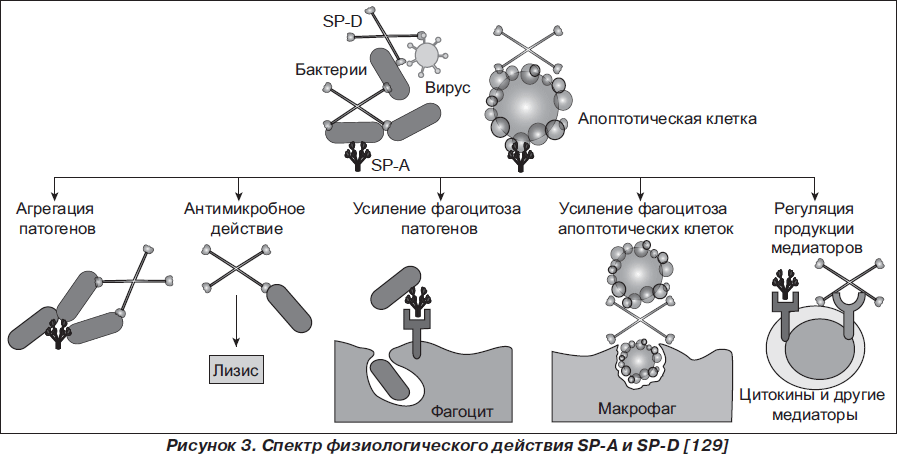
Краткая характеристика биологических свойств SP-A и SP-D и спектра их действия представлена в табл. 2 и на рис. 2, 3.
Список литературы находится в редакции