Международный эндокринологический журнал 3 (35) 2011
Вернуться к номеру
Особенности гонартроза у больных ожирением и сахарным диабетом
Авторы: Красивина И.Г., ГОУВПО «Ярославская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию», Россия
Рубрики: Эндокринология
Версия для печати
Введение
Остеоартроз (ОА) представляет собой гетерогенную группу хронических прогрессирующих заболеваний синовиальных суставов с общностью биологических, морфологических, клинических признаков и единым исходом [1]. Параллельное вовлечение в патологический процесс суставного хряща, синовиальной мембраны, субхондральной кости, капсулы, связок и параартикулярных мышц позволяет считать ОА органной патологией [2].
Остеоартроз относится к распространенным заболеваниям, среди жителей России частота его регистрации составляет 85 % от всех болезней костно-мышечной системы (В.А. Насонова и соавт., 2009). Преимущественная распространенность ОА у лиц пожилого возраста определяет высокую степень полиморбидности [3].
Значимым фактором нарастания заболеваемости ОА является пандемия неинфекционных метаболических заболеваний. Глобальные прогнозы на 2030 год: прирост больных сахарным диабетом (CД) — в 2,3 раза, ожирением — в 1,5 раза. Тенденция к увеличению продолжительности жизни закономерно повышает вероятность сочетания у одного пациента этих хронических, медленно и длительное время латентно развивающихся заболеваний. Наиболее часто остеоартритический процесс поражает коленный сустав, особенно у женщин с ожирением [4].
Ожирение традиционно рассматривается и как биомеханический фактор риска развития и прогрессирования гонартроза [5], и как метаболический предиктор, повышающий риск манифестации ОА для таких локализаций, как коленный сустав и суставы кисти. Имеются сведения о повышенном уровне накопления липидов и дисбалансе катаболических и анаболических процессов в костной ткани у больных ОА.
Данные о связи нарушений гликемического контроля с развитием первичного ОА противоречивы: от прямых указаний на хроническую гипергликемию как фактор повышенного риска повреждения соединительнотканных структур до исследований, отрицающих зависимость ОА от наличия сахарного диабета.
С точки зрения метаболизма структурные компоненты сустава различаются по типу и характеру использования субстратов: мышечная ткань может использовать как глюкозу, так и свободные жирные кислоты, а суставной хрящ, связки, субхондральная кость обеспечиваются энергией только за счет глюкозы. Обеспечение суставного хряща глюкозой регулируется присутствием в нем 8 изоформ инсулинонезависимых белков-транспортеров семейства GLUT, а единственная инсулинозависимая изоформа GLUT4 экспрессируется в мышечной и жировой ткани. В мышце преобладающим является аэробное окисление субстратов, а в соединительнотканных структурах доминирующий путь энергообеспечения — анаэробный гликолиз, запускающийся при активации GLUT1 и GLUT3. Метаболическая активность хондроцитов здорового суставного хряща зависит от внеклеточной концентрации глюкозы и нарушается в условиях остеоартритического повреждения (A. Mobasheri et al., 2010).
Несмотря на признание значимости метаболических нарушений в патогенезе ОА, коррекции баланса нутриентов в питании пациентов с данным заболеванием отводится вторичная роль. Существуют предложения улучшить состояние суставов диетическими мероприятиями, направленными на уменьшение массы тела, на обеспечение хряща глюкозой, гликозаминогликанами, аминокислотами и микроэлементами.
В лечении ОА широко используются препараты, содержащие глюкозамин и хондроитин. Данные вещества являются компонентами естественного питания человека и в настоящее время включаются в нормы потребления пищевых веществ наряду с микроэлементами и витаминами.
Цель исследования — изучить особенности клинического течения гонартроза на фоне ожирения и сахарного диабета 2-го типа (СД2), выявить факторы неблагоприятного артрозогенного воздействия нарушений липидного и углеводного метаболизма и наметить пути их немедикаментозной коррекции.
Материалы и методы исследования
В исследование включено 386 женщин с остеоартрозом коленных суставов в возрасте от 41 до 79 лет (61,3 ± 7,8 года).
Диагноз гонартроза устанавливался в соответствии с критериями American Rheumatism Association (1986). При определении рентгенологической стадии заболевания использовали классификацию по J.H. Kellgren и J.S. Lawrenсe (1958).
Клиническая характеристика больных
Степень нарушения массы тела оценивалась по индексу массы тела (ИМТ). Нормальная масса тела (ИМТ = 18,5–24,9 кг/м2) была выявлена у 36 человек (10 %), избыточная масса тела (ИМТ = 25–29,9 кг/м2) обнаружена у 114 человек (29,5 %), ожирение 1-й степени (ИМТ = 30–34,9 кг/м2) — у 125 человек (32,4 %), ожирение 2-й степени (ИМТ = 35–39,9 кг/м2) — у 71 человека (18,4 %), ожирение 3-й степени (ИМТ ≥ 40 кг/м2) — у 40 человек (10,4 %).
Больные с сопутствующим СД 2-го типа составляли 42 %. Подавляющее большинство участниц исследования (82 %) страдало артериальной гипертензией различной степени и получало соответствующую гипотензивную терапию.
Методы исследования
Клинический осмотр пациентов проводился в соответствии с общепринятыми подходами и включал:
1. Сбор анамнеза: давность заболевания, течение заболевания, лечение основного заболевания, наличие и лечение сопутствующей патологии.
2. Объективное обследование: антропометрические данные: определение ИМТ, величины окружности талии (ОТ), коэффициента «талия/бедра» (КТБ).
3. Объективное исследование коленных суставов:
3.1. Пальпаторные болевые характеристики, ранжированные в баллах от 0 (отсутствие болезненности при пальпации) до 3 (1 — незначительная, 2 — умеренная, 3 — резко выраженная болезненность при пальпации) в следующих точках: проекция суставной щели, верхний и нижний медиальные энтезы, верхний и нижний латеральные энтезы, бугристость большеберцовой кости (pes anserinum), глубокая инфрапателлярная сумка.
3.2. Определение продолжительности утренней скованности со слов пациента (в минутах).
4. Функциональное обследование коленных суставов:
4.1. Определение амплитуды активных безболезненных движений в коленных суставах (в градусах).
4.2. Динамическая гравиметрическая проба с целью оценки работоспособности мышц бедра (патент РФ № 2289296).
5. Метод анкетирования: определение выраженности боли по визуально-аналоговой шкале (ВАШ), степени функциональной недостаточности суставов с помощью анкеты FAS-9 (патент РФ № 2286124), альгофункционального индекса Lequesne (АФИ_L), шкал индекса WOMAC, оценка качества жизни по одноименной шкале опросника KOOS, анализ пищевого рациона (суточная калорийность и макронутриентный состав).
6. Инструментальные методы исследования коленных суставов:
6.1. Рентгенография кистей и коленных суставов.
6.2. Ультразвуковое исследование коленных суставов на ультрасонографе Nemio Toshiba XG с линейным датчиком 7,5 МГц. Оценивали количественно (в мм) толщину синовиальной оболочки (СО), высоту суставного хряща (СХ), полуколичественно (в баллах) — выраженность синовиальной экссудации (синовиальной жидкости — СЖ) и остеофитоза (ОФ), регистрировали наличие кист Бейкера.
7. Лабораторные методы включали определение уровня глюкозы глюкозооксидазным методом Триндера, концентрации С-реактивного белка (СРБ) в высокочувствительном иммунотурбидиметрическом тесте с мультикалибратором, общего холестерина и триглицеридов ферментативным методом Триндера, мочевой кислоты в плазме венозной крови уриказным методом, гликозилированного гемоглобина HbA1c в цельной капиллярной крови реакцией «сэндвичевого» типа на аппарате Nycocard Reader II, анализ синовиальной жидкости с оценкой содержания глюкозы, общего белка и СРБ.
Для структуризации параметров, оцениваемых при клиническом и функциональном обследовании пациента с гонартрозом, выделяли четыре профиля показателей (боль, дисфункция, скованность, качество жизни), представленных в долях единицы от наихудшего значения. Сумма приведенных к единице параметров в каждом профиле формировала соответствующие рейтинги: боли (Рейт_Б; 0–5 баллов), дисфункции (Рейт_ДФ; 0–5 баллов), скованности (Рейт_Ск; 0–1 балл), снижения качества жизни (Рейт_сКЖ; 0–1 балл). Сумма рейтингов максимально могла составить 12 баллов. В качестве интегрирующего все профили параметра вычисляли рейтинг больного ОА (Рейт_ОА), выражаемый в процентах от максимального.
Статистическая обработка результатов исследования проводилась на PC Pentium IV при помощи программного обеспечения, включающего электронные таблицы Excel 7.00, пакеты статистических программ Primer of Biostatistics (Version 4.03, Copyright 1998, McGraw Hill) и Statistica (Version 7.0, Copyright 2005, Stat Soft, Inc). Вычисляли средние значения и стандартные отклонения средних при нормальном распределении признаков; медианы и межквартильные интервалы при распределениях, отличающихся от нормальных). Оценка межгрупповых различий проводилась с использованием параметрических (дисперсионный анализ, t-критерий Стьюдента с поправкой Бонферрони, ANOVA) и непараметрических (критерии Манна — Уитни, Крускела — Уоллиса, Уилкоксона, медианный тест) методов. Сопряженность качественных и полуколичественных показателей оценивали по критерию c2. Взаимосвязи изучаемых признаков изучали с помощью ранговой корреляции Спирмена, множественного регрессионного анализа, логистической регрессии, факторного анализа. За уровень статистической значимости принималось значение p < 0,05.
Результаты исследования и их обсуждение
Особенности проявлений гонартроза при различных градациях ИМТ
Проведено сравнение изучаемых параметров в группах нормальной массы тела (Норм_МТ), избыточной массы тела (Изб_МТ), ожирения 1-й (ОЖ1), 2-й (ОЖ2) и 3-й (ОЖ3) степени.
Первая рентгенологическая стадия имела место почти у половины (44,4 %) больных Норм_МТ, реже обнаруживалась у пациентов Изб_МТ — в 2,6 раза (16,8 %), у больных ОЖ1 — в 3,7 раза (12 %), ОЖ2 — в 31,7 раза (1,4 %) и не встречалась при ОЖ3. Значительно выраженные рентгенологические признаки ОА (Kellgren — Lawrenсe III) выявлялись у 11,1 % женщин с нормальной массой тела, далее их частота возрастала: при избыточной массе тела — в 1,9 раза (21,2 %), при ожирении 1-й степени — в 2,7 раза (30,4 %), при ожирении второй степени — в 4,6 раза (50,7 %), при ожирении третьей степени — в 5,6 раза (62,5 %) по сравнению с нормальной массой тела (c2 = 73,1; р = 0,0001).
Интенсивность боли по ВАШ во время ночного отдыха и комплексная оценка боли по шкале WOMAC_боль у больных ОА с нормальной массой тела были статистически значимо меньше, чем при всех других градациях ИМТ, а выраженность боли по ВАШ при дневных нагрузках и при пальпации периартикулярных структур у данной подгруппы пациенток была значимо ниже лишь по сравнению с женщинами с ожирением 2-й и 3-й степени. Функция коленных суставов была в меньшей степени ограничена у женщин с нормальной массой тела по сравнению с больными всех других градаций ИМТ по таким параметрам, как АФИ_L, WOMAC_активность, FAS_ноги, амплитуда подвижности коленных суставов. Работоспособность параартикулярных мышц колена пациенток с ОА снижалась у больных ОЖ2 и ОЖ3 относительно Норм_МТ и Изб_МТ на 48,5 % (0,009), а в ОЖ1 — на 44 % (0,01).
У больных Норм_МТ относительно Изб_МТ, ОЖ1, ОЖ2 и ОЖ3 были ниже: Рейт_Б — на 33,3; 38,9; 44,4; 55,6 % (F = 7,5; р < 0,0001), Рейт_ДФ — на 26,7; 40,0; 40,0; 46,7 % (F = 9,8; р < 0,0001) соответственно. Больные Изб_МТ отличались от ОЖ3 меньшими Рейт_Б — на 16,7 % и Рейт_ДФ — на 15,8 %. У пациенток Норм_МТ был меньше на 20 % Рейт_Ск относительно всех градаций ИМТ (F = 4,2; р = 0,0025). Пациентки ОЖ3 отмечали ухудшение КЖ на 75,0; 40,0 и 16,7 % относительно Норм_МТ, Изб_МТ и ОЖ1–ОЖ2 соответственно (F = 8,5; р < 0,0001). У больных Норм_МТ Рейт_ОА был благоприятнее на 28,8; 36,8; 39,0 и 49,0 % относительно Изб_МТ, ОЖ1, ОЖ2 и ОЖ3 соответственно (F = 9,6; p < 0,0001).
Ультразвуковое исследование коленных суставов выявило значимые различия толщины СО, выраженности ОФ, количества СЖ, толщины СХ в латеральном отделе тибиофеморального сочленения у больных Норм_МТ относительно других градаций ИМТ.
Группа Изб_МТ по толщине СО и высоте СХ латерального надмыщелка бедра отличалась только от Норм_МТ (+45,4 и –12,1 % соответственно), но не имела различий с больными ожирением, а по выраженности ОФ и количеству СЖ занимала промежуточную позицию между группами с нормальной массой тела и ожирением. Снижение высоты СХ в медиальном отделе тибиофеморального сочленения не зависело от градации ИМТ. Больные Норм_МТ отличались от остальных отсутствием кист Бейкера, которые определялись у пациентов Изб_МТ (28,6 %), ОЖ1 (41,5 %), ОЖ2 (29,6 %) и ОЖ3 (39,3 %) (c2 = 15,2; р = 0,004).
Сопряженность ожирения и системного маловыраженного воспаления подтверждена выявлением при ожирении 2-й и 3-й степени повышенной концентрации СРБ, большей соответственно на 51,1 % (p < 0,05) и 69,8 % (p < 0,05) относительно больных Норм_МТ, на 30,2 % (p < 0,05) и 46,3 % (p < 0,05) — по сравнению с пациентками Изб_МТ. Более того, у больных с 3-й степенью ожирения концентрация СРБ была на 28,0 % больше относительно ОЖ1.
Взаимосвязи величины окружности талии и проявлений гонартроза
Для выявления абдоминального ожирения в качестве скринингового параметра метаболического синдрома (МС) Международная диабетическая федерация (2005) и Всероссийское научное общество кардиологов (2009) рекомендуют измерение ОТ. Величина ОТ ≥ 80 см для женщин европеоидной группы рассматривается в качестве главного критерия МС. В обследованном контингенте женщин с ОТ < 80 см было 25 человек (6,5 %), то есть даже меньше, чем больных Норм_МТ (36 человек, 9,3 %). С целью оценки влияния абсолютного значения ОТ на проявления ОА обследованные женщины были распределены в группы, сформированные по терцильным значениям ОТ.
Группа верхнего терциля ОТ (ВТ_ОТ; n = 129) характеризовалась большим на 22,7 % Рейт_Б (F = 13,9; р < 0,0001) и на 20 % — Рейт_Ск (F = 6,6; р = 0,0016) относительно нижнего терциля ОТ (НТ_ОТ; n = 129) и не отличалась по данным параметрам от среднего терциля ОТ (СТ_ОТ; n = 128). У больных ВТ_ОТ был выше на 22,2 и 10 % Рейт_ДФ (F = 17,1; р < 0,0001), на 50 и 20 % — Рейт_сКЖ (F = 13,9; р < 0,0001), на 23,2 и 7,4 % — Рейт_ОА (F = 17,0; р < 0,0001) относительно НТ_ОТ и СТ_ОТ соответственно.
Анализ взаимосвязей между антропометрическими проявлениями ожирения и клинико-функциональными характеристиками больных ОА выявил наибольшее количество слабых корреляций величины ОТ с выраженностью боли и нарушения функции в подгруппе 236 женщин с ожирением разной степени.
Логистический регрессионный анализ силы влияния антропометрических параметров на тяжесть суставного синдрома
Сравнение силы влияния антропометрических характеристик на тяжесть суставного синдрома проведено методом логистической регрессии. В качестве зависимой дихотомической переменной создан параметр «тяжесть Рейт_ОА», который расценивали как нетяжелый при его значениях менее 47 % и как тяжелый — при значениях более 47 % (данное значение соответствовало медиане значений Рейт_ОА в обследованной выборке больных).
Обнаружено более сильное влияние величины ОТ на тяжесть Рейт_ОА. Отношение шансов на единицу измерения позволяет прогнозировать при увеличении ОТ на 1 см повышение на 4 % вероятности тяжелого Рейт_ОА, а прирост ОТ на 5 см будет предиктором 22%-ной вероятности утяжеления суставного синдрома.
Анализ проявлений ОА у больных с нарушениями липидного обмена, клинически манифестирующими как различная степень избытка массы тела, выявил скачкообразное ухудшение параметров боли, дисфункции, скованности, качества жизни при переходе от нормальной массы тела к избыточной с более плавным приростом боли, дисфункции, ухудшения качества жизни, но не скованности. Ожирение 3-й степени характеризовалось значимым (р = 0,008) снижением работоспособности параартикулярных мышц коленных суставов относительно более низких градаций ИМТ. Артрозогенный потенциал ожирения проявлялся в увеличении частоты III рентгенологической стадии (c2 = 73,1; р < 0,0001), выявлением при артросонографии более грубого остеофитоза и более выраженного истончения суставного хряща с усилением градации ИМТ. Провоспалительная роль ожирения отмечалась при ожирении 2-й и 3-й степени, при которых зафиксировано увеличение концентрации СРБ и количества синовиальной жидкости в полости коленных суставов по сравнению с более низкими градациями ИМТ. Особо неблагоприятным фактором риска тяжелой степени клинико-функциональной манифестации ОА является наличие абдоминального типа распределения жира, его количество, косвенно определяемое по величине окружности талии.
Влияние сопутствующего СД 2-го типа на проявления гонартроза
В изучаемой выборке больных ОА у 42 % участниц имел место сопутствующий СД 2-го типа. Сопоставлены клинические, артросонографические и лабораторные параметры в группах ОА и ОА + СД2. Группы не различались по возрасту, ИМТ, окружности талии, наличию узелковой формы ОА и давности суставного синдрома. В обеих группах преобладали больные с избыточной массой тела и ожирением 1-й степени (65 и 57 %), лица с нормальной массой тела составляли 8,5 и 10,5 % .
Частота выявления рентгенологических стадий гонартроза различалась между группами: первая рентгенологическая стадия встречалась у больных ОА в 2,6 раза чаще (18 % против 7 %), в то время как третья рентгенологическая стадия в два раза чаще (46 % против 23 %) встречалась у пациентов ОА + СД2 (c2 = 25,5; р = 0,001).
У больных ОА + СД2 отмечались более низкие показатели: Рейт_Б — на 22,2 % (< 0,00001), Рейт_ДФ — на 22,7 % (< 0,00001), Рейт_Ск — на 28,6 % (< 0,00001), Рейт_сКЖ — на 16,7 % (< 0,00001), Рейт_ОА — на 22,9 % были меньше, чем в группе ОА.
Проведено сравнение картины ультразвуковой визуализации коленных суставов в группах ОА и ОА + СД2.
У больных ОА + СД2 определялся более выраженный ОФ: в 1,4 раза (t = 6,1; p = 0,0001) с латеральной и в 1,2 раза (t = 3,0; p = 0,003) с медиальной стороны тибиофеморального сочленения, снижение высоты СХ на 30,9 % над латеральным (t = 6,3; p = 0,0001) и на 10,9 % (t = 2,3; p = 0,023) — над медиальным мыщелком большеберцовой кости, а также была на 39,1 % меньше (t = 6,9; p = 0,0001) толщина СО и в 1,6 раза менее выражена (t = 6,1; p = 0,0001) экссудация в полости коленных суставов. Среди пациентов ОА + СД2 преобладали лица с физиологическим (0 баллов) и минимальным (1 балл) объемом синовиальной жидкости, а в группе ОА — лица с выраженной (3–4 балла) экссудацией (c2 = 40,7; р < 0,00001).
Таким образом, при ультразвуковом исследовании коленных суставов у больных группы ОА + СД2 отмечались более выраженные дегенеративно-дистрофические изменения, проявляющие истончением суставного хряща и более грубым остеофитозом, с преобладанием поражения латерального отдела тибиофеморального сочленения, но при этом меньшей пролиферацией синовиальной оболочки и меньшим количеством синовиальной жидкости в полости коленых суставов.
Анализ синовиальной жидкости у больных ОА и ОА + СД2
У больных с выраженным синовитом (53 образца от больных ОА и 22 образца от больных ОА + СД2) проведен анализ синовиальной жидкости, который выявил значимое отличие у пациентов с СД 2-го типа по уровню глюкозы (+46,6 %, р < 0,005). Учитывая, что глюкоза является единственным энергетическим субстратом для СХ, можно предполагать благоприятное значение данного явления для снижения реактивного воспаления в суставе у больных СД 2-го типа. С такой точкой зрения согласуются и более низкие показатели боли, и менее выраженная синовиальная экссудация и пролиферация. Однако значимо более выраженные дегенеративные изменения в виде истончения СХ и более грубого ОФ у больных СД 2-го типа требуют дальнейшего метаболического анализа. Вероятно, умеренная гипергликемия, закономерно повышая уровень глюкозы в СЖ и являясь энергетическим субстратом для хондроцитов, обеспечивает снижение патологической синовиальной экссудации до некоторого порогового уровня. Однако, как и в любой другой инсулинонезависимой ткани, резко выраженная декомпенсация СД (среднесуточная гликемия более 15 ммоль/л, НbА1с более 10 %) приводит к формированию феномена глюкозотоксичности. Логично предположить, что для соединительной ткани, так же как и для нервной, токсическое воздействие резко повышенной концентрации глюкозы выражается в угнетении репаративных процессов и превалировании катаболических изменений.
Влияние уровня компенсации углеводного обмена на проявления гонартроза у больных с сопутствующим СД 2-го типа
Анализ суставного синдрома у больных ОА с сопутствующим СД 2-го типа в зависимости от уровня контроля гликемии проведен в группах, сформированных по терцилям гликированного гемоглобина (НbА1с). Нижний терциль (НТНbА1с; n = 54) характеризовался уровнем НbА1с 6,59 ± 0,66 %, средний терциль (СТНbА1с; n = 54) — 8,27 ± 0,45 %, что на 25,5 % больше (0,0001) нижнего, а верхний терциль (ВТНbА1с; n = 54) — 10,66 ± 1,21 %, что на 61,8 % (0,0001) и 28,9 % (0,0001) больше нижнего и среднего терцилей соответственно. Подгруппы не различались по возрасту, ИМТ, КТБ, длительности суставного синдрома, долям разных рентгенологических стадий ОА, наличию узелковой формы полиостеоартроза. Отмечалось увеличение числа больных с наличием диабетической сенсомоторной периферической нейропатии на 11,1 % от НТНbА1с к СТНbА1с и на столько же от СТНbА1с к ВТНbА1с (c2 = 8,2; р = 0,016). Выраженность нарушений периферической чувствительности превалировала в ВТНbА1с на 47,8 % (p < 0,05) и 31,9 % (p < 0,05) относительно НТНbА1с и СТНbА1с.
Больные ОА + СД2 с компенсированным СД2 (нижний терциль) отличались большим на 17,4 % (< 0,05) Рейт_Б, на 16,7 % (< 0,05) Рейт_сКЖ и на 20,7 % (< 0,05) Рейт_ОА от больных с умеренной декомпенсацией СД 2-го типа (средний терциль). Пациенты с выраженной декомпенсацией СД 2-го типа (верхний терциль) характеризовались тенденцией к усилению боли и скованности, ухудшению функции и качества жизни, поэтому не имели различий с больными НТНbА1с, а отличались от СТНbА1с по Рейт_КЖ на 20,0 % (< 0,05) и по Рейт_ОА — на 7,5 % (< 0,05).
По большинству изучаемых параметров отмечалось нелинейное распределение значений в зависимости от уровня гликированного гемоглобина.
Итак, относительно более благоприятный артрологический профиль имел место у женщин подгруппы СТНbА1с по сравнению с НТНbА1с и ВТНbА1с. Вероятно, в большей степени на такой характер распределения признаков оказывала влияние диабетическая сенсомоторная нейропатия, частота и выраженность которой нарастали с увеличением степени декомпенсации СД 2-го типа.
Влияние диабетической нейропатии на проявления гонартроза у больных с сопутствующим СД 2-го типа
Проведен анализ проявлений суставного синдрома у больных ОА при сопутствующем СД 2-го типа в зависимости от наличия диабетической сенсомоторной периферической нейропатии (ДНП). Периферическая сенсомоторная дистальная симметричная нейропатия была выявлена у 129 (79,6 %) больных ОА с сопутствующим СД 2-го типа. При наличии ДНП имело место усиление периартрикулярной болезненности на 33 % (р = 0,039) и снижение работоспособности параартикулярных мышц колена на 34 % (р = 0,007).
Анализ использования различных методов консервативной терапии ОА в зависимости от наличия СД 2-го типа
Проведен анализ частоты систематического использования нестероидных противовоспалительных препаратов (НПВП), пероральных медленно действующих симптом-модифицирующих препаратов (хондроитин и/или глюкозамин), алфлутопа и внутрисуставного введения глюкокортикостероидов в группах ОА и ОА + СД2.
Систематически использовали НПВП 77,2 % больных ОА и 75,3 % больных ОА + СД2, но при этом женщины с изолированным гонартрозом в 1,9 раза чаще использовали селективные ингибиторы ЦОГ-2 (c2 = 9,6; р = 0,008).
Не использовали в лечении медленно действующие симптом-модифицирующие средства 65,6 % больных ОА и 83,3 % пациентов с ОА + СД2, соответственно, применение пероральных препаратов, содержащих хондроитин и/или глюкозамин, было в 1,7 раза, а внутримышечное введение алфлутопа — в 5,2 раза чаще в группе ОА (c2 = 17,6; р = 0,000). Внутрисуставное введение глюкокортикостероидов в 2,1 раза, а алфлутопа — в 2,9 раза чаще применялось у больных с изолированным гонартрозом (c2 = 18,0; р = 0,000).
Таким образом, уменьшение рейтингов боли, дисфункции, качества жизни, характерное для больных ОА с сопутствующим СД2, закономерно приводило к менее активному использованию как медленно действующих симптом-модифицирующих средств, так и внутрисуставных инъекций глюкокортикостероидов и алфлутопа.
Эффективность терапии НПВП у больных ОА с сопутствующим СД 2-го типа
Проведено открытое проспективное краткосрочное исследование эффективности фиксированной комбинации 50 мг диклофенака натрия с комплексом витаминов группы В у 30 больных ОА, у 14 из которых был сопутствующий СД 2-го типа. Критерии включения: достоверный диагноз гонартроза, жалобы на боль в коленных суставах ≥ 40 мм по ВАШ, подписанное информированное согласие на участие в исследовании. Критерии исключения: декомпенсация и острые осложнения сопутствующей патологии, непереносимость диклофенака и витаминов группы В в анамнезе. Все больные ОА отвечали критериям метаболического синдрома (IDF, 2005). Артериальное давление контролировалось и достигало целевых значений на фоне гипотензивной терапии. Пациентки с СД 2-го типа находились в стадии компенсации и субкомпенсации углеводного обмена (НbА1с до 7,5 %), получали сахароснижающую терапию препаратами сульфонилмочевины в виде монотерапии либо в комбинации с инсулином. Прием комплексного препарата назначался в режиме «по требованию». Больные вели дневники приема препарата, где ежедневно отмечали уровень боли по ВАШ, количество принятых капсул и нежелательные лекарственные реакции. Осмотр больных проводился в начале исследования, через 2 и 4 недели.
Завершили исследование 26 человек, четверо (13,3 %) выбыли (по 2 человека из группы ОА и ОА + СД2) в связи с развитием нежелательных явлений (диспепсия, гастралгия, головокружение).
Рейт_ОА снижался на 17,4–25,6 % (р = 0,00006) у пациенток ОА и на 16,7–25,4 % (р = 0,0012) — у женщин с сопутствующим СД 2-го типа через 2 и 4 недели приема препарата, т.е. принципиальных различий в динамике суставного синдрома между группами не выявлено.
Больные ОА по сравнению с больными ОА + СД2 принимали большее количество препарата: в первую неделю лечения — на 29,7 % (Z = 2,6; p = 0,009), во вторую — на 18,2 % (Z = 2,4; p = 0,018), в третью — на 28,3 % (Z = 2,0; p = 0,042), в четвертую — на 22 % (Z = 1,9; p = 0,049).
Влияние особенностей фактического питания на проявления ОА у больных с метаболическим синдромом
В изучаемой группе больных ОА присутствовало значительное количество (42 %) больных с сопутствующим СД 2-го типа, при котором соблюдение гипокалорийной диеты с ограничением животных жиров и моно- и дисахаридов является одним из важных лечебных мероприятий. Был проведен анализ особенностей питания в сопоставлении с клиническими и артросонографическими параметрами суставного синдрома. Оценка суточной калорийности рациона и его макронутриентного состава проводилась на основе «Таблиц химического состава и калорийности российских продуктов питания» (2008). Сравнение с рекомендуемыми диетическими параметрами проводилось на основе методических рекомендаций «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации» (2008).
У 117 женщин с ОА коленных суставов и метаболическим синдромом обнаружено превышение суточной калорийности рациона — 71 % участниц, преимущественно за счет содержания жира более 30 % от суточной калорийности. В соответствии с указанными методическими рекомендациями женщины были разделены на две возрастные категории (средний возраст (40–59 лет) и пожилые женщины старше 60 лет), для которых рекомендовались разные значения суточной калорийности пищевого рациона. Каждая возрастная категория подразделялась на группы эукалорийного и гиперкалорийного типа питания.
Установлено, что у женщин среднего возраста с гиперкалорийной диетой в отличие от их сверстниц эукалорийного типа питания были выше: на 31,1 % (0,008) — уровень боли по шкале WOMAC_боль, на 31,0 % (0,02) — Рейт_Б, на 56,0 % (0,003) — ограничения функциональной активности по индексу FAS_ноги, на 26,4 % (0,009) — Рейт_ДФ, на 24,2 % (0,025) — суммарный индекс WOMAC.
Параметры суставного синдрома больных ОА с МС средней возрастной категории и гиперкалорийного типа питания не отличались от показателей старшей возрастной группы независимо от калорийности питания последних. Различий в отношении суставного синдрома между женщинами пожилого возраста с эукалорийным и гиперкалорийным рационом не выявлено.
Избыток жира в пищевых рационах изученной выборки больных ОА прямо коррелировал с интенсивностью боли по ВАШ при дневных нагрузках (0,23; p < 0,05), по шкале WOMAC_боль (0,29; p < 0,05), с Рейт_Б (0,22; p < 0,05), с нарушением функции коленных суставов по шкале WOMAC_активность (0,29; p < 0,05), с суммарным индексом WOMAC (0,30; p < 0,05). При избыточном потреблении жира ультразвуковое исследование коленных суставов выявило усиление пролиферации синовиальной оболочки независимо от возраста больных, а у женщин старше 60 лет — дополнительное отрицательное влияние на высоту суставного хряща в латеральном отделе тибиофеморального сочленения.
Эффективность немедикаментозной коррекции избыточной массы тела и ожирения у больных гонартрозом
Проведена оценка эффективности улучшения параметров суставного синдрома при выполнении немедикаментозных мероприятий, направленных на снижение массы тела у больных ОА с ИМТ от 25 кг/м2 и выше.
Программа комплексной реабилитации применена у 100 женщин с ОА коленных суставов и ожирением (78) либо избыточной массой тела (22). Наблюдение за больными осуществлялось в течение 3 месяцев, на протяжении которых женщины постепенно уменьшали суточную калорийность рационов с особым акцентом на сокращение количества животного жира, вели пищевые дневники (описание 1–2 стандартных дней в неделю). Рекомендовалось увеличение двигательной активности (пешеходные прогулки, занятия лечебной гимнастикой и т.п.). Допускался прием НПВП по потребности.
Снижение массы тела достигнуто у 45 (57,7 %) больных ожирением и у 7 (31,8 %) пациенток с избыточной массой тела. Редукция массы тела за три месяца на 3,6 % у больных ОА в процессе комплексной немедикаментозной реабилитации достигалась при уменьшении суточной калорийности рациона на 26,1 % на фоне активизации физической активности, при этом в пищевых рационах доля жира сокращалась на 8,5 %, а доля общих углеводов увеличивалась на 15,3 %.
Исходно параметры суставного синдрома не различались между группами. Через 3 месяца в группе снизивших массу тела (МТ(–)) достигнуто уменьшение интенсивности боли по ВАШ в дневное время на 24,4 % (p < 0,05), по шкале WOMAC_боль — на 26,4 % (p < 0,05). В группе больных, сохранивших стабильную массу или даже несущественно прибавивших ее (МТ(+)), динамика данных параметров имела лишь тенденцию к снижению, не достигающую уровня статистической значимости.
Комплексная оценка взаимосвязи системных метаболических и локальных остеоартритических признаков
Параметры, имеющие максимальные факторные нагрузки в составе ведущего фактора «боль и дисфункция», использованы для комплексной оценки взаимосвязи локальных остеоартритических и системных метаболических факторов. Проведен однофакторный дисперсионный анализ распределения параметров ВАШ_Д и суммарный индекс WOMAC в группах больных ОА и ОА + СД2 в зависимости от градации ИМТ, степени гипертонической болезни (ГБ), возраста, рентгенологической стадии, степени коморбидности.
У больных ОА + СД2 дисперсия боли по ВАШ в дневное время имела уровень статистической значимости лишь в зависимости от степени ГБ, рентгенологической стадии и индекса коморбидности, а суммарный индекс WOMAC статистически значимо распределялся в зависимости от градации ИМТ, степени ГБ и рентгенологической стадии.
Таким образом, на усиление боли и ухудшение функции у больных ОА без сопутствующего СД 2-го типа влияли: увеличение градации ИМТ, степень артериальной гипертензии, рентгенологическая стадия, возраст старше 70 лет. При наличии ассоциированного с остеоартрозом СД 2-го типа уменьшалась степень влияния избыточной массы тела, рентгенологической стадии, устранялась связь с пожилым возрастом, но усугублялось влияние степени артериальной гипертензии и появлялась зависимость от степени коморбидности.
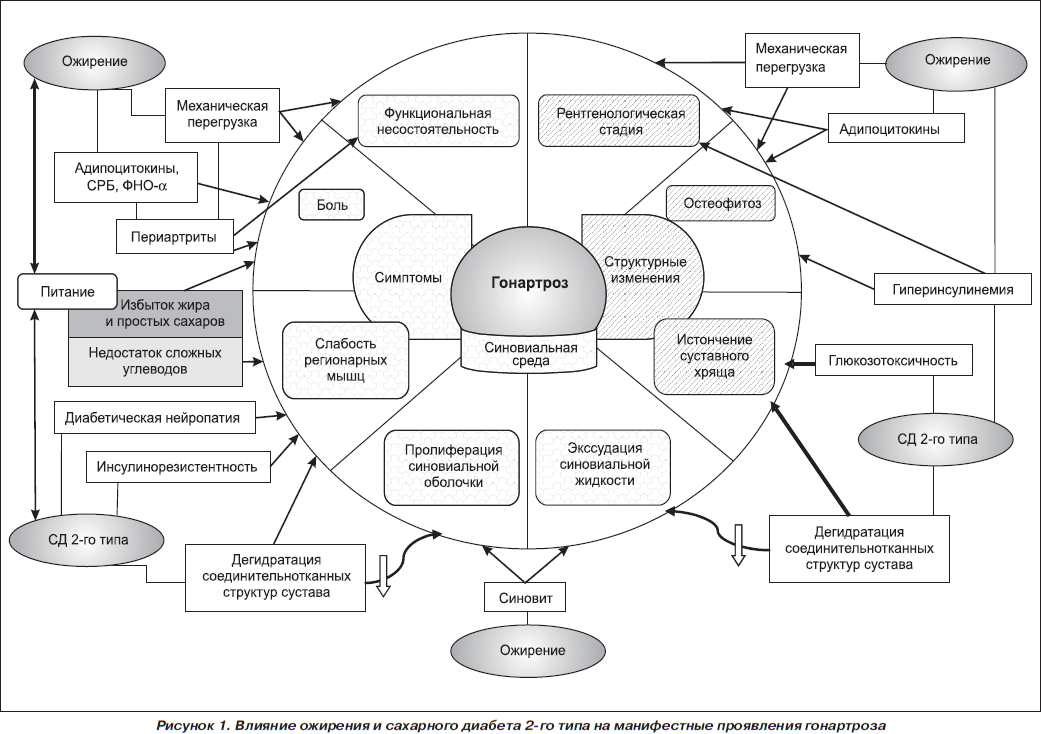
Полученные в настоящей работе данные о вкладе нарушений липидного (ожирение) и углеводного (СД 2-го типа) обмена в манифестацию болезни у пациентов с гонартрозом схематично отображены на рис. 1. Усиление боли как ведущего остеоартритического симптома отмечается у больных ожирением вследствие механической перегрузки сустава и периартикулярных структур, повышения активности воспалительных явлений. Избыточное потребление жиров, выявленное при анализе фактического питания больных гонартрозом и метаболическим синдромом, усиливает выраженность боли, а недостаток сложных углеводов усугубляет слабость регионарных мышц колена. Количественное определение мышечной слабости коленных суставов обнаружило значимое снижение работоспособности параартикулярных мышц колена при диабетической нейропатии, выраженном ожирении. У больных гонартрозом с сопутствующим СД 2-го типа уменьшены количество синовиальной жидкости, толщина синовиальной оболочки и высота суставного хряща, что в совокупности с увеличением амплитуды подвижности коленных суставов и концентрации глюкозы в синовиальной жидкости свидетельствует в пользу дегидратации соединительнотканных структур сустава. Выраженность дегенеративных изменений структур коленного сустава усугубляется и при ожирении, и при СД 2-го типа.
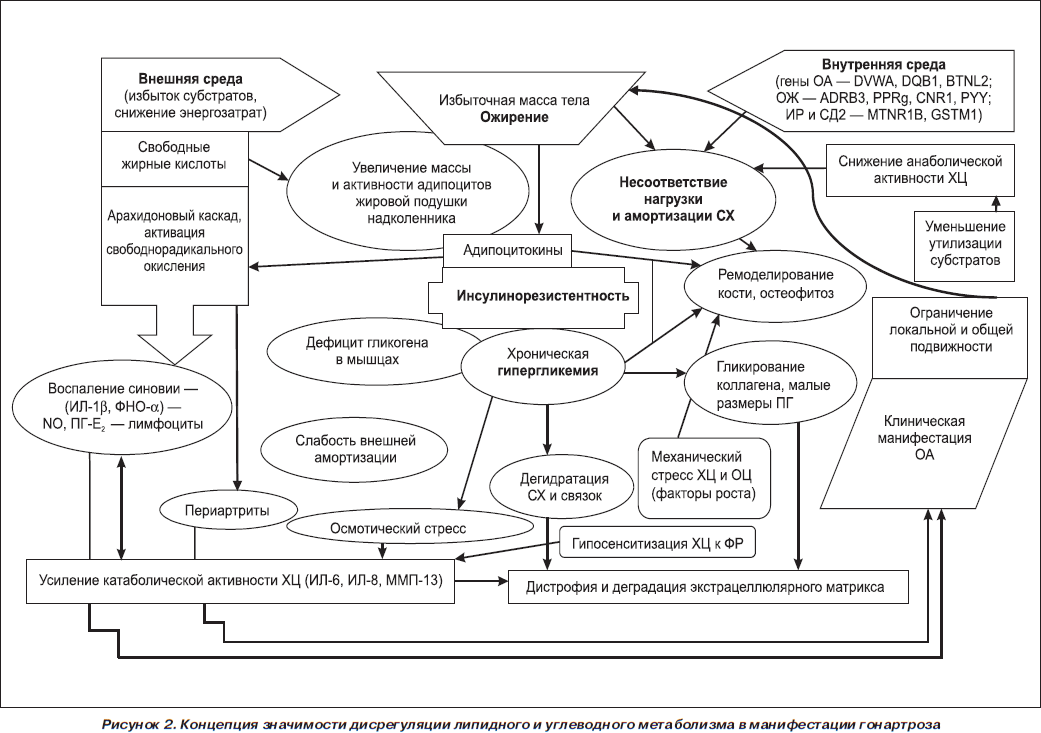
Обобщающая концепция значимости дисрегуляции липидного и углеводного метаболизма в манифестации гонартроза представлена на рис. 2. Каждое из обсуждаемых заболеваний характеризуется генетической предрасположенностью, реализующейся при определенных внешнесредовых воздействиях, длительным латентным периодом. Ожирение как естественная модель нарушений липидного метаболизма демонстрирует усиление его провоспалительной и дегенеративной роли в отношении гонартроза. СД 2-го типа как модель очевидных нарушений обмена углеводов обладает артрозогенным потенциалом, что обусловлено дегидратацией суставов и гликированием соединительнотканных белков.
Выводы
1. Боль и дисфункция коленных суставов при гонартрозе линейно нарастают при увеличении индекса массы тела (р = 0,01). Низкое качество жизни также значимо ассоциируется с высоким индексом массы тела (р = 0,0001). Наиболее благоприятная клиническая картина заболевания отмечается у лиц с ИМТ < 25 кг/м2.
2. Методом логистического регрессионного анализа установлено, что у женщин с гонартрозом с окружностью талии более 80 см увеличение ее на каждый 1 см повышает вероятность тяжелого суставного синдрома на 4 %, что подчеркивает значение ожирения абдоминального типа как существенного фактора риска неблагоприятного течения заболевания.
3. Сопутствующий СД 2-го типа у больных гонартрозом приводит к меньшей интенсивности хронической боли (–22 %; p < 0,001) и выраженности функциональных нарушений (–23 %; p < 0,001). Пероральный прием НПВП (в четырехнедельном исследовании суточной потребности диклофенака) также снижен (–23 %; р = 0,018) по сравнению с пациентами с изолированным гонартрозом.
4. Гонартроз при коморбидном СД 2-го типа характеризуется в 2 раза большей (р = 0,001) частотой третьей рентгенологической стадии по Kellgren — Lawrence, более выраженным остеофитозом при ультразвуковом исследовании (в 1,4 раза в латеральном (p < 0,001) и в 1,2 раза (p = 0,003) в медиальном отделе тибиофеморального сочленения), меньшей высотой суставного хряща (–30,9 % над латеральным (p < 0,001) и –10,9 % (p = 0,023) над медиальным мыщелком большеберцовой кости).
5. При ассоциированном СД 2-го типа у больных гонартрозом наблюдаются уменьшение толщины синовиальной оболочки (–39,1 %; p < 0,001) и менее выраженная экссудация в полости коленных суставов (в 1,6 раза; p < 0,001). Соответственно, больные ОА с ассоциированным СД 2-го типа реже получают локальную терапию внутрисуставным введением глюкокортикостероидов — в 2,1 раза и алфлутопа — в 2,9 раза (c2 = 18,0; р < 0,0001). Наличие диабетической сенсомоторной периферической нейропатии усиливает периартикулярную болезненность на 33 % (р = 0,039) и уменьшает работоспособность параартикулярных мышц колена на 34 % (р = 0,007).
6. Избыток жира в пищевых рационах больных гонартрозом, протекающим в условиях метаболического синдрома, ассоциируется с усилением боли (r = 0,29; p < 0,05), ухудшением функциональности (r = 0,28; p < 0,05) и качества жизни (r = –0,26; p < 0,05), усилением экссудативных (r = 0,25; p < 0,05) проявлений. Соответствующее нормальному потребление общих углеводов определяет большую работоспособность мышц колена (r = 0,24; p < 0,05) и меньшую степень дегенерации суставного хряща (r = 0,31; p < 0,05).
1. Влияние локальной терапии на показатели физической активности у больных с хроническими гонартритами / А.С. Носкова, Л.Н. Долгова, И.Г. Красивина, М.Е. Канавина // Научно-практическая ревматология. — 2004. — № 2 — С. 76
2. Алфлутоп в локальной терапии периартритов плеча / С.М. Носков, О.И. Фетелего, И.Г. Красивина, Л.Н. Долгова // Терапевтический архив. — 2005. — № 8. — С. 57-60.
3. Оценка функциональной недостаточности суставов в реабилитации / А.С. Носкова, И.Г. Красивина, И.С. Могутова, Н.А. Горбакова // Физиотерапия, бальнеология и реабилитация. — 2005. — № 6. — С. 32-35.
4. Сравнительный анализ объективных методов оценки нарушения функции коленных суставов / И.Г. Красивина, А.С. Носкова, Л.Н. Долгова, И.С. Могутова // Физиотерапия, бальнеология и реабилитация. — 2006. — № 1. — С. 38-40.
5. Долгова Л.Н., Красивина И.Г., Носкова А.С. Роль ультразвукового исследования коленных суставов в оценке локальной терапии у больных остеоартрозом // Ультра-звуковая и функциональная диагностика. — 2006. — № 6. С. 113.