Журнал «Травма» Том 10, №4, 2009
Вернуться к номеру
Оценка адекватности анестезии у пациентов, оперированных по поводу субтенториальных новообразований головного мозга
Авторы: В.И. Черний, А.Н. Колесников, Себаи Слим, Т.А. Мустафин, Г.И. Лебедева,
К.А. Кардаш, А.Г. Колесникова - Донецкий национальный медицинский университет им. М. Горького, Донецк, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
В статье рассмотрена оценка адекватности анестезии у пациентов, оперированных по поводу субтенториальных новообразований головного мозга.
У статті розглянута оцінка адекватності анестезії в пацієнтів, оперованих із приводу субтенторіальних новотворів головного мозку.
This article has described estimation of efficiency of anaestesia for surgery of subtentorium tumors of the brain.
анестезия, новобразования, головной мозг
анестезія, новотвори, головний мозок
anaestesia, tumor, brain
Вмешательства на задней черепной ямке характеризуются высоким уровнем стрессогенности, так как осуществляются в рефлексогенных зонах (черепно-мозговые нервы, дыхательный центр, сердечно-сосудистый центр и т.д.). Новообразования задней черепной ямки в 73% случаев сопровождаются окклюзионной гидроцефалией, что приводит к быстрому росту внутричерепного давления и нарушению церебрального перфузионного давления. Наряду с этими влияниями большое значение имеют сопутствующие операции факторы: сидящее положение пациентов на операционном столе, отрицательное воздействие общих анестетиков, кровопотеря и гиповолемия, нарушения центрального и периферического кровообращения, гипоксемия и тканевая гипоксия и механическое повреждение мозга [1].
Цель работы - изучение адекватности анестезии у пациентов с субтенториальной локализацией новообразований в условиях тотальной внутривенной анестезии и в условиях многокомпонентной комбинированной общей анестезии на основе севофлурана.
Материал и методы
Исследования проводились на базе II нейрохирургического отделения и отделения нейрореанимации Донецкого областного клинического территориального медицинского объединения (ДОКТМО). У всех больных отсутствовали сопутствующие заболевания в стадии декомпенсации (хроническая сердечная недостаточность, бронхиальная астма, сахарный диабет и т.д.).
Пациенты были разделены на две группы в зависимости от применяемого основного анестетика. Группы практически не отличались по полу, возрасту, физическому статусу по классификации ASA, характеру и объёму оперативного вмешательства.
І группу – основную – составили 20 пациентов, у которых применяли многокомпонентную комбинированную общую анестезию на основе севофлурана (севорана) с использованием внутривенного введения фентанила в качестве анальгетика.
ІІ группу – контрольную – составили 18 пациентов, для которых была выбрана тотальная внутривенная анестезия с использованием внутривенного введения фентанила в качестве анальгетика.
Схемы проведения анестезии.
Премедикация в исследуемых группах не отличалась и осуществлялась введением в/в 0,1% атропина (0,01мг/кг), 1% димедрола (1-2 мл), 0,5% сибазона (0,015 мг/кг), 0,005% фентанила (1-1,5 мкг/кг).
У пациентов первой группы индукция в анестезию осуществлялась внутривенным введением 10 % раствора пропофола (2-2,5 мг/кг), поддержание анестезии осуществлялось путем ингаляции севофлурана («Севоран») в режиме minimum flow anesthesia, анальгетический компонент создавался путем болюсного введения 0,005% фентанила (2-3 мкг/кг) после нагрузочной дозы 5 мкг/кг. У пациентов второй группы индукция в анестезию осуществлялась внутривенным введением 20% раствора оксибутирата натрия (80–100 мг/кг) в сочетании с 1% раствором тиопентала натрия (5-7 мг/кг), поддержание анестезии осуществлялось путем фракционного введения оксибутирата натрия (40-50 мг/кг/час), анальгетический компонент создавался путем болюсного введения 0,005% фентанила (2-5 мкг/кг) после нагрузочной дозы 5 мкг/кг.
Всем пациентам проводилась преоксигенация в течение 5-7 минут при FiO2 100%, интубация трахеи обеспечивалась применением ардуана (0,07-0,08 мг/кг), проводили искусственную вентиляцию легких (ИВЛ) в режиме умеренной гипервентиляции (8-10 мл/кг).
Интраоперационный мониторинг включал в себя неинвазивное измерение АД, определение ЧСС и SpO2, а также запись ЭКГ во втором отведении с анализом вариабельности сердечного ритма осуществлялись при помощи реанимационно-хирургического монитора UTAS, имеющего встроенную программу математической обработки кардиоинтервалограммы.
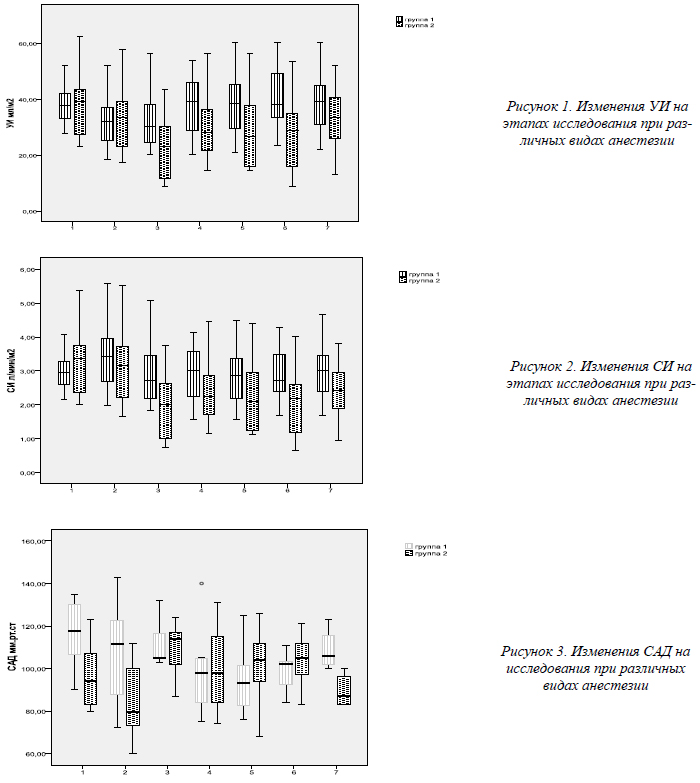
Рассчитывался ударный индекс (УИ), сердечный индекс (СИ), общее периферическое сопротивление (ОПСС) на всех этапах наблюдения по общим принятым формулам.
Рассчитывали ЦПД по формуле: ЦПД = САД – ВЧД [2,3], где САД – среднее артериальное давление, ВЧД – внутричерепное давление.
Измерение ВЧД производилось путем вентрикулярной пункции. Для измерения ВЧД применялась стеклянная градуированная трубка диаметром 2 мм и длиной 50-60 см.
Анализ ВСР проводился путем обработки R-R интервалов, записанных на следующих этапах: 1) за сутки до операции (исходный уровень); 2) после интубации трахеи; 3) после разреза кожи; 4) после вскрытия ТМО; 5) на основном этапе операции (удаление опухоли); 6) после завершения операции; 7) после перевода больного в отделение нейрореанимации, больные находились на ИВЛ аппаратом через интубационную трубку. На всех этапах измерения проводились в течение стандартного промежутка времени - 5 минут. Анализировались следующие показатели ВСР [4]: частотные.
В процентах к тотальной мощности спектра определяли:
- VLF (мс2) - very low frequency – очень низкие частоты (ОНЧ);
- LF (мс2) - low frequency – низкие частоты (НЧ);
- HF (мс2) - high frequency – высокие частоты (ВЧ);
- LF/HF (НЧ/ВЧ) - симпато-вагусный баланс.
С целью объективной оценки адекватности анестезии определяли:
- уровень стресс-гормонов в крови (кортизол) иммуноферментным методом (набор реактивов фирмы «Алкор Био» (Россия, Санкт-Петербург));
- уровень серотонина и гистамина (прибор для определения – Spectrofluooroometer, JASCO, FP-770 (Япония));
- концентрацию глюкозы в крови (прибором ONE TOUCH).
Забор крови для определения уровня кортизола, гистамина, серотонина осуществлялся в 3 этапа: 1-й - до операции на операционном столе, 2-й - после вскрытия твердой мозговой оболочки (ТМО), 3-й - сразу после окончания операции. Уровень глюкозы крови определяли в 4 этапа: 1-й - до операции на операционном столе, 2-й - после интубации, 3-й - после вскрытия твердой мозговой оболочки (ТМО), 4-й - сразу после окончания операции.
Результаты и обсуждение
При анализе результатов исследований параметров центральной гемодинамики было выявлено, что показатели первой группы не претерпевали статистически достоверных изменений на различных этапах исследованиях. У пациентов второй группы было выявлено, что УИ снижался на этапе разреза кожи по сравнению с исходным уровнем (М±m: 20±7, vs 39±11(р=0,01)) (рис. 1), СИ снижался на этапе разреза кожи по сравнению с исходным уровнем (М±m: 1,9±0,7 vs 3,3±0,9 (р=0,04)) (рис. 2), ОПСС повышалось на этапе разреза кожи по сравнению с этапом интубации трахеи (М±m: 4422±1339, vs 2190±335 (р<0,05)) и САД повышалось на этапе разреза кожи по сравнению с этапом интубации трахеи (М±m: 114±5 vs 80±7 (р<0,05)) (рис. 3), в связи с пониженной производительностью сердца САД поддерживалось за счет высокого сосудистого сопротивления. Повышение ОПСС являлось причиной снижения УИ и СИ. Данные параметров центральной гемодинамики подтверждались данными показателей вариабельности сердечного ритма у пациентов второй группы, которые указывали на преобладание на самом травматичном этапе в спектры мощности параметров, отражающих активность симпатической нервной системы (ОНЧ 44±9 и НЧ 25±8). Параметры вариабельности сердечного ритма у пациентов первой группы оставались стабильными на всех этапах исследований.
При анализе изменений уровня глюкозы крови было выявлено, что исходный уровень у пациентов обеих групп находился в пределах физиологической нормы. У пациентов второй группы уровень глюкозы в крови в конце операции достоверно повышался по сравнению с исходным уровнем, при этом он не превышал норму (М±m: 6,1±1,3 vs 4,53±0,8 (р=0,02)) (табл.1).
Анализ стрессового гормона (кортизола) показал, что его среднее содержание в предоперационном периоде у пациентов обеих групп находилось в пределах нормы и достоверно не отличалось (табл. 2). На этапе вскрытия ТМО и в конце операции уровень кортизола не претерпевал в обеих группах статистически значимых изменений. Уровень серотонина и гистамина имели тенденцию к повышению на этапе вскрытия ТМО и в конце операции в обеих группах.
При изучении внутричерепного давления на этапе вскрытия твердой мозговой оболочки не было выявлено отличий между тотальной внутривенной анестезией и многокомпонентной комбинированной анестезией на основе севофлурана (М±m: 12±2 vs 14±2). Церебральное перфузионное давление на этапе вскрытия ТМО составило у пациентов первой группы (72±10 мм рт.ст.), у пациентов второй группы составило (85±9 мм рт.ст.).
Расход фентанила у пациентов первой группы (2,5±0,3 мкг/кг/ч) статистически достоверно был ниже, чем у пациентов второй группы (5±0,5 мкг/кг/ч).
Выводы
Таким образом, для пациентов с субтенториальной локализацией новообразования очень важно, в связи с сидячим положением на операционном столе, сохранить адекватное САД и ОПСС для обеспечения нормального уровня церебрального перфузионного давления.
При анализе параметров церебральной гемодинамики было выявлено, что при комбинированной ингаляционной анестезии на основе севофлурана церебральное перфузионное давление пострадало и находилось на нижней границе нормы, что является опасным для больных с субтенториальной локализацией новообразований.
При многокомпонентной тотальной внутривенной анестезии САД и ОПСС находились на адекватном уровне для обеспечения адекватного церебрального перфузионного давления. Несмотря на более адекватный уровень защиты пациентов от операционной травмы при комбинированной ингаляционной анестезии, по данным изменений параметров вариабельности сердечного ритма и глюкозы крови мы делали вывод, что интракраниальный гомеостаз для данных больных имеет более важное значение, поэтому для данной категории больных мы рекомендуем многокомпонентную общую анестезию.
1. Чепкий Л.П. Современный подход к анестезиологическому обеспечению нейрохирургических операций // Журнал пракичного лікаря.- 2004.- № 3.- С 22-25.
2. Антонов А.А. Гемодинамика для клинициста. – www.symona.ru, 2004. – 99с.
3. Зильбер А. П. Клиническая физиология в анестезиологии и реаниматологии / А. П. Зильбер. – М.: Медицина, 1984. – 437с.
4. Кирячков Ю.А., Салтанов И.А., Хмелевский Я.М. Компьютерный анализ вариабельности сердечного ритма. Новые возможности для анестезиолога и врачей других специальностей // Вестник интенсивной терапии. – 2002. - №1.- С.3-8.