Журнал «Травма» Том 9, №3, 2008
Вернуться к номеру
Функционально-фенотипическая характеристика культивированных некоммитированных и коммитированных по остеогенному пути мезенхимальных стволовых клеток
Авторы: Д.А. Зубов - Институт неотложной и восстановительной хирургии им. В.К. Гусака АМН Украины,
Донецк, Украина
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
В статье обсуждаются результаты по изучению функционально-фенотипических характеристик некоммитирванных и остеоиндуцированных мезенхимальных стволовых клеток костного мозга человека in vitro. Обговаривается роль этих клеток в иммунорегуляторных процессах, протекающих при посттравматическом заживлении костных дефектов.
У статті обговорюються результати вивчення функціонально-фенотипічних характеристик некомітованих та остеоіндукованих мезенхімальних стовбурових клітин кісткового мозку людини in vitro. Обговорюється роль цих клітин в імунорегуляторних процесах, що мають місце при посттравматичному загоєнні кісткових дефектів.
In the article the results of human bone marrow uncommitted and osteogenic inducted mesenchymal stem cell phenotype characteristics in vitro are discussed. The role of these cells in immunoregulatory processes during post-traumatic bone defect healing is highlighting.
мезенхимальные стволовые клетки, поверхностные антигены клетки, остеогенная индукция, щелочная фосфатаза, костная резорбция, остеорепарация
мезенхімальні стовбурові клітини, поверхневі антигени клітини, остеогенна індукція, лужна фосфатаза, кісткова резорбція, остеорепарація
mesenchymal stem cells, cell surface antigens, osteogenic induction, bone alkaline phosphatase, bone resorption, bone reparation
Остеопрогениторные популяции мезенхимальных стволовых клеток (МСК), обладают характерным антигенным профайлом, и, в общем, разделяют антигены с остальными костномозговыми клеточными популяциями. Некоторые из детектируемых поверхностных маркеров конститутивно экспрессируются клетками кости. Другие эпигенетически регулируются различными факторами или цитокинами, выделяемыми в экстрацеллюлярный матрикс (ЭЦМ) теми или иными клеточными популяциями, которые слаженно и в тесной кооперации друг с другом участвуют в процессах физиологической и репаративной регенерации кости. Это клетки лимфо-миелоидного и моноцитарно-макрофагального ряда, зрелые остеокласты и незрелые клетки предшественники остеобластов [15].
Под МСК в данной статье понимаются культивированные клеточные мезенхимальные линии, полученные как из стромы костного мозга, так и из других тканей, и соответствующие трем минимальным идентификационным критериям, предложенным в 2006 г. Комитетом по мезенхимальным и тканевым стволовым клеткам при Международном обществе по клеточной терапии (International Society for Cellular Therapy - ISCT) [6]: 1) адгезия к пластику при стандартных условиях культивирования; 2) специфическая экспрессия поверхностных клеточных антигенов (позитивная экспрессия CD105, CD73, CD90 и негативная CD45, CD34, CD14 или CD11b, CD79α или CD19, HLA-DR); 3) мультилинеарный потенциал к in vitro дифференцировке в остеобласты, адипоциты и хондробласты.
Целью настоящих исследований является определение функционально-фенотипических характеристик некоммитированных и коммитированных по остеогенному типу МСК костного мозга человека в условиях клеточной культуры. В фенотипическом плане изучается и сравнивается набор поверхностных антигенов межклеточной и клеточно-матриксной адгезии, активации и костимуляции иммунного ответа, МНС I и II классов, а также маркеров гемопоэтических стволовых клеток в обеих линиях МСК.
Материал и методы
МСК изолировали по общепринятой методике [11] из аспирата костного мозга, забранного на гепарине, при пунктировании грудины или гребня подвздошной кости у пациентов травматологического профиля. Среднее количество аспирата составляло 20 мл от одного больного. Мононуклеарную фракцию аспирата высевали на проколлагененные пластиковые флаконы площадью 75 см2 (Corning, США) и культивировали в ростовой среде DMEM/F12 (Sigma, США) с добавлением 10% эмбриональной телячьей сыворотки (Биолот, Россия) и 1 нг/мл основного фактора роста фибробластов (Sigma, США) в СО2-инкубаторе (Jouan, Франция) при 37°С и 5% атмосфере СО2. Пассирование культур производили 0,25% раствором трипсина и ЭДТА (Биолот, Россия) в соотношении 1:5. Остеоиндукцию линий МСК производили путем внесения в выше указанную ростовую среду остеогенной добавки: 0,1 μМ дексаметазона, 10 мМ β-глицерофосфата и 50 мкг/мл аскорбиновой кислоты (Sigma, США). Окраску культур на щелочную фосфатазу (ЩФ) проводили иммуноцитохимическим методом с применением субстрата BCIP/NBT Liquid Substrate System (Sigma, США) согласно инструкции. Иммуномаркирование клеточных культур МСК 1-4 пассажей производили с помощью моноклональных антител, МКА, (BD Biosciences, США) модифицированным методом прямой и непрямой флуоресцентной окраски для флуоресцентной микроскопии, защищенным патентом Украины [1]. Визуализацию и фотодокументирование культур осуществляли посредством инвертированного микроскопа Leica DMIL, рабочей станции по обработке изображений Leica QWin500 Standart и видеокамеры Sanyo TK-C1380, а также системы для флуоресцентной микроскопии и обработки изображения Leica DMLS - DC-IM-50 (Германия).
Полученные данные были выражены как среднее значение со стандартной ошибкой среднего и подвергнуты статистическому анализу.
Результаты и обсуждение
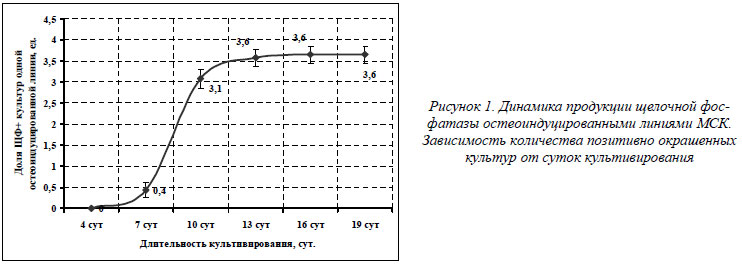
Продукция щелочной фосфатазы остеоиндуцированными линиями МСК
ЩФ является эктозимом, заякоренным в клеточной мембране. Ее функция состоит в гидролизе органических фосфорных соединений, например моноэфиров фосфорных кислот (β-глицерофосфат), в неорганический фосфат-ион, который в свою очередь вносит основной вклад в процесс минерализации матрикса кости [4, 9, 17]. В случае остеогенеза речь идет о костном изоферменте ЩФ – остазе. При обработке конфлуентных культур глюкокортикоидом дексаметазоном МСК начинают секрецию ЩФ. Как видно из графика, представленного на рисунке 1, синтез остазы начинается примерно с седьмых суток остеогенной индукции. Резкий скачок в активной секреции ЩФ происходит с седьмых по десятые сутки индукции. Так, для средне статистической остеогенной линии (n=14), состоящей из 4-х культур, на 10 сутки реакция на ЩФ становилась позитивной в 3,1 культур из 4-х, а начиная с 13 суток остеоиндукции и по 19 сутки активность ЩФ оставалась на стабильно высоком уровне в 3,6 культур.
В процессе индукции МСК претерпевают определенные морфологические изменения. Так, на 7 сутки индукции, в культуре наблюдаются веретеновидные фибробластоидные мало дифференцированные клетки с включением единичных более крупных, распластанных и продуцирующих ЩФ клеток (рис. 2а). Но уже с 13 суток ЩФ активно вырабатывается практически всеми клетками индуцированных культур (рис. 2.б-г), и отчетливо прослеживаются изменения в морфологии клеток и структуре монослоя. С увеличением сроков индукции монослойные некоммитированные культуры со специфическим взаимно параллельным расположением веретеновидных клеток (рис. 2а), постепенно образовывали стратифицированные плотные полусферические скопления и активно секретировали ЩФ (рис. 2.г). Происходящая в процессе индукции перестройка пространственной архитектоники монослоя МСК, напоминает по своей природе формирование остеогенных островков, характерных для процесса прямого остеогенеза. При этом, в ходе почти трехнедельной индукции, ЩФ-позитивные МСК приобретали распластанный вид и округло-многоугольную форму с выраженными выростами цитоплазмы (рис. 2.в).
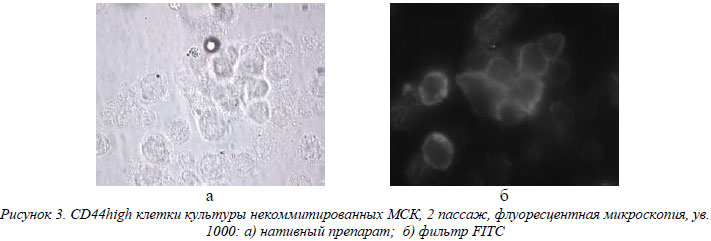
Фенотипическая характеристика культивированных некоммитрованных и коммитированных МСК. В таблице представлены данные по фенотипированию некомитированных и комитированных по остеогенному пути линий МСК. При изучении и сравнении антигенов клеточной поверхности использовалась бальная система и статистический непараметрический Н-критерий Краскелла-Уоллиса. Так, 1 бал соответствовал единичным позитивным клеткам в поле зрения; 2 бала – количество позитивных клеток составляло до 25%; 3 бала – до 50%; 4 бала – до 75% и 5 балов – до 100%. Для удобства сравнения маркеров, антигены были разбиты на некие общие группы, представленные в таблице. Прежде всего, необходимо отметить отсутствие экспрессии поверхностных гемопоэтических маркеров (CD34, CD45, CD14, CD19) в обеих группах МСК. Это говорит об однородности культивированных популяций МСК и отсутствии в них ранних предшественников гемопоэтических стволовых клеток (ГСК). Полученные результаты целиком согласуются с предложенными Комитетом по мезенхимальным и тканевым стволовым клеткам минимальными критериями идентификации МСК [6]. Относительно экспрессии молекул I и II классов главного комплекса гистосовместимости человека, HLA A, B, C и HLA-DR соответственно, то, как видно из таблицы, достоверную детекцию HLA-DR выявили в группе коммитированных МСК 4 пассажа, но уровень этой экспрессии был весьма слабым. То есть, приведенные результаты свидетельствуют о низкой вероятности трансплантационных реакций, направленных против биотехнологически размноженных МСК человека в обеих группах. При изучении антигенного профиля в группе маркеров межклеточной адгезии и интегриновых цепей – маркеров клеточно-матриксной адгезии, было отмечено, что уровень экспрессии этих молекул обеими группами МСК в процессе культивирования оставался на стабильном среднем и высоком уровне. На клетках некоммитированой и остеоиндуцированной группы МСК определялись рецепторы (CD29, CD49b и CD49c) к молекулам костного матрикса – ламинину, коллагену, фибронектину (α2β1, α3β1) и гиалуроновой кислоте (CD44) (рис. 3).
CD105 экспрессировался в одинаковой степени как на некоммитированных, так и на коммитированных МСК. Данный антиген играет ключевую роль в процессах ангиогенеза и гемопоэза. Он широко экспрессируется на поверхности эндотелиоцитов и является частью рецепторного комплекса TGFβ и участвует в связывании TGFβ1, TGFβ3, BMP-2 и BMP-7. Иными словами, CD105 может косвенно участвовать в депонировании костных матриксных белков при реорганизации костного регенерата [5]. Прослеживается и его регуляторная роль в процессах клеточной миграции МСК в ране [5].
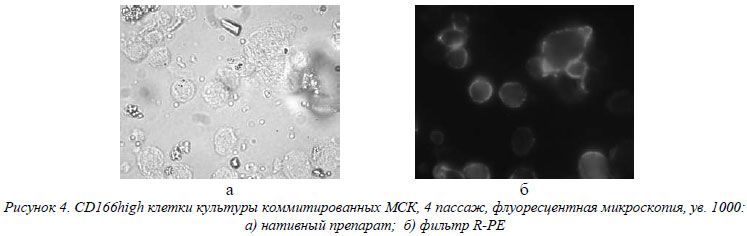
МСК активно экспрессируют молекулы активации и костимуляции иммунного ответа, которые относятся, по большому счету, к группе антигенов межклеточного взаимодействия. Наблюдался средний уровень экспрессии обеими группами CD58 – основного антигена функциональной активности лимфоцитов, участвующего и в воспалительном процессе, и высокий уровень экспрессии CD166, ответственного за активацию лимфоцитов по гомо- или гетерофильному механизму (рис. 4).
CD73 является маркером созревания лимфоцитов и участвует в таких иммунологических феноменах, как активация, пролиферация и адгезия лимфоцитов к эндотелию, и, по последним данным, опосредует связывание лимфоцитов с культивированными эндотелиоцитами, а также является вспомогательной активационной молекулой Т-лимфоцитов [2, 3]. Таким образом, роль линий МСК, посредством экспрессии CD73, также может потенциально сводиться к активации Т-клеточного звена иммунного ответа в костной ране.
Поскольку лигандом CD90 является пан-лейкоцитарный антиген CD45, то можно выдвинуть предположение о потенциальной роли Thy-1, а в целом и самих линий МСК, в процессах иммунной регуляции воспалительной фазы репаративной регенерации костной ткани.
Кроме того, CD105, CD90 и CD73 были взяты и в качестве позитивного критерия идентификации культивированных линий МСК человека [6]. Как видно из таблицы, уровень их экспрессии не самый высокий, но стабильный, независимо от длительности культивирования или остеогенной индукции МСК линий.
В 2000 году группа авторов из Великобритании под руководством R. Grimer [7] предложила молекулу CD56 (NCAM - neural cell adhesіon molecule), антиген натуральных киллеров, рассматривать в качестве нового остеобластного маркера. В их иммуногистохимических исследованиях этот антиген активно экспрессировался остеобластами, клетками периоста и МСК в зонах активного формирования кости in vivo, а также неопластическими остеобластами. При этом NCAM-молекула не экспрессировалась остеоцитами. Как видно из таблицы, уровень экспрессии CD56 некоммитированными клетками был выше среднего, а остеоиндуцированные клетки достоверно выявили отсутствие экспрессии данного маркера.
CD54 способен активировать Т- и В-лимфоциты, моноциты и эндотелиальные клетки [8]. Его экспрессия находится на стабильном среднем уровне в обеих группах МСК. Видимо, данный антиген свидетельствует о вовлечении МСК в процессы васкуляризации и привлечения предшественников остеокластов в область резорбции и заживления костной ткани, а также выполнения определенных иммунорегуляторных функций.
CD62L действует как хоуминговый рецептор для лейкоцитов при проникновении последних во вторичные лимфоидные ткани посредством облегчения адгезии лимфоцитов к адрессинам, экспрессируемым на активированном эндотелии высоких венул [13]. Его экспрессия обеими группами МСК была ниже среднего уровня.
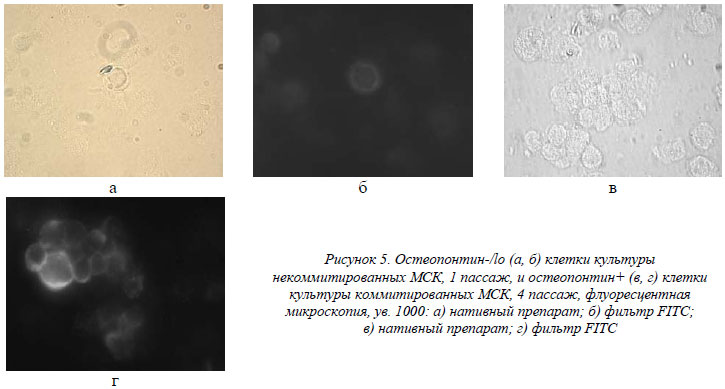
Остеопонтин (ОП) взят в качестве маркера эффективности остеогенной дифференциации культивированных МСК, наряду со ЩФ. Как видно из таблицы, некоммитированные МСК экспрессировали его на уровне единичных клеток во всех пассажах (<2%), в то время как коммитированная группа достоверно экспрессировала его на уровне приблизительно 95% (рис. 5). Это важный фактор, регулирующий иммунный ответ и воспаление. Его экспрессия инициируется, как в остеобластах и остеокластах, так и в активированных Т-клетках, макрофагах и натуральных киллерах [10, 16]. ОП также стимулирует привлечение макрофагов и лимфоцитов в участок повреждения ткани и регулирует их активность [18]. ОП является незаменимым фактором-посредником активации и адгезии остеокластов к гидроксиапатиту минеральной фазы костного матрикса. Именно этот протеин через витронектиновый рецептор «заякоривает» остеокласты в участках активной костной резорбции [18], а также участвует в активной продукции остеобластами остеоидов [12, 18]. Экспрессия ОП, вероятнее всего, является и частью быстрого Т-лимфоцит-зависимого ответа при бактериальной инфекции, что может предварять классические формы Т-клеточного иммунитета [14].
Выводы
Таким образом, согласно исследованной панели антигенов и полученным данным (см. табл.), и учитывая продукцию ЩФ, фенотип некоммитированых МСК можно представить в следующем виде:
СD44high/СD166high/СD58+/CD62L+/CD29+/CD49b+/CD49c+/CD56+/CD54+/CD73+/CD90+/CD105+/osteopontin-/lo
Фенотип же индуцированных по остеогенному типу МСК выглядит следующим образом:
СD44high/СD166high/СD58+/CD62L+/CD29+/CD49b+/CD49c+/CD54+/CD73+/CD90+/CD105+/alkaline phosphatasehigh/ osteopontin+/CD56-/lo/HLA-DR-/lo.
1. Деклараційний патент на корисну модель (11) 8551 (13) U (51) 7 А61В5/00. Спосіб імунофлуоресцентного маркування поверхневих антигенів, зафіксованих на скельцях адгерентних клітин в культурі з використанням моноклональних антитіл для флуоресцентної мікроскопії / Корчак О.М., Зубов Д.О., Попандопуло А.Г., Разєнкова І.А, Сліпченко І.О. (Україна).- Заяв. №2003087368 від 05.08.2003; Опубл. 15.08.2005. - Бюл. №8. – 2 с.
2. Airas L., Niemela J., Salmi M. et al. Differential regulation and function of CD73, a glycosyl-phosphatidylinositol-linked 70-kD adhesion molecule, on lymphocytes and endothelial cells // J. Cell Biol. – 1997. – Vol. 136, №2. – P. 421-431.
3. Andrade C.M., Roesch G.C., Wink M.R. et al. Activity and expression of ecto-5'-nucleotidase/CD73 are increased during phenotype conversion of a hepatic stellate cell line // Life Sci. – 2008. – Vol. 82, №1-2. – P. 21-29.
4. Chung C., Golub E., Forbes E., Tokuoka T. and Shapiro I. Mechanism of action of β-glycerophosphate on bone cell mineralization // Calcif. Tissue Internat. – 1992. – Vol. 51, №4. - P. 305-311.
5. Conley B.A., Koleva R., Smith J.D. et al. Endoglin controls cell migration and composition of focal adhesions: function of the cytosolic domain // J. Biol. Chem. – 2004. – Vol. 25. – P. 27440-27449.
6. Dominici M., Le Blanc K., Mueller I. et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement // Cytotherapy. – 2006. – Vol. 8, №4. – P. 315-317.
7. Grimer R.J., Belthur M., Carter S.R. et al. Extendible replacements of the proximal tibia for bone tumors // J. Bone Joint Surg. [Br]. – 2000. – Vol. 82. – P. 255-259.
8. Kim Y.S., Park G.B., Song H.K. et al. Cross-linking of CD54 on Burkitt lymphoma cell line Raji and Ramos induces FasL expression by reactive oxygen species and apoptosis of adjacent cells in Fas/FasL interaction // J. Immunother. – 2007. – Vol. 30, №7. – P. 727-739.
9. Kuroki T., Shingu N., Koshihara Y. et al. Effects of cytokines on alkaline phosphatase and osteocalcin production, calcification and calcium release by human osteoblastic cells // J. Bone and Joint Sur. – 1997. – Vol. 79. – P. 1699-1709.
10. Merry K., Dodds R., Littlewood A. et al. Expression of osteopontin mRNA by osteoclasts and osteoblasts in modelling adult human bone // J. Cell Sci. – 1993. – Vol. 104. – P. 1013-1020.
11. Minguell J.J., Erices A. and Conget P. Mesenchymal stem cells // Exp. Biol. Med. (Maywood). -2001. – Vol. 226. – P. 507–520.
12. Mulari M.T., Qu Q., Härkönen P.L. and Väänänen H.K. Osteoblast-like cells complete osteoclastic bone resorption and form new mineralized bone matrix in vitro // Calcif. Tissue Int. - 2004. – Vol. 75, №3. – P. 253-261.
13. Nicholson I.C. CD62L (L-selectin) // J. Biol. Regul. Homeost. Agents. – Vol. 16, №2. – P. 144-146.
14. Patarca R., Freeman G.J., Singh R.P. et al. Structural and functional studies of the early T lymphocyte activation 1 (Eta-1) gene. Definition of a novel T cell-dependent response associated with genetic resistance to bacterial infection // J. Exp. Med. – 1989. – Vol. 170, №1. – P. 145-161.
15. Ruiz С., Pérez Е., García-Martínez О. et al. Expression of cytokines IL-4, IL-12, IL-15, IL-18, and IFNγ and modulation by different growth factors in cultured human osteoblast-like cells // J. Bone and Miner. Metab. – 2007. – Vol. 25, №5. - Р. 286-292.
16. Scatena M., Liaw L. and Giachelli C.M. Osteopontin: a multifunctional molecule regulating chronic inflammation and vascular disease // Arterioscler. Thromb. Vasc. Biol. – 2007. – Vol. 27, №11. – P. 2302-2309.
17. Song S.J., Jeon O., Yang H.S. et al. Effects of culture conditions on osteogenic differentiation in human mesenchymal stem cells // J. Microbiol. Biotechnol. – 2007. – Vol. 17, №7. – P. 1113-1119.
18. Wang K., Shi Y. and Denhardt D. Osteopontin regulates hindlimb-unloading-induced lymphoid organ atrophy and weight loss by modulating corticosteroid production // PNAS. – 2007. - Vol. 104. – P. 14777–14782.