Журнал «Травма» Том 12, №2, 2011
Вернуться к номеру
Остеогенна активність стовбурових стромальних клітин кісткового мозку в дорослих при остеоартрозі на ґрунті спондилоепіфізарної дисплазії
Авторы: Гужевський І.В., Герасименко С.І., Панченко Л.М., Магомедов О.М., ДУ «Інститут травматології та ортопедії АМН України», м. Київ
Рубрики: Травматология и ортопедия
Версия для печати
Досліджено зразки спонгіозної кісткової тканини голівки стегнової кістки 13 хворих віком від 28 до 61 року з коксартрозом 3–4-ї стадії (за класифікацією J.Н. Kellgren, J.S. Lawrence, 1957), що виник на ґрунті спондилоепіфізарної дисплазії. Установлено значне підвищення регенераторного потенціалу клітин-попередників кісткового мозку в ділянці уражених патологічним процесом суглобів, що дозволяє очікувати позитивних віддалених результатів при застосуванні хірургічних методів лікування, пов''язаних з імплантацією алогенних матеріалів у ділянку суглобів.
Остеогенна активність, остеоартроз, спондилоепіфізарна дисплазія.
Вступ
Остеоартроз (ОА) — найбільш поширене захворювання суглобів, поширеність якого неухильно зростає [1, 2, 7, 8]. Відповідно до сучасної дефініції, ОА є групою захворювань суглобів різної етіології, але з однаковим кінцевим результатом — утратою суглобового хряща та супутнім ураженням субхондральної кістки, синовіальної оболонки, капсули, періартикулярних тканин [7]. У більшості публікацій ОА поділяють на первинний (ідеопатичний) та вторинний (із виявленими етіологічними факторами) [7, 18]. Вважають, що генетичні чинники мають найбільше значення як фактори ризику первинного ОА, і серед них одне з перших місць посідають прояви спадкової патології гену колагену ІІ типу [13, 14, 17–19], до яких належить спондилоепіфізарна дисплазія (СЕД) [12, 13, 16].
Незважаючи на успіхи у вивченні патогенезу ОА, на сьогодні серед дослідників не існує одностайної думки щодо стану регенераторно-компенсаційних процесів у різних тканинах ділянки суглоба [2, 7, 18]. Зокрема, достатньо не вивчені процеси перебудови кісткової тканини в субхондральних відділах кісток при ОА різної етіології, що залежать від активності остеобластів і безпосередньо впливають на результати хірургічних втручань [3, 6, 9]. Джерелом поповнення остеобластів є остеогенні клітини-попередники кісткового мозку або стовбурові стромальні клітини, властивості яких вивчають методом клонування in vitro. У культурах остеогенні клітини-попередники утворюють колонії, звідси походить їх назва — колонієутворюючі одиниці фібробластів (КУОф) [3, 6]. Існують дані про КУОф кісткового мозку різних ділянок скелета людини при де- яких ортопедичних захворюваннях [3, 9], але відомостей про показники регенаторного потенціалу кісткової тканини у хворих з ОА, що виникає на ґрунті СЕД, та практичне застосування отриманих результатів із діагностичною та прогностичною метою у доступній нам літературі ми не знайшли.
Також недостатньо вивчені біохімічні маркери інтенсивності деградації хрящового матриксу, які в більшості публікацій оцінюються шляхом вимірювання рівнів відповідних метаболітів у крові та сечі, а не безпосередньо в нативному хрящі та синовіальній рідині, що знижує інформативність подібних досліджень [11].
Пов’язані з генетично запрограмованими порушеннями синтезу колагену ІІ типу метаболічні, імунологічні та біомеханічні зміни обумовлюють особливості перебігу та характеру прогресування ОА при СЕД і вимагають особливої тактики лікування [4, 5, 10, 12]. На жаль, ліків від дисплазії сполучної тканини ще не існує, але, безумовно, реально при вивченні особливостей перебігу регенераторно-компенсаційних процесів у ділянці суглобів у хворих з ОА на ґрунті СЕД підвищити ефективність консервативного лікування та подовжити терміни позитивних результатів хірургічного лікування обраної групи хворих [4, 5, 11, 15, 18].
Матеріал і методи дослідження
Метою дослідження було одночасне вивчення показників остеогенної активності стовбурових стромальних клітин кісткового мозку в голівці стегнової кістки та локальних біохімічних показників деградації хрящового матриксу шляхом дослідження зразків спонгіозної тканини та суглобового хряща, отриманих при виконанні оперативних втручань у дорослих хворих із коксартрозом (КА) на тлі СЕД. Досліджено зразки спонгіозної кісткової тканини голівки стегнової кістки, суглобового хряща та синовіальної рідини від 13 хворих віком від 28 до 61 року з КА 3–4-ї стадії (за класифікацією J.Н. Kellgren, J.S. Lawrence, 1957), що виник на ґрунті СЕД. Забір матеріалу для дослідження проводився у стерильних умовах під час операцій ендопротезування кульшового суглоба. Здобуті в процесі дослідження показники порівнювали з нормою та аналогічними показниками хворих із диспластичним (на ґрунті локальної дисплазії суглоба) КА 3–4-ї ст. [3, 6, 9].
Клонування стовбурових стромальних клітин кісткового мозку проводили за методикою О.Я. Фріденштейна (1973) в модифікації В.С. Астахової (1982) при стандартних умовах протягом 14 діб без зміни культурального середовища у чашках Петрі, матеріал знаходився при 37 °С у газовій суміші з 5% умістом СО2 в атмосферному повітрі з використанням летально опромінених клітин кісткового мозку кроля як фідера. Остеогенну активність стовбурових стромальних клітин кісткового мозку оцінювали за такими показниками: загальна кількість ядровмісних клітин та кількість стовбурових стромальних клітин (КУОф кісткового мозку) в 1 см3 та ефективність їх клонування серед 105 ядровмісних клітин. Ефективність клонування КУОф кісткового мозку визначали за формулою:
ЕКУОф = К/N х 105,
де К — кількість колоній, що виросли у чашці Петрі х 105; N — кількість клітин, що посаджено у чашку Петрі.
Кількість КУОф в 1 см3 визначали за формулою:
Кількість КУОф в 1 см3 = К х n/N x V,
де К — кількість колоній, що виросли у чашці; n — кількість клітин, що вимито із зразка спонгіозної кістки; N — кількість клітин, що посаджено; V — об’єм зразка спонгіозної кістки.
З біохімічних способів дослідження використовували визначення глікозаміногліканів у хрящі карбазоловим методом С.А. Кляцкіна та Р.І. Ліфшиц, 1989. Уміст колагену визначали за методом А.А. Крель та Л.Н. Фурцевої, 1968, а визначення активності колагенази в синовіальній рідині — за S. Lindy та J. Halme, 1973.
Розрахунки проводили за кожним дослідом й у середньому в групі. Статистичну обробку отриманого матеріалу виконували за допомогою пакету програм Statistica. Середні величини подані як M ± m, де M — середнє значення показника, m — стандартна похибка середнього.
Результати та їх обговорення
Вирощені 42 культури стромальних фібробластів кісткового мозку, значущі результати отримані в 12 випадках, а в ішних випадках отримали пророст культур грибами роду Aspergillus fumigatus і Aspergillus niger та іншою бактеріальною флорою. У наших попередніх дослідженнях [9] були вивчені показники регенераторного потенціалу спонгіозної кістки проксимального епіметафізу стегна в нормі та при КА на ґрунті локальної дисплазії кульшового суглоба. Саме ці показники були використані нами як показники контрольної групи та групи порівняння (табл. 1).
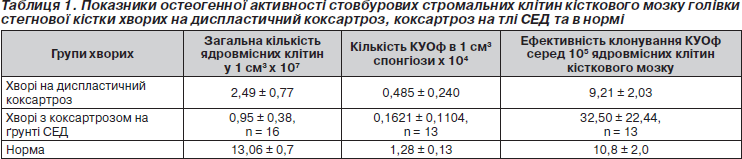
Як видно з табл. 1, ефективність клонування КУОф хворих із коксартрозом на ґрунті СЕД вірогідно вища за аналогічні показники здорових осіб та хворих із коксартрозом унаслідок локальної дисплазії кульшового суглоба. Цей факт може бути пояснений дією факторів, що стимулюють активність остеогенних клітин-попередників кісткового мозку у хворих із СЕД. Імовірно, причиною виникнення подібних стимулюючих агентів є більш інтенсивні процеси деградації хрящового матриксу при спадковій неповноцінності колагену ІІ типу.
Біохімічні дослідження суглобового хряща та синовіальної рідини, отримані під час операцій, дозволили встановити низький уміст колагену та глікозаміногліканів у суглобовому хрящі та підвищення активності колагенази в синовіальній рідині (табл. 2), що підтверджує наявність виражених процесів деструкції основних складових хрящового матриксу.
Висновки
1. У хворих із пізніми стадіями коксартрозу, що виник на ґрунті СЕД, спостерігається значне підвищення регенераторного потенціалу клітин-попередників кісткового мозку в ділянці уражених патологічним процесом суглобів.
2. Імовірно, що фактори, які підвищують ефективність клонування колонієутворюючих одиниць фібробластів, пов’язані з дією продуктів інтенсивної деградації хрящового матриксу, що, у свою чергу, обумовлено спадковою неповноцінністю колагену ІІ типу у хворих із СЕД.
3. Таким чином, при ОА на ґрунті СЕД не спотерігається виснаження регенераторного потенціалу кісткового мозку, що дозволяє очікувати тривалих позитивних результатів при застосуванні хірургічних методів лікування, пов’язаних з імплантацією алогенних матеріалів у ділянку суглобів.

