Журнал «Здоровье ребенка» 3 (30) 2011
Вернуться к номеру
Особенности течения бронхолегочной дисплазии у детей на современном этапе
Авторы: Сенаторова А.С., Логвинова О.Л., Черненко Л.Н., Муратов Г.Р. Харьковский национальный медицинский университет КУОЗ «Харьковская областная детская клиническая больница»
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье приведены современные сведения об особенностях течения бронхолегочной дисплазии у детей. У 75 % детей выявлена легочная гипертензия, в комплекс терапии которой входило назначение ингибитора фосфодиэстеразы-5 силденафила. Приведено описание собственного клинического наблюдения ребенка с бронхолегочной дисплазией, показана высокая эффективность лечения легочной гипертензии силденафилом.
Бронхолегочная дисплазия, легочная гипертензия, силденафил, дети.
В 2007 году Украина перешла на критерии регистрации перинатального периода соответственно рекомендациям ВОЗ, что обусловило увеличение количества детей с низкой и экстремально низкой массой тела. Преждевременные роды регистрируются с полных 22 недель гестации [14]. Благодаря усовершенствованию методов интенсивной терапии и сурфактантной поддержке неонатологи добились выживания маловесных малышей, родившихся с респираторными нарушениями и другими состояниями, требующими искусственной вентиляции легких. Однако незрелость бронхолегочной системы, баротравма, повреждение кислородными радикалами, воспаление у многих из них привели к формированию хронических изменений в легких — бронхолегочной дисплазии (БЛД) [6, 9]. По современным данным, частота бронхолегочной дисплазии составляет 73 % в группе детей с массой тела менее 1000 г; 41 % с массой тела 1000–1499 г; 16 % среди новорожденных с массой тела выше 1500 г. Легочная гипертензия и недостаточность кровообращения при БЛД служат основными причинами ранней смертности выживших в неонатальный период больных и составляют 23–36 % [8].
Определение бронхолегочной дисплазии (впервые данное Northway в 1967 г.) как хронического заболевания недоношенных, которые находились на искусственной вентиляции легких (ИВЛ), с жесткими параметрами в настоящее время претерпело ряд значительных изменений. Согласно современному определению, бронхолегочная дисплазия — это полиэтиологическое хроническое заболевание морфологически незрелых легких, развивающееся у новорожденных, главным образом глубоко недоношенных, в результате интенсивной терапии респираторного дистресс-синдрома и/или пневмонии. Протекает с преимущественным поражением бронхиол и паренхимы легких, развитием эмфиземы, фиброза и/или нарушением репликации альвеол. Проявляется зависимостью от кислорода в возрасте 28 суток жизни и старше, бронхообструктивным синдромом и симптомами дыхательной недостаточности и характеризуется специфичными рентгенологическими изменениями в первые месяцы жизни и регрессом клинических проявлений по мере роста ребенка [7]. Принято выделять классическую и «новую» БЛД недоношенных и БЛД доношенных. Классическая БЛД — хроническое обструктивное заболевание легких, возникающее вследствие повреждения легких кислородом, давлением, объемом, ведущее к воспалительному поражению дыхательных путей, фиброзу и эмфиземе [8]. Первоначально БЛД рассматривалась как результат повреждающего действия кислорода и искусственной вентиляции на легкие новорожденного, что нашло отражение в классической формуле A. Philip (1975): «кислород + давление + время» [5, 9, 18].
В настоящее время классическую БЛД редко увидишь у новорожденных с массой тела больше 1200 г и гестационным возрастом более 30 недель. Мягкая техника режимов вентиляции, применение кортикостероидов антенатально, сурфактантная терапия уменьшили развитие серьезных повреждений легочной ткани, в частности тотальное фиброзирование легочной ткани, у доношенных и недоношенных новорожденных.
У детей с очень низкой массой тела все чаще имеет место новая БЛД — паренхиматозное легочное заболевание, характеризующееся нарушением роста и развития альвеол и сосудов малого круга кровообращения у детей с очень низкой массой тела при рождении [7].
Следует отметить, что факт преждевременных родов не всегда обязателен для развития БЛД. У доношенных детей, требовавших ИВЛ с длительной экспозицией и высокими концентрациями кислорода при лечении врожденных пороков сердца или пневмонии, поражений центральной нервной системы, также нередко развивается БЛД [7]. Таким образом, в настоящее время о БЛД можно говорить как о мультифакторном процессе с достаточно разнообразной клинической картиной, требующей дальнейших научных поисков причин формирования БЛД и ведения таких больных [12]. Диагноз БЛД устанавливается у детей до трехлетнего возраста, а само заболевание характеризуется регрессом клинических проявлений по мере роста ребенка, с обязательным установлением исхода заболевания [7]. Обобщая современные сведения о катамнезе детей с БЛД, можно выделить следующие варианты исходов при данном заболевании:
— клиническое выздоровление;
— хронический бронхит;
— интерстициальный пневмонит;
— эмфизема легких;
— облитерирующий бронхиолит;
— рецидивирующий бронхит;
— пневмофиброз (пневмосклероз);
— бронхоэктазы.
Несмотря на значительный научный прогресс в определении этиологических факторов, патогенеза и клиники бронхолегочной дисплазии, до настоящего времени не удается достичь желаемого уровня контроля над этим заболеванием. У 76 % детей с бронхолегочной дисплазией развивается легочная гипертензия, при прогрессировании которой запускаются механизмы ремоделирования сосудов малого круга кровообращения с последующим формированием дисфункции миокарда сердца, что является важным патогенетическим звеном в формировании хронического легочного сердца. Повышение сопротивления в сосудах малого круга кровообращения увеличивает работу правого желудочка (ПЖ) сердца и приводит к его гипертрофии. Одновременно с этим увеличивается конечное диастолическое давление в правом желудочке, ухудшается кровоток в субэндокардиальном участке наружной стенки правого желудочка, что в условиях повышенной постнагрузки приводит к развитию ишемии миокарда [2].
Анализ литературных данных свидетельствует, что в последние годы предметом исследований клиницистов и физиологов стали механизмы развития диастолической дисфункции (ДД) миокарда, ее роль в возникновении хронической сердечной недостаточности, при которой происходит ремоделирование левого желудочка (ЛЖ). В своих работах F.I. Parthenakis, E.M. Kanonpakis показали, что функциональный класс хронической сердечной недостаточности, толерантность к физической нагрузке, качество жизни пациентов и даже прогноз заболевания тесно связаны с параметрами диастолического наполнения [1, 13]. Наиболее частой причиной ДД является нарушение сократительной способности миокарда. К основным патогенетическим факторам, которые способствуют развитию ДД, относят фиброз миокарда, его гипертрофию, ишемию, а также возрастание постнагрузки при артериальной гипертензии. Важнейшим следствием взаимодействия перечисленных факторов является увеличение концентрации ионов кальция в кардиомиоцитах, снижение податливости миокарда ЛЖ, нарушение расслабления сердечной мышцы, изменение нормального соотношения раннего и позднего наполнения ЛЖ, повышение конечного диастолического объема. Для оценки центральной гемодинамики и определения уровня среднего давления в легочной артерии как показателя формирования легочной гипертензии используют допплерэхокардиографическое исследование.
На данном этапе развития медицины в Украине протокола лечения бронхолегочной дисплазии нет. Лечение носит симптоматический характер. Согласно рекомендациям Европейского общества кардиологов и Европейского респираторного общества, одобренным Международным обществом трансплантологии сердца и легких и Ассоциацией европейской педиатрической кардиологии, терапия легочной гипертензии предусматривает применение силденафила — ингибитора фосфодиэстеразы-5, повышающего уровень циклического гуанозинмонофосфата и образования оксида азота, которые являются мощными вазодилататорами, особенно в сосудах малого круга кровообращения, и таким образом влияют на этиопатогенетическое звено формирования легочной гипертензии у детей с бронхолегочной дисплазией [7, 19].
Цель работы — определить особенности течения бронхолегочной дисплазии у детей на современном этапе.
Материалы и методы
Обследованы 65 детей в возрасте от 2 месяцев до 3 лет с бронхолегочной дисплазией (1-я группа), находившихся на стационарном лечении в областной детской клинической больнице г. Харькова. Группу сравнения составили 10 детей с диагнозом «рецидивирующий бронхит» (2-я группа). У всех обследованных пациентов изучены анамнестические и клинические данные, применялись общепринятые лабораторные методы обследования. Допплерэхокардиографическое обследование с вычислением данных трансмитрального потока проводилось на ультразвуковом аппарате AU3Partner фирмы Esaote Biomedica (Италия). Диастолическую функцию левого желудочка изучали по методике L.K. Hattle, B. Angelsen (1985) в импульсном допплеровском режиме с картированием трансмитрального потока с верхушечного доступа четырехкамерного сердца. По кривой трансмитрального потока крови измерялись следующие параметры диастолической функции левого желудочка: максимальная скорость потока в фазу раннего диастолического наполнения ЛЖ (Vе, м/с); скорость потока в фазу позднего диастолического наполнения ЛЖ в систолу предсердий (Vа, м/с); время ускорения скорости потока в фазу раннего диастолического наполнения ЛЖ (АТе, с); время замедления скорости потока в фазу раннего диастолического наполнения (DTе, с); время изоволюметрического расслабления ЛЖ (IVRT, с). На основании полученных величин изучали соотношение скоростей в фазы раннего и позднего диастолического наполнения левого желудочка (Vе/Vа). Уровень давления в легочной артерии измерялся методом A. Kitabatake at al. (1983) — по временным показателям систолического потока в выходном отделе правого желудочка. Использовали специальную таблицу соответствия определенного значения среднего давления в легочной артерии определенному отношению между временем акселерации (АсТ) и периодом изгнания (RVET). За нормативные показатели трансмитрального потока были приняты данные, полученные при обследовании контрольной группы, среди которых отсутствовали факторы, изменяющие диастолическую функцию. Все данные, полученные в ходе обследования, обработаны с помощью стандартной компьютерной программы Microsoft Exsel с использованием среднего значения, ошибки среднего с определением вероятности различий по t-критерию Стьюдента.
Результаты исследования
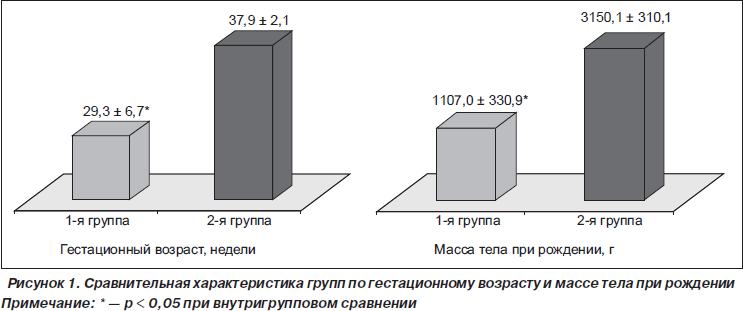
В группе детей с БЛД по полу превалировали мальчики (69,2 ± 7,3 %, р < 0,05), по возрасту наибольшую группу составили дети 2–12 месяцев (66,1 ± 7,5 %, р < 0,05). В группе сравнения обследованных детей также преобладали мальчики (70 %, р < 0,05), по возрасту — дети 1 года — 2 лет (80,00 ± 1,54, р < 0,05). Анализ антенатального периода у обследованных детей показал, что у матерей обследуемых детей 1-й группы достоверно чаще регистрировались наличие самопроизвольных абортов (41,5 %, p < 0,01), преэклампсия (78,4 %, p < 0,01), угроза преждевременных родов (90,7 %, p < 0,01), фетоплацентарная недостаточность (58,4 %, p < 0,01), инфекции урогенитальной области (41,5 %, p < 0,05) и острые инфекционные заболевания во время беременности (44,6 %, p < 0,05), осложненный акушерско-гинекологический анамнез (38,4 %, p < 0,05), что указывает на возможные факторы риска возникновения бронхолегочной дисплазии. При сравнительном анализе интранатального периода отметили, что у матерей группы детей с БЛД достоверно чаще регистрировались многоводие (60 %, p < 0,01), быстрые и стремительные роды (75,3 %, p < 0,01), преждевременное излитие околоплодных вод (47,6 %, p < 0,01), хроническая внутриутробная гипоксия (40 %, р < 0,05), ЗВУР (16,9 %, р < 0,05 ), тяжелая асфиксия (47,6 %, р < 0,01), хориоамнионит (33,8 %, р < 0,05), роды путем кесарева сечения (24,6 %, р < 0,05). После рождения 93 % детей из основной группы требовали проведения первичной реанимации в родильном зале в виде санации верхних дыхательных путей, непрямого массажа сердца, интубации трахеи, введения адреналина, куросурфа, проведения искусственной вентиляции легких, средняя продолжительность которой составила 91,5 ± 60,7 дней (p < 0,01). Изучение распределения детей по сроку гестации показало, что в основной группе гестационный возраст составил в среднем 29,3 ± 6,7 недели, тогда как во 2-й группе — 37,9 ± 2,1 недели (р < 0,05). Масса тела при рождении также имела отличия — 1107,0 ± ± 330,9 г в первой группе по сравнению с 3150,1 ± ± 310,1 г во 2-й (р < 0,05) (рис. 1).
Патология в неонатальном периоде у детей с бронхолегочной дисплазией распределилась следующим образом: асфиксия тяжелой степени — 47,6 %, синдром дыхательных расстройств — 90,7 %, врожденная пневмония — 95,3 % (p < 0,01).
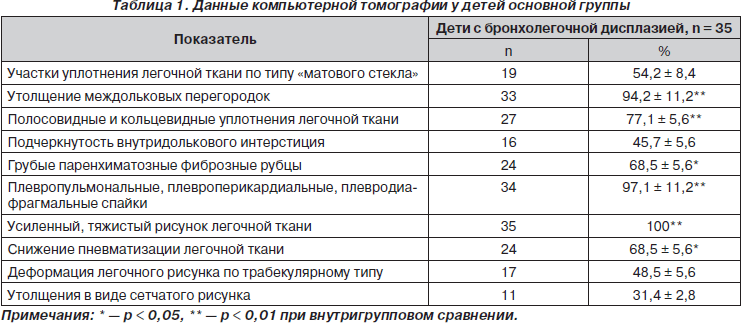
Данные рентгенологического исследования органов грудной клетки не всегда полно отражают изменения паренхимы легких и наличие фиброза. Типичные для классической БЛД рентгенологические изменения, включающие чередование вздутий (булл) с лентообразными уплотнениями, придающими легочному рисунку сетчатый характер, наблюдаются далеко не у всех детей. На современном этапе компьютерная томография занимает одно из ведущих мест в постановке диагноза бронхолегочной дисплазии, исследование было проведено 35 больным из основной группы. Характер изменений легких представлен в табл. 1.
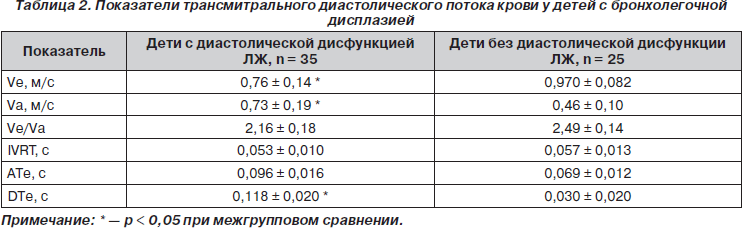
У 75 % детей из 1-й группы было выявлено повышение давления в стволе легочной артерии. У 67,3 % детей 1-й группы имела место диастолическая дисфункция левого желудочка, являющаяся предиктором формирования кардиоваскулярных осложнений (табл. 2).
Лечение бронхолегочной дисплазии [11] должно быть основано на адекватной калорийности питания — 120–140, а иногда и 180 ккал/кг/сутки, что должно обеспечивать прибавку 15–30 г/сут. Важно поддержание максимальных значений парентеральных белков, углеводов, жиров, витаминов и микроэлементов. Ежедневные потребности в белке и жире составляют не менее 3–3,5 г/кг массы тела в сутки. Потребности в витамине А должно составлять 1500 МЕ/сут. Витамин А участвует в нормальном росте и дифференцировке эпителиальных клеток, поэтому при его дефиците последовательность патологических изменений такая же, как и при БЛД (некротический трахеобронхит — сквамозная метаплазия — снижение растяжимости легких). Витамин Е в питании должен составлять 5 мг/кг/сут. Следует помнить, что в настоящее время все парентеральные препараты витамина Е исключены из общей практики из-за неудачных результатов применения, вероятно в связи с недостаточным мембраностабилизирующим действием, а введение витамина Е внутрь ассоциируется с повышением частоты некротизирующего язвенного колита, что может быть связано с высокой осмолярностью препарата. Нет доказательств того, что витамин Е влияет на частоту или тяжесть БЛД. Микроэлементы являются кофакторами антиоксидантной защиты, особенно важно поддержание в питании уровня кальция 200 мг/кг/сут, фосфора 125 мг/кг/сут, железа 2–4 мг/кг/сут для стабилизации мембран у ребенка с БЛД.
Основные принципы медикаментозной терапии
В острый период — по показаниям — противовирусная и антибиотикотерапия. Выбор антибиотика производится с учетом предполагаемого возбудителя: цефалоспорины III поколения, аминогликозиды, карбапенемы назначаются при частом внутрибольничном инфицировании грамотрицательными бактериями; макролиды — при атипичной этиологии инфекции. Доказана эффективность азитромицина и кларитромицина и при ступенчатой терапии Ps.aeruginosa.
Муколитическая терапия (при усилении бронхообструкции на фоне респираторной инфекции) — лазолван (1,5–2 мг/кг/сут) энтерально или в ингаляциях через небулайзер. При обострении заболевания применяют сальбутамол в ингаляциях 100–200 мкг каждые 6–8 часов короткими курсами.
Петлевые диуретики (фуросемид) назначаются при лечении легочной гипертензии с помощью выведения излишков натрия и воды. Фуросемид назначается в дозе 1–2 мг/кг/сут внутривенно от 1 до 3 раз в день в течение 1 недели. Достаточно эффективно применение фуросемида, растворенного в физиологическом растворе, через небулайзер в дозе 1 мг/кг каждые 6 часов.
Для длительной диуретической терапии (до 2–2,5 месяца) наиболее рационально использование калийсберегающих диуретиков спиронолактона (верошпирона) по 2 мг/кг/сут в 2 приема.
Считается оправданным назначение метилксантинов, которые мягко стимулируют диурез, активируют дыхательный центр, улучшают сократительную функцию диафрагмы, а также снижают сосудистое сопротивление и обладают бронходилатирующим действием. Нагрузочная доза эуфиллина 5–6 мг/кг, затем 3–6 мг/кг/сут каждые 8–12 часов в течение 1 месяца.
Согласно руководству по лечению легочной гипертензии у детей (European Heart Journal, 2009) современная тактика лечения легочной гипертензии предусматривает применение силденафила, в основе действия которого лежит повышение уровня циклического гуанозинмонофосфата за счет ингибирования фосфодиэстеразы-5. Это приводит к расслаблению гладкой мускулатуры. Кроме того, силденафил оказывает сосудорасширяющее действие на молекулярном уровне за счет образования оксида азота (основного вазодилататора, выделяемого эндотелием), и уменьшает давление в малом круге кровообращения, что приводит к снижению давления в легочных артериях. В детской практике силденафил назначается из расчета 1–2 мг/кг/сут с длительностью приема в среднем до 18 месяцев.
Имеются данные о возможности применения в детской практике препаратов из группы аналогов простациклинов, представителями которой являются илопрост и трепостинил. Илопрост обладает также антиагрегантным действием. Препарат подавляет агрегацию, адгезию и активацию тромбоцитов, вызывает дилатацию артериол и венул, снижает повышенную сосудистую проницаемость, активирует фибринолиз, подавляет адгезию и миграцию лейкоцитов после повреждения эндотелия, уменьшает образование свободных радикалов кислорода. Применяют внутривенные инфузии из расчета 0,5–2 мг/кг/мин, длительность терапии до 4 недель. Трепостинил повышает уровень циклического гуанозинмонофосфата, приводящего к вазодилатации. Назначается в виде внутривенных инфузий в дозе 1,25 мг/кг/мин.
В аспекте важной патогенетической роли ренин-ангиотензин-альдостероновой системы в формировании легочной гипертензии препаратами выбора являются ингибиторы АПФ — каптоприл 0,1–0,5 мг/кг каждые 8 часов в течение 2 месяцев. Данная группа препаратов препятствует задержке натрия и воды, замедляет процесс ремоделирования миокарда, уменьшает периферическую артериальную вазоконстрикцию.
Важную задачу антиоксидантной защиты выполняет коэнзим Q10. Он принимает участие в синтезе АТФ, обладает мембраностабилизирующим действием. Эффективно применение препаратов L-карнитина (милдронат в дозе 50–100 мг/кг/сут в течение 1–2 месяцев) в сочетании с витаминами (кардонат 1 табл. 1 раз в день в течение месяца).
Вибрационный массаж, постуральный дренаж, лечебная физкультура также неотъемлемые части лечения БЛД [11].
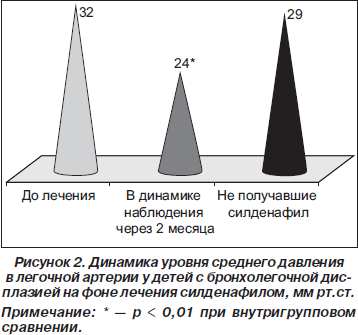
В комплекс лечебных мероприятий для детей с легочной гипертензией на фоне бронхолегочной дисплазии включался ингибитор фосфодиэстеразы-5 силденафил в суточной дозе 1–2 мг/кг в зависимости от уровня среднего давления в легочной артерии. Через 2 месяца у 80 % детей, получавших силденафил, отмечалось достоверное снижение давления в легочной артерии (р < 0,01) (рис. 2).
В качестве иллюстрации приводим выписку из истории болезни ребенка П., 8 месяцев, находившегося на стационарном лечении в ОДКБ. Впервые мать обратилась в областной центр диагностики и лечения ОДКБ, когда ребенку было 3 месяца с жалобами на наличие у него учащенного дыхания в покое, дистанционных хрипов. Из анамнеза жизни и заболевания известно, что ребенок от II беременности, протекающей на фоне угрозы прерывания на всем протяжении беременности, фетоплацентарной недостаточности, преэклампсии средней степени. Первая беременность закончилась самопроизвольным абортом на сроке 9 недель. Роды первые, стремительные, в сроке гестации 33 недели. Масса тела при рождении 1240 г. Состояние ребенка после рождения расценено как крайне тяжелое за счет выраженной кардиореспираторной недостаточности, неврологической симптоматики. В связи с неэффективностью функции дыхания переведен на искусственную вентиляцию легких, которая проводилась в течение 21 суток, далее был кислородозависим в течение 10 дней. Выписан домой в возрасте 2 месяцев с диагнозом: перинатальное гипоксически-ишемическое поражение ЦНС, тяжелое течение, ранний восстановительный период, с отеком головного мозга, перивентрикулярная ишемия II ст., синдром ликвородинамических нарушений. Бронхолегочная дисплазия II–III ст. Функционирующее овальное окно, недостаточность кровообращения 0 ст. Недоношенность II ст. Анемия недоношенных I ст. Состояние после лазеркоррекции по поводу активной ретинопатии недоношенных обоих глаз. Реконвалесцент по внутриутробной пневмонии.
У ребенка в возрасте 3 месяцев мать отметила усиление тахипноэ, наличие дистанционных хрипов, в связи с чем он впервые госпитализируется в ОДКБ. Объективно: состояние ребенка расценено как тяжелое за счет респираторных нарушений, неврологической симптоматики. Ребенок отставал в нервно-психическом развитии: не держал голову, не улыбался, не гулил. Плохо прибавлял в весе. Обращало на себя внимание наличие множественных стигм дизэмбриогенеза: микроцефальной формы головы, короткой шеи, широкой переносицы, короткого фильтра, готического неба, гипертелоризма глазных щелей и сосков, низко расположенных ушных раковин и пупочного кольца. Тахипноэ до 60–62 в минуту с участием вспомогательной мускулатуры. Втяжение податливых мест грудной клетки. Перкуторно над легкими коробочный звук, умеренное притупление в нижних отделах с обеих сторон. Аускультативно — на фоне жесткого дыхания средне- и мелкопузырчатые хрипы с обеих сторон. Тоны сердца ритмичные, приглушены. Живот мягкий, не вздут, доступен пальпации. Печень выступает из-под края реберной дуги на 3 см, край эластичный. Склонность к запорам. Мочеиспускание без особенностей.
В комплекс лабораторно-инструментальных методов исследования было включено проведение высокоразрешающей компьютерной томографии органов грудной клетки (рис. 3).
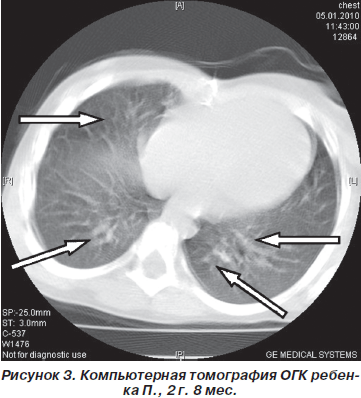
Диагноз: Бронхолегочная дисплазия, хроническая стадия, классическая форма, тяжелое течение. Легочная гипертензия I ст. Заключение: легочный рисунок диффузно усилен и деформирован по груботрабекулярному типу, утолщение междольковых перегородок.
КТ-признаки диффузного пневмофиброза
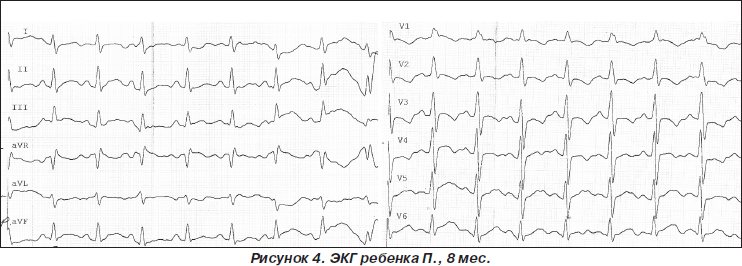
При регистрации ЭКГ у ребенка были выявлены изменения в виде синусовой тахикардии, неполного блока правой ветви пучка Гиса, дилатации правого желудочка, гипоксических нарушений реполяризации (рис. 4).
Диагноз: бронхолегочная дисплазия, хроническая стадия, классическая форма, тяжелое течение. Легочная гипертензия I ст. Заключение: синусовая тахикардия (ЧСС 141 уд/мин). ЭОС отклонена вправо. Перегрузка правого желудочка: глубокий зубец S в отведении V5, высокий заостренный зубец Р во II отведении. Неполный блок правой ветви пучка Гиса. Деформация QRS в правых грудных отведениях. Амплитуда зубца РII > 2 мм; 100R/R+S в II > 20; Нарушения реполяризации: сегмент SТ выше изолинии, косовосходящий в I, II, V5, V6 отведениях.
При проведении допплер-ЭхоКГ выявлена умеренная дилатация правых камер (диаметр левого желудочка в диастолу — 25,1 мм, диаметр левого желудочка в систолу — 15,2 мм, диаметр правого желудочка — 16,8 мм), легочная гипертензия I степени (Dр на клапанах легочной артерии 7,8 мм рт.ст., среднее давление в легочной артерии — 37 мм рт.ст.), диастолическая дисфункция левого желудочка (Vе — 0,71 м/с, Vа — 0,74 м/с, Vе/Vа — 2,14, IVRT — 0,051 с, ATе — 0,095 с, DTе — 0,119 с).
Лечение. Ребенку был назначен постельный режим. Смесь «Хумана» по 120,0 мл каждые 4 часа, овощное пюре 170,0 мл, гречневая/рисовая каша 150,0 мл, отварное мясо 40,0–50,0 г, творог 40,0 г, фруктовое пюре 80,0 г. Медикаментозное лечение: с учетом выделенной флоры и ее чувствительности антибактериальная терапия (цефуроксим 100 мг/кг/сут в/в в течение 7 суток), короткий курс парентеральных глюкокортикостероидов (дексаметазон 2 мг/кг/сут в/в в течение 5 суток), с целью улучшения дренажной функции муколван 1 мг/кг/сут в/в в течение 5 суток, затем амброксол перорально, вентолин 100 мкг 4 раза в сутки, ингаляционно, ингаляционные стероиды (фликсотид 100 мкг/кг/сут), силденафил (виагра) 2 мг/кг/сут, метаболические препараты (кудесан 8 кап. 1 раз в день). Массаж грудной клетки, ЛФК. На фоне лечения состояние ребенка улучшилось, одышки нет, хрипы не выслушивались. Рекомендовано контрольное обследование через 2 месяца, при котором отмечена положительная динамика в виде снижения давления в легочной артерии до 26 мм рт.ст., в связи с чем доза силденафила была уменьшена до 1 мг/кг/сут. Через 1 месяц среднее давление в легочной артерии — 24 мм рт.ст., что дало основание отменить силденафил.
Выводы
1. Факторами риска развития бронхолегочной дисплазии являются недоношенность (выявлена у 91 %), малая масса тела при рождении (94,5 %), респираторный дистресс-синдром новорожденных (90,7 %), врожденная пневмония (95,3 %), ИВЛ в неонатальном периоде, хронические заболевания легких в семейном анамнезе.
2. Высокоразрешающая компьютерная томография легких у детей с БЛД позволяет достоверно установить степень поражения бронхов и паренхимы легких, локализацию и морфологию эмфиземы легких, характер поражения плевры.
3. У 75 % детей с бронхолегочной дисплазией выявлено повышение уровня среднего давления в легочной артерии, у 67,3 % детей имела место диастолическая дисфункция левого желудочка, что может свидетельствовать о ремоделировании левого желудочка и является предиктором формирования кардиоваскулярных осложнений.
4. Назначение ингибитора фосфодиэстеразы-5 — силденафила — в комплекс лечебных мероприятий при легочной гипертензии на фоне бронхолегочной дисплазии приводило к достоверному снижению уровня среднего давления в легочной артерии у 80 % детей (32 ± 6 мм рт.ст. до лечения; 24 ± 3 мм рт.ст. после лечения (p < 0,01)).
Практические рекомендации
1. Дети грудного и раннего возраста с бронхолегочной дисплазией после выписки со II этапа выхаживания нуждаются в комплексном обследовании, включающем обязательное проведение допплерэхокардиографии с определением морфофункционального состояния миокарда и уровня среднего давления в легочной артерии.
2. Для установления степени поражения бронхов и легочной паренхимы необходимо проведение высокоразрешающей компьютерной томографии органов грудной клетки.
3. В комплексном лечении легочной гипертензии на фоне бронхолегочной дисплазии целесообразно назначение ингибитора фосфодиэстеразы-5 силденафила в дозе 1–2 мг/кг/сут с возможной коррекцией суточной дозы в зависимости от уровня давления в легочной артерии.
Перспективы развития. По данным литературы, снижают частоту развития БЛД: раннее профилактическое введение сурфактанта, высокочастотная струйная вентиляция, постоянное положительное давление в дыхательных путях через носовые катетеры (NCPAP), кофеин, системные стероиды, витамин А. Продолжаются рандомизированные контролируемые исследования по поводу применения высокочастотной осцилаторной вентиляции, раннего назначения аминокислот, антибиотикотерапия колонизации U.urealyticum.
Список литературы находится в редакции