Журнал «Здоровье ребенка» 3 (30) 2011
Вернуться к номеру
Дисметаболические нефропатии в педиатрической практике Сообщение 2. Принципы лечения и профилактики
Авторы: Зубаренко А.В., Стоева Т.В. Одесский национальный медицинский университет
Рубрики: Педиатрия/Неонатология
Версия для печати
Одной из актуальных проблем современной нефрологии является проблема уролитиаза и дисметаболических нефропатий у детей. Лечение обменных нефропатий как полиэтиологических заболеваний должно быть комплексным: необходимо воздействовать и на причинный фактор, и на механизмы, способствующие литогенезу. В работе на основании анализа данных литературы и собственных наблюдений изложены современные дифференцированные подходы к терапии дисметаболических нефропатий с учетом предрасполагающих факторов, характера метаболических нарушений, длительности заболевания, функционального состояния нефрона и фоновой патологии.
Дисметаболические нефропатии, дети, терапия.
Многоуровневые патогенетические сдвиги, наблюдаемые при дисметаболических нефропатиях (ДМН), а также тяжесть вызываемых обменными нарушениями патологических состояний, таких как тубулоинтерстициальный нефрит, нефролитиаз, хроническая болезнь почек, определяют важность проблемы и необходимость использования эффективных методов лечения и профилактики.
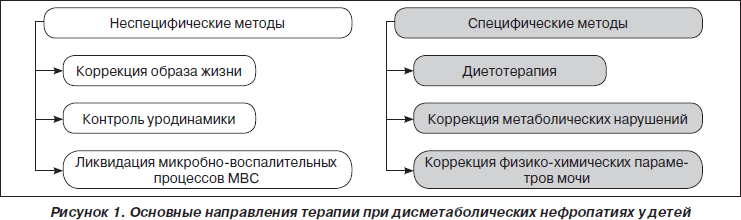
С учетом особенностей этиопатогенеза комплексное лечение при дисметаболических нефропатиях предполагает включение мероприятий неспецифического и специфического (с учетом вида метаболических нарушений) характера (рис. 1).
Неспецифические мероприятия, такие каккоррекция образа жизни, коррекция уродинамики, лечение и профилактика инфекции мочевыделительной системы, являются общими для разных видов нефропатий независимо от вида метаболических нарушений.
I. Коррекция образа жизни
Следует подчеркнуть, что гипокинезия (двигательный дефицит) является одним из факторов, влияющих на возникновение и прогрессирование дисметаболических нефропатий у детей. Основным патогенетическим моментом при гиподинамии является нарушение метаболических процессов в организме, что сопровождается образованием и накоплением литогенных веществ.
Низкая физическая активность у детей обычно связана с нерациональным распорядком дня ребенка, перегрузкой учебными занятиями. По данным различных исследований, современные дети мало бывают на свежем воздухе (до 1 часа), мало двигаются, проводят много времени перед компьютером и телевизором (от 3 до 6 часов).
Снижение физической активности оказывает общенегативное воздействие на растущий организм: приводит к снижению иммунитета, замедляет кишечную моторику, вызывает изменения метаболизма костной ткани, нарушение осанки. Указанные процессы имеют патогенетическую связь с метаболическими процессами в почках и также оказывают негативное влияние при дисметаболических нефропатиях.
Для коррекции гиподинамии рекомендуется использовать дозированную физическую нагрузку, пешие прогулки и утреннюю зарядку. Общая длительность ежедневных физических нагрузок должна составлять не менее 30 мин 5 раз в неделю.
Не менее важной особенностью жизни современного ребенка является наличие психоэмоционального перенапряжения. Стрессовые ситуации связаны с началом раннего обучения и его интенсификацией, необходимостью приспосабливаться к новой ситуации при поступлении в дошкольное учебное заведение или школу, постоянным ростом потока информации, высокой учебной нагрузкой. Симптомами психоэмоционального перенапряжения являются утомляемость, вялость, беспокойный сон или повышенная сонливость, головная боль, боль в животе, неустойчивое настроение, снижение аппетита. Эти же жалобы нередко отмечаются у детей с дисметаболическими нефропатиями. Говоря о связи стрессовых ситуаций и обменных нефропатий, следует также отметить, что при частых нервно-психических стрессах может развиваться уратурия за счет снижения уровня ферментов, расщепляющих пуриновые основания.
В связи с этим создание комфортной психоэмоциональной обстановки в семье, организация оптимального режима дня, достаточный по продолжительности сон, ограничение просмотра телепередач, снижение интенсивности учебной нагрузки, использование приемов психологической разгрузки, обязательное чередование физических нагрузок и релаксации способствуют снижению негативного влияния стресса на детский организм.
Приоритетную роль в возникновении метаболических расстройств играет нерациональное питание. Сегодня многие педиатры констатируют, что питание детей, особенно школьного возраста, чаще всего несбалансированное — как по основным пищевым нутриентам, так и по режиму приема пищи. На возникновение нефропатий оказывает влияние употребление питьевой воды с высоким содержанием различных солей, наличие в воде и продуктах питания компонентов минеральных удобрений. Наиболее характерной современной особенностью является питание out of home, это часто приводит к тому, что дети употребляют «взрослую» пищу, приготовленную по рецептуре, не отвечающей требованиям детской диететики. Питание детей часто оказывается однообразным, гиповитаминизированным. Дети школьного возраста отказываются от овощных и фруктовых блюд, отдают предпочтение питанию fast food, а в интервалах между приемами пищи злоупотребляют чипсами, солеными жареными орехами, солеными сухариками с вкусовыми добавками.
Необходимо подчеркнуть, что у большинства школьников наблюдается неадекватный, нерегулярный питьевой режим, при этом в качестве питья часто используются искусственные напитки с высоким содержанием углеводов.
Приведенные факторы в значительной мере влияют на метаболические процессы в растущем организме, оказывают повреждающее влияние на структурные элементы нефрона. Приучение детей к здоровому питанию, смена диетических приоритетов в семье, особенно с учетом того, что в большинстве случаев дисметаболизм носит семейный характер, организация сбалансированного пищевого рациона являются важными компонентами поддержания здорового образа жизни ребенка.
Таким образом, коррекция образа жизни складывается из оптимизации физической активности, организации правильного режима дня и рационального адекватного питания ребенка.
II. Контроль процессов уродинамики
Существенную роль в развитии дисметаболической нефропатии, а также ее дальнейшей трансформации в мочекаменную болезнь играет нарушение уродинамики. Уростаз приводит к нарушению транспорта литогенных веществ как на уровне тубулярных отделов нефрона, так и мочевыделительной системы в целом.
Причинами уростаза у детей могут быть функциональные и органические изменения: дискинезия мочевыводящих путей, нейрогенные расстройства мочеиспускания, врожденные аномалии развития мочевой системы и др. Важным моментом в развитии уродинамических расстройств является отсутствие у детей навыков регулярного мочеиспускания. Так, при анкетировании детей младшего школьного возраста с дисметаболическими нефропатиями выявлено, что 2/3 из них не соблюдают режим своевременных мочеиспусканий, а интервал между мочеиспусканиями превышает 3,5–5,5 часа.
С учетом того, что уростаз является универсальным местным условием для кристаллизации мочевых солей даже при отсутствии повышенной концентрации мочевых солей в моче, необходимость контроля уродинамики при дисметаболических нефропатиях не вызывает сомнений.
Коррекция уродинамических нарушений у детей с дисметаболическими нефропатиями предусматривает:
— соблюдение режима регулярных и своевременных мочеиспусканий;
— активный двигательный режим (прогулки, утренняя гимнастика, плавание);
— восстановление мышечного тонуса мочевых путей с помощью упражнений ЛФК, направленных на укрепление мышц брюшного пресса и тазового дна;
— применение аппаратной физиотерапии (электростимуляция, амплипульс-терапия, динамическая нейроэлектростимуляция — ДЭНС), рефлексотерапии с использованием биологически активных точек меридианов: мочевого пузыря (V23, V60, V31, V40), почек (R2, R3, R7), желудка (Е36), селезенки (RP6), переднего серединного меридиана (J3, J4);
— своевременное выявление и лечение нейрогенных дисфункций мочевого пузыря.
III. Лечение и профилактика инфекции мочевыделительной системы
Инфекция мочевой системы часто сопутствует дисметаболическим нефропатиям. При этом наличие мочевой инфекции может как выступать фактором кристаллообразования (уреазная активность некоторых микроорганизмов приводит к повышению рН мочи, что способствует снижению растворимости и выпадению кристаллов солей, преимущественно фосфатов), так и являться его следствием (вторичный пиелонефрит на фоне дисметаболической нефропатии, когда микробно-воспалительный процесс служит дополнительным патогенетическим фактором литогенеза, чаще при оксалатных и мочекислых обменных нарушениях).
Несмотря на сложность взаимодействия микроорганизмов и метаболических нарушений, роль мочевой инфекции в процессах кристалло- и камнеобразования не вызывает сомнения. Это обусловливает необходимость проведения у детей с дисметаболическими нефропатиями бактериологического исследования мочи и назначения соответствующей антибактериальной терапии.
Учитывая то, что микробно-воспалительный процесс при дисметаболических нефропатиях может принимать рецидивирующий характер, для профилактики рекомендуется проводить курсы противорецидивной антимикробной терапии с помощью уросептиков и фитоуросептиков.
В качестве фитотерапии используются сборы, оказывающие антисептическое, мочегонное и кристаллолитическое действие, в состав которых могут входить хвощ полевой, толокнянка, брусника, петрушка, можжевельник, листья березы. В ряде работ показана высокая эффективность комплексного фитонирингового препарата канефрон в лечении и профилактике микробно-воспалительных и дисметаболических процессов мочевыделительной системы.
Мероприятия специфического характера имеют существенное значение при дисметаболических нефропатиях, проводятся дифференцированно с учетом вида метаболических нарушений и включают диетотерапию, коррекцию метаболических нарушений и коррекцию физико-химических параметров мочи.
I. Диетотерапия
Характер питания и питьевой режим являются важными факторами реализации дисметаболических нефропатий. С учетом роли характера питания для коррекции биохимических сдвигов в зависимости от типа обменных нарушений используются дифференцированные диеты.
Однако сегодня многие исследователи говорят о нецелесообразности строгих диетических ограничений по ряду причин. Во-первых, обменные нарушения долговременны, и соответственно, длительность диеты пролонгирована, а полное исключение некоторых пищевых ингредиентов не всегда благоприятно сказывается на развитии растущего организма. Во-вторых, рекомендации, выдаваемые пациентам и их родителям в отношении диеты с исключением широкого круга продуктов, иногда сложновыполнимы и могут приводить к снижению комплайентности. В-третьих, ограничения разного рода не всегда благоприятно влияют на психологическое состояние ребенка.
В связи с этим основной рекомендацией при дисметаболических нефропатиях является создание рационального полноценного разнообразного питания с учетом возрастных потребностей растущего организма, особенностей нарушенного обмена и исключением функциональной нагрузки на тубулярный аппарат. При составлении диетических программ следует прежде всего обращать внимание на содержание в продуктах питания метаболитов литогенных веществ.
Для оксалатной нефропатии важен учет содержания щавелевой кислоты в продуктах питания (табл. 1).
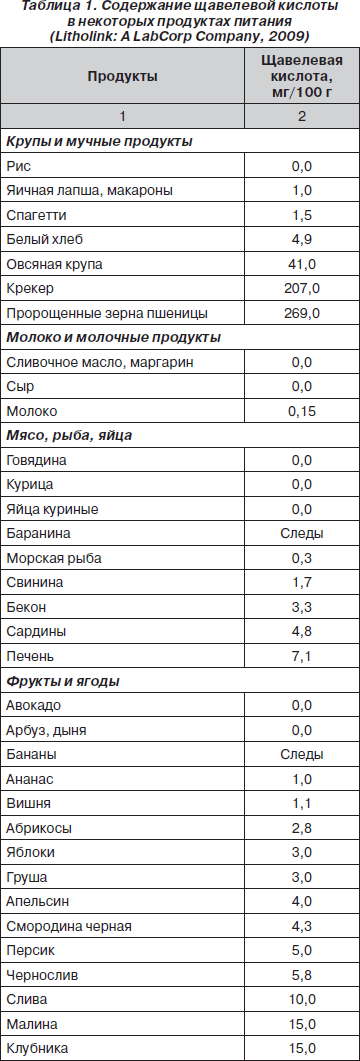
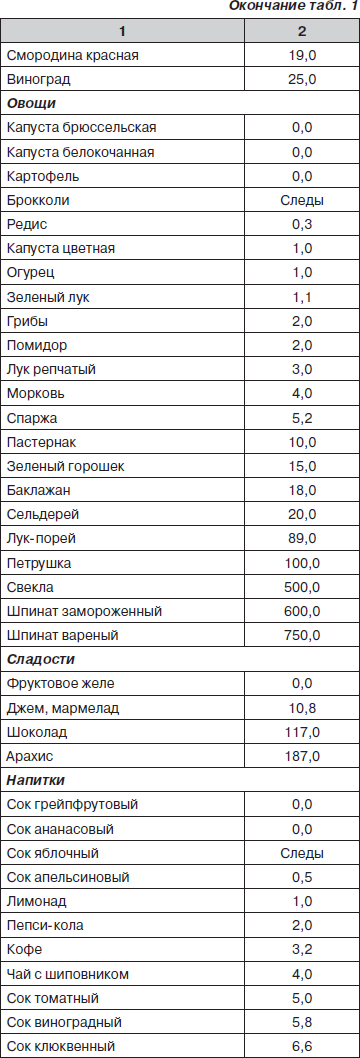
При построении рациона питания ребенка с дисметаболической нефропатией необходимо исключить продукты, содержащие более 50 мг оксалата в 100 г, и ограничить продукты с содержанием щавелевой кислоты от 5 до 50 мг в 100 г.
Количество продуктов, подлежащих полному исключению (более 50 мг щавелевой кислоты) из рациона, на самом деле не так велико. Кроме того, следует отметить, что способность богатых оксалатами продуктов усиливать экскрецию оксалатов зависит не только от их содержания, но и от биодоступности, растворимости и формы, в которой существуют их соли. Так, считается, что только шпинат и ревень представляют риск как пищевые продукты, так как содержат большое количество биодоступных оксалатов.
Общие диетические рекомендации при оксалурии соответствуют лечебной диете № 5. С учетом возможной сопутствующей аллергопатологии при оксалурических нефропатиях следует исключать облигатные пищевые аллергены. Традиционное назначение при оксалурии капустно-картофельной диеты обосновано низким содержанием щавелевой кислоты в этих продуктах. Кроме того, значительное количество кальция в картофеле удерживает оксалаты в нерастворенном состоянии и способствует полному выведению оксалатов с калом.
Ввиду того, что при оксалурии отмечается снижение в кишечнике специфической микрофлоры Oxalobacterpylory, важным преимуществом капустной клетчатки является ее нормализующее действие на жизнедеятельность кишечной микрофлоры, а также достаточно выраженное стимулирующее действие на двигательную функцию кишечника.
Следует также отметить, что снижению оксалурии способствует употребление кальция. В исследовании B. Hess et al. (2008) было доказано, что у здоровых субъектов гипероксалурия, вызванная 20-кратным повышением оксалатной нагрузки, может быть полностью предотвращена приемом высоких, около 4 г/сутки, доз кальция.
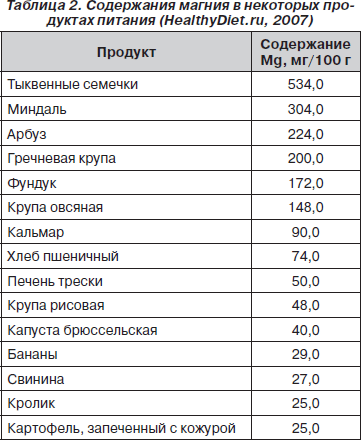
В ряде работ показано положительное влияние диеты, обогащенной магнием, при уролитиазе с оксалурией и при смешанных оксалатно-уратных камнях, в связи с чем диета при дисметаболической нефропатии должна включать богатые магнием продукты (табл. 2).
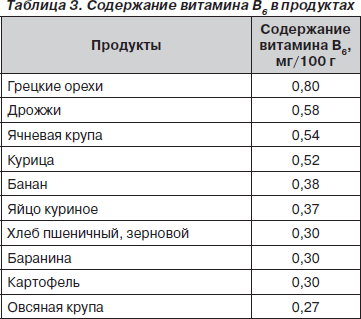
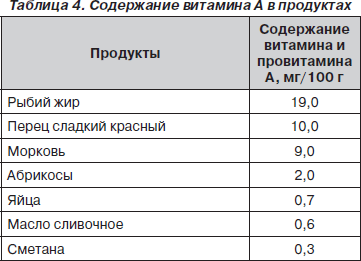
В рационе необходимо увеличивать содержание витаминов, особенно В6, нормализующего обмен щавелевой кислоты, и витамина А, положительно влияющего на слизистые оболочки мочевых путей (табл. 3, 4).
В связи с тем, что образование щавелевой кислоты в организме повышается при избыточном потреблении витамина С, суточное поступление его за счет пищевых продуктов и препаратов не должно превышать 150–200 мг.
Для уратной нефропатии характерно накопление и избыточное выведение мочевой кислоты эндогенной и экзогенной природы и ее солей — уратов.
В результате обмена нуклеопротеидов в организме происходит эндогенное образование мочевой кислоты. В то же время употребление с пищей большого количества нуклеопротеидов может вызвать повышенную экскрецию с мочой мочевой кислоты экзогенного происхождения. Ввиду этого при построении диеты при уратной дисметаболической нефропатии надо ограничивать потребление продуктов, содержащих пурины (табл. 5).
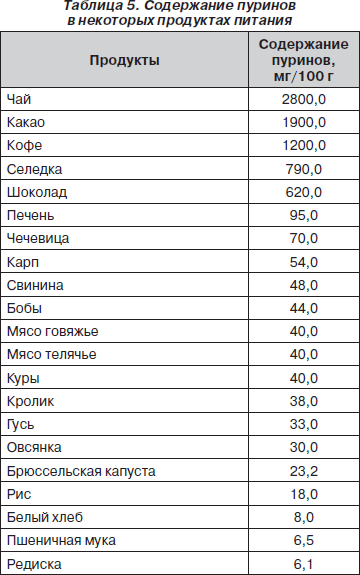
Общие рекомендации по питанию в случае уратной дисметаболической нефропатии соответствуют лечебной диете № 6. Необходимо подчеркнуть, что при составлении меню для ребенка с уратной дисметаболической нефропатией не следует превышать белковую компоненту пищевого рациона, т.к. эндогенное выделение мочевой кислоты максимально в условиях белкового питания. Животные белки необходимо употреблять в первой половине дня, до 16 часов, из расчета 100–150 г/сутки не чаще 3 раз в неделю. Не рекомендуется употребление копченых и жареных мясных продуктов, которые по содержанию пуринов и их абсорбции в кишечнике превосходят отварное мясо. Отварные мясопродукты при кулинарной обработке теряют 50 % пуринов, и поэтому их употребление предпочтительно. В то же время высокое содержание пуриновых компонентов в мясных и рыбных бульонах объясняет необходимость их исключения из рациона. Также полностью исключаются колбасы, субпродукты, фаршевые мясопродукты, холодец, консервы, мясо молодых животных (цыплята, телятина).
Пищевой рацион ребенка с уратной нефропатией должен содержать овощи и фрукты. Урикозурическое действие оказывают яблоки, груши, сливы, виноград, цитрусовые. Из овощей следует рекомендовать картофель, белокочанную капусту, свеклу, морковь, кабачки, огурцы. Овощную и фруктовую диету целесообразно чередовать с молочнокислой диетой. Также показаны продукты, содержащие витамины А, В6.
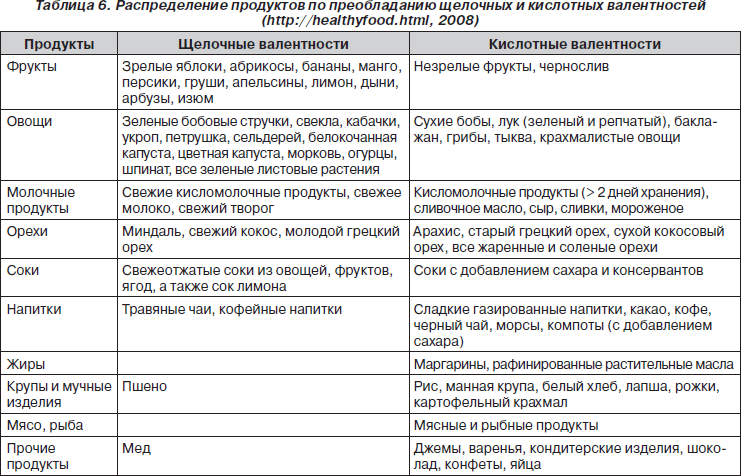
При фосфатной дисметаболической нефропатии основными диетическими направлениями являются применение продуктов с преобладанием кислотных валентностей (табл. 6) и ограничение продуктов, богатых кальцием. Общие диетические рекомендации в случае фосфатной дисметаболической нефропатии соответствуют лечебному столу № 14.
Больным при фосфатной дисметаболической нефропатии не показаны лимоны, грейпфруты, арбузы, подлежит ограничению употребление слив, крыжовника, груш, томатов, свеклы, шпината. Также следует ограничить в питании магнийсодержащие продукты (табл. 2). Рекомендуется соблюдать дробный режим питания — 5–6 раз в сутки. В случае сопутствующей гиперсекреции желудочного сока необходимо исключить из диеты острые закуски, пряности, являющиеся активаторами секреторной функции желудка.
С целью ограничения кальция в рационе уменьшают употребление молочных продуктов. Следует помнить, что длительное ограничение в рационе продуктов, содержащих кальций, негативно влияет на обмен веществ, поэтому на фоне основной диеты могут использоваться так называемые периодические зигзаги с включением продуктов, богатых кальцием.
В рационе увеличивают употребление продуктов, содержащих витамин А, каротины.
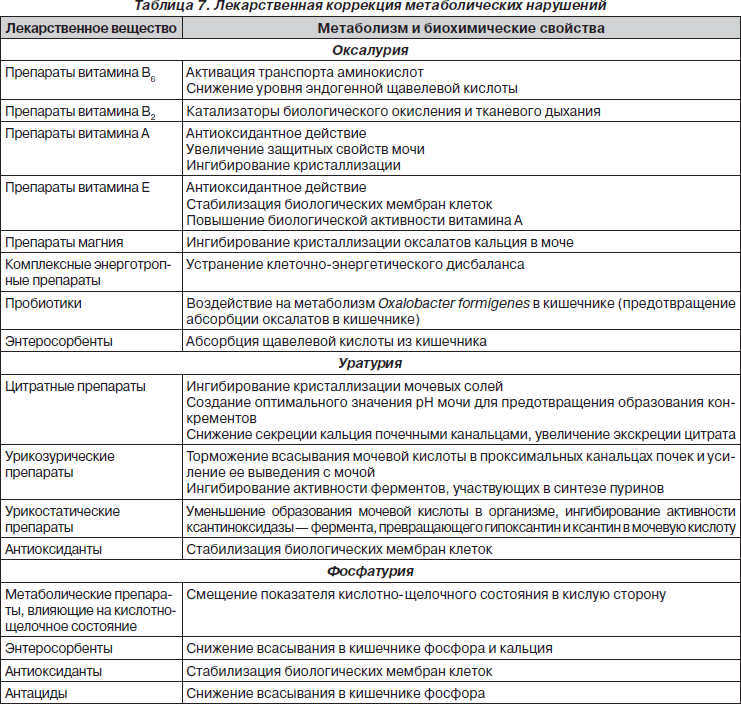
II. Медикаментозная коррекция метаболических нарушений
Применение медикаментозной коррекции при ДМН проводится с целью воздействия на обменные процессы и призвано снижать концентрацию литогенных веществ в сыворотке крови и моче.
Следует отметить, что залогом эффективности терапии при ДМН является не только устранение дисметаболических нарушений, но и длительная поддерживающая коррекция с целью предотвращения рецидивов и трансформации в нефролитиаз.
В качестве альтернативной длительной коррекции метаболических процессов дифференцированно с учетом обменных нарушений применяют следующие гомеопатические средства: Calcium carbonicum, Acidum oxalicum, Lycopodium clavatum, Berberis vulgaris, Causticum, Sepia officinalis, Coccus cacti, а также комплексные препараты: ренель, хепель, солидаго композитум С, коэнзим композитум, убихинон композитум, мукоза композитум, реструкта про инъекционе С и др.
III. Коррекция физико-химических параметров мочи
Коррекция физико-химических свойств мочи направлена на угнетение процессов кристаллизации литогенных веществ. При этом важное значение уделяется регуляции баланса ингибиторов и промоторов кристаллообразования.
Основными компонентами в регуляции параметров мочи при дисметаболических нефропатиях являются кристаллолитики, фитолитики и контроль кислотно-основного состояния (табл. 8).
В заключение необходимо отметить, что комплексная этиопатогенетически обусловленная коррекция метаболических нарушений при дисметаболических нефропатиях у детей не только способствует восстановлению обменных процессов, но и позволяет предотвратить развитие и прогрессирование хронической болезни почек.
1. Багдасарова І.В., Фоміна С.П., Желтовська Н.І., Лавренчук О.В. Дисметаболічні нефропатії у дітей // Современная педиатрия. — 2008. — № 3 (20). — С. 62-67.
2. Дисметаболическая нефропатия, мочекаменная болезнь и нефрокальциноз у детей / В.В. Длин, И.М. Османов, Э.А. Юрьева, П.В. Новиков. — М.: Оверлей, 2005. — 232 с.
3. Иванов Д.Д., Вакуленко Л.И. Применение фитотерапевтических препаратов в детской нефрологии // Medical nature. — 2010. — № 2. — С. 36-37.
4. Игнатова М.С., Коровина Н.А. Диагностика и лечение нефропатий у детей. — М.: ГЭОТАР-Медиа, 2007. — 336 с.
5. Малкоч А.В., Гаврилова В.А. Дисметаболические нефропатии у детей // Лечащий врач. — 2006. — № 1. — С. 32-36.
6. Мирошников В.М. Лекарственные растения и препараты растительного происхождения в урологии. — М.: МЕДпресс-информ, 2005. — 40 с.
7. Мойсеєнко В.О., Рудюк Л.І. Кристалурії: лікування і профілактика // Биологическая терапия. — 2008. — № 1. — С. 55-56.
8. Ларина Т.А., Кузнецова Т.А., Цыгин А.Н. и др. Распространенность гиперкальциурии по результатам скринингового обследования детей региона с высокой частотой мочекаменной болезни // Российский педиатрический журнал. — 2007. — № 3. — С. 41-43.
9. Щевелев Т.С. Лечение мочекаменной болезни и дисметаболических нефропатий у детей и у взрослых с применением нутрицевтиков // Международная научно-практическая конференция. — М. — К., 2003. — С. 269-288.
10. Johri N., Cooper B., Robertson W. et al. An Update and Practical Guide to Renal Stone Management // Nephron Clin. Pract. — 2010. —Vol. 116, № 3. — P. 159-171.
11. Bernd Hoppe Markus J. Kemper. Diagnostic examination of the child with urolithiasis or nephrocalcinosis // Pediatr. Nephrol. — 2010. — Vol. 25 (3). — P. 403-413.
12. Mohsen Akhavan Sepahi, Akram Heidari, Ahmad Shajari. Clinical Manifestations and Etiology of Renal Stones in Children Less than 14 years age // Saudi J. Kidney Dis. Transpl. — 2010. — Vol. 21 (1). — P. 181-184.
13. Hakan Hasbey Koyuncu, Faruk Yencilek, Bilal Eryildirim, Kemal Saric. Family history in stone disease: how important is it for the onset of the disease and the incidence of recurrence? // Urol. Res. — 2010. — Vol. 38. — P. 105-109.
14. Hoppe B., Leumann E. Diagnostic and therapeutic strategies in hyperoxaluria: a plea for early intervention // Nephrol. Dial. Transplant. — 2004. — Vol. 19. — P. 39-42.
15. Andrew D. Rule, Veronique L. Roger, L. Joseph Melton et al. Kidney Stones Associate with Increased Risk for Myocardial Infarction // J. Am. Soc. Neprol. — 2010. — Vol. 21. — P. 1-4.
16. Naseri M., Varasteh A.R., Alamdaran S.A. Metabolic Factors Associated With Urinary Calculi in Children // Iranian Journal of Kidney Diseases. — 2010. — Vol. 4 (1). — P. 32-38.
17. Obligado S.H., Goldfarb D.S. The association of nephrolithiasis with hypertension and obesity: a review // Am. J. Hypertens. — 2008. — Vol. 21. — P. 257-264.
18. Lahme S., Feil G., Strohmaier W. L. et al. Renal Tubular Alteration by Crystalluria in Stone Disease — An Experimental Study by Means of MDCK Cells // Urologia International. — 2004. — Vol. 72, № 3. — P. 244-251.
19. Sayer John A. Renal Stone Disease // Nephron Physiolology. — 2010. —Vol. 118, № 1. — P. 35-44.
20. Patricia C.G. Damasio, Carmen R.P. Amaro, Silvia J.P. Berto et al. Urinary Lithiasis and Idiopathic Hypercalciuria: The Importance of Dietary Intake Evaluation // International Braz. J. Urol. — 2010. — Vol. 36 (5). — P. 557-562.