Журнал «Здоровье ребенка» 3 (30) 2011
Вернуться к номеру
Синдром циклічної блювоти у дітей. Сучасні погляди і останні рекомендації щодо ведення хворих. Частина 1
Авторы: Пипа Л.В., Свістільнік Р.В., Леньга В.Р., Свістільнік Т.В., Поліщук В.А. Вінницький національний медичний університет ім. М.І. Пирогова Хмельницька міська інфекційна лікарня Старокостянтинівська ЦРЛ, Хмельницька область
Рубрики: Педиатрия/Неонатология
Версия для печати
Проведений аналітичний огляд світової літератури, у якому висвітлено етіологію, сучасні погляди на патогенез, клініку, діагностичні критерії, диференціальну діагностику синдрому циклічної блювоти (СЦБ). Розглянуті ключові рекомендації з ведення, лікування і профілактики СЦБ у дітей.
СЦБ, діагностика, патогенез, ведення хворих.
В іноземній літературі синдром циклічної блювоти (СЦБ) (Сyclic Vomiting Syndrome) фігурує під різними назвами і визначається як «синдром циклічного блювання», «періодичний синдром», «ацетонемічна блювота», «автономна епілепсія», «черевна епілепсія», «конвульсивний еквівалент» і «мігрень, що супроводжується нудотою і блюванням»[10].
За визначенням консенсусних рекомендацій Північноамериканської асоціації дитячої гастроентерології, гепатології і харчування СЦБ, це порушення, що характеризується дискретними, самообмежуючими епізодами блювоти й визначається відповідно до критеріїв, які базуються на клінічних симптомах і відсутності позитивних лабораторних, рентгенологічних і ендоскопічних змін [24].
Блювота часто самообмежується та зникає спонтанно, але тяжкі тривалі напади можуть призводити до дегідратації, порушення електролітного балансу й розвитку відповідних ускладнень [21].
СЦБ уперше був описаний доктором W. Heberden у французькій літературі в 1806 році, а пізніше у 1882 році в англійській літературі педіатром Samuel Ge [7]. Саму назву СЦБ отримав від P.S. Smith у 1937 році [41].
Деякі вітчизняні автори вважають, що СЦБ і ацетонемічний синдром (який лише визнаний і фігурує у вітчизняній літературі і не зустрічається в іноземній літературі) є рівнозначними. Дійсно, за клінічними проявами й патогенезом СЦБ й ацетонемічний синдром досить подібні. Деякі зарубіжні автори відмічають, що СЦБ практично завжди супроводжується кетозом [4, 10, 24]. Втім, це твердження потребує подальших досліджень, які ще не проводились, і в майбутньому можливе об’єднання цих нозологічних одиниць, що вирішить багато суперечок і внесе ясність у походження цих синдромів.
Більшість дослідників вважають, що СЦБ є варіантом мігрені [15]. Асоціація СЦБ із мігренню була відмічена вже в 1898 році Whitney і в 1904 році Rachford [34]. Подібність між цими синдромами прослідковується на загальних клінічних проявах у вигляді епізодичності, стереотипності симптомів, появою вранці або вночі, провокування напругою або хвилюванням і частим сімейним анамнезом СЦБ і мігрені [29].
Крім того, звертає на себе увагу значна ефективність у лікуванні СЦБ та його профілактики специфічних антимігренозних засобів. У дослідженнях J.M. Andersen et al. (1997) амітриптилін і ципрогептадин, що використовуються для профілактики мігрені, показали значну ефективність у профілактиці СЦБ у дітей. За даними Lі Bu et al. (2003), парентеральне введення антагоністу серотоніну ондансентрону зменшувало тривалість нападу більше ніж на 50 %. Призначення антимігренозного засобу суматриптану в більшості випадків припиняло розвиток СЦБ [33].
СЦБ є можливим джерелом розвитку ускладнень: 50 % дітей потребують внутрішньовенної регідратації. Крім того, діти з СЦБ відсутні в школі протягом щонайменше 20 днів щорічно, а середня вартість перебування в реанімаційних відділеннях, лікарнях, проведення діагностичних тестів (біохімічних, рентгенологічних, ендоскопічних), пропущення роботи батьками призводить до витрат більше ніж 17 000 доларів щорічно на одну дитину з СЦБ у США [20].
Епідеміологія
СЦБ був описаний у всіх расах і етносах, але в людей білої раси СЦБ зустрічається значно частіше [7]. Це порушення переважно спостерігається у дітей і починається в середньому у 5-річному віці, хоча повідомлялися випадки СЦБ з початком на 6-й день життя і в 73 роки [17]. Поширеність СЦБ у дітей знаходиться в діапазоні 0,3–2,2 % [2, 14] з перевагою дівчаток над хлопчиками (60 : 40) [24].
Етіологія
Загальні фактори
Пацієнти можуть ідентифікувати пускові механізми СЦБ у 68 % [20]. Тригерні механізми поділяються на психологічні, інфекційні й фізичні. Емоційна напруга (пов’язана зі шкільними екзаменами, сімейним конфліктом, днем народження) та інфекція — одні з найбільш поширених тригерних механізмів розвитку СЦБ (44 і 31 % відповідно). Цікаво, що дві третини емоційної напруги має позитивне забарвлення. Різноманітні інфекції можуть викликати епізоди блювоти, особливо хронічний синусит. Інші тригерні механізми включають дієтичні фактори, особливо сир, шоколад і продукти, що містять глутамат натрію (20–23 %), фізичне виснаження, порушення сну і втомлюваність (24 %), алергію (10–15 %), морську хворобу (10 %), травму і менструальні кровотечі (15 %) — менструальний СЦБ [17, 41].
Велика частина дітей (32 %) мають сезонність розвитку епізодів СЦБ зі значним переважанням протягом зими і значно меншим улітку. Це корелює з періодом навчання, а влітку з відсутністю шкільної напруги й меншою кількістю епізодів інфекції. Зимові канікули, включаючи свята, такі як Різдво і Новий рік, можуть слугувати збуджуючими пусковими факторами для деяких дітей [27, 28].
Провокуючі фактори СЦБ [27]:
1. Стрес:
а) фізичний: інфекція, депривація сну, травма, виснаження;
б) емоційний: канікули, день народження, перебування в шкільному таборі, екзамени, сімейні конфлікти, тривога.
2. Менструальна кровотеча.
3. Вагітність.
4. Харчова алергія.
Генетика СЦБ
Існує генетична спільність СЦБ й мігрені, що підтверджується сімейними випадками мігрені у 82 % хворих СЦБ [2]. Значення генетичного фактора в механізмі розвитку СЦБ було підтверджено з успадкуванням по материнській лінії мітохондріальної ДНК. Виявлено, що СЦБ проявляється значно раніше й має більш тяжкий перебіг у хворих на нейром’язові захворювання [4, 23].
Психічні фактори
Дослідження підлітків із СЦБ виявило, що 47 % із них мають високий ризик розвитку психічних порушень. Чи відіграє депресія роль у можливій схильності до СЦБ, на теперішній час невідомо [36].
Патогенез
Патогенез СЦБ залишається невідомим, хоча існує сильний зв’язок між СЦБ і мігренню, заснований на подібності симптомів, тригерних факторів, високої сімейної поширеності мігрені у хворих на СЦБ і ефективності протимігренозних засобів у лікуванні й профілактиці СЦБ. Постуловані патогенетичні механізми включають епізодичну вегетативну дизавтономію, мутації мітохондріальної ДНК й дефіцит утворення клітинної енергії, нейроендокринні причини з посиленою реакцією гіпоталамусу, що активує блювотну реакцію [15, 24, 35]. Потенційна кореляція між СЦБ і мігренню була постулована в 1904 році, цю думку підтримують і сучасні вчені [15].
Існує гіпотеза, що СЦБ може бути більш ранньою фазою мігрені і може в подальшому прогресувати до мігрені [19], а в деяких випадках може вважатися і варіантом мігрені [30].
Мітохондріальна дисфункція
Мітохондріальна дисфункція вірогідно виступає фактором у патогенезі СЦБ і мігрені і пов’язана з мітохондріальною ДНК (mtDNA), що успадковується лише по материнській лінії, свідченням чого є переважання хворих на мігрень і СЦБ в осіб жіночої статі [22, 39]. Крім того, сильні асоціації з поліморфізмом 16519T і 3010A mtDNA були відмічені у дітей молодше 12 років [3]. R.G. Boles et al. (1999) продемонстрували, що серед дітей із СЦБ і нервово-м’язовими захворюваннями 86 % мають мігрень по материнській лінії [4].
Підвищення сечової кислоти, лактату й порушення обміну органічних кислот було виявлено під час епізодів СЦБ. Подібні зміни виявляються у хворих із відомими мітохондріальними захворюваннями [4].
Лікування внутрішньовенною декстрозою протягом нападів, щоденне призначення L-карнітину й попередження голодування полегшує симптоми у багатьох хворих на СЦБ і вказує на очевидну основу мітохондріальної дисфункції під час епізодів СЦБ навіть у хворих без виявлених мутацій mtDNA [34].
Автономна дисфункція
Гарячка, в’ялість, блідість, слинотеча, понос, порушення моторики кишечника, які зустрічається протягом епізоду СЦБ, обумовлені порушенням автономної вегетативної регуляції [34].
T.C. Chelminsky et al. (2007) визначали симпатичну автономну дисфункцію у хворих на СЦБ через ортостатичну пробу й виявили синдром ортостатичної тахікардії та патологічні судомоторні реакції подібних, як при автономних невропатіях [5].
Дослідження вегетативної регуляції J. To et al. (1998) проводили за допомогою варіабельності частоти серцевих скорочень під час реєстрації ЕКГ у хворих на СЦБ. Було виявлено вірогідно більш високий симпатичний тонус і вірогідно низький парасимпатичний тонус вегетативної нервової системи, що вказує на недостатність парасимпатичного відділу й гіперактивацію симпатичного відділу нервової системи в міжнападний період порівняно з контрольною групою [38]. Порушення шлунково-кишкової моторики за типом гіперкінезії, гіпокінезії із залученням тонкої кишки були наявні навіть протягом безсимптомних періодів у хворих із СЦБ, що могло говорити про порушення автономної вегетативної регуляції травлення [7].
Нейроендокринна дисфункція
Первинна функція кортикотропін-рилізинг-фактора — збудження передньої частки гіпофізу з наступною секрецією адренокортикотропного гормону (АКТГ), який активує гіпоталамо-гіпофізарно-адреналову систему (ГГАС). Активацію ГГАС при СЦБ було вперше описано S.M. Wolfe, R.A. Adler і T. Sato в 1964 році, а T. Sato і співавтори у 1982 році описали підвищення рівня АКТГ, вазопресину, кортизолу, простагландину Е2 і продуктів катехоламінів у сечі під час нападу СЦБ. Призначення при СЦБ клонідину — агоністу центральних адренорецепторів T. Sato і співавторами і дексаметазону S.M. Wolfe і R. Adler переривало активацію ГГАС, що збігалося зі скороченням нападу СЦБ [34].
Вірогідно підвищена секреція АКТГ у відповідь на стресорний фактор активує норадренергічний центр головного мозку — блакитну пляму (locus ceruleus), яка, у свою чергу, активує адренергічну трансмісію і тим самим збуджує гальмівні рухові нервові клітини в дорсальному моторному ядрі блукаючого нерва, викликаючи затримку шлункової секреції, моторну активність шлунка і появу нудоти. Крім того, активація locus ceruleus призводить до збільшення симпатичної активації і виникнення таких симптомів епізоду СЦБ як блідість, гарячка, летаргія, понос. Основна секреція АКТГ відбувається в певному ритмі зі збільшенням секреції о 1.00 год ночі, досягаючи піку о 6.00 год ранку. Це може пояснювати переважання початку епізоду СЦБ вночі або вранці. Таким чином, гіпоталамічна секреція кортикотропін-рилізинг-фактора може діяти як нейроендокринний пусковий механізм блювоти [31, 35].
Дослідження ролі кортикотропін-рилізинг-фактора при СЦБ не тільки можуть пояснити патофізіологічний каскад СЦБ, але й можуть відкрити потенційні терапевтичні впливи з використанням антагоністів кортикотропін-рилізинг-фактора. Слід відзначити, що трициклічні антидепресанти пригнічують промоторну активність гену кортикотропін-рилізинг-фактора і є одними з ефективних профілактичних засобів лікування СЦБ [32].
Інші причини
Психологічний профіль дітей із СЦБ характеризується схильністю до розвитку тривожних станів. Було запідозрено відносну роль серотоніну в розвитку функціональних шлунково-кишкових порушень, але вона ще не підтверджена у хворих на СЦБ [14].
Існують також твердження, що в основі СЦБ може лежати посилена нейронна збудливість через надмірну мембранну іонну проникність (каналопатії) [17].
Цікаве дослідження проведено S. Lucarelli et al. (2000), у якому було встановлено роль харчової алергії в розвитку СЦБ. Шкірні проби і наявність IgE були позитивними для білків коров’ячого молока, яєчного білка і сої. Обмеження відповідної їжі в цих дітей, які видужали після елімінаційної дієти, протягом 6 місяців спостереження показало задовільне самопочуття пацієнтів [8].
Клініка
Найбільш часто епізод СЦБ у всіх вікових групах починається вночі або вранці з 1.00 до 7.00 [18], у середньому о 3.00–4.00, і часто провокується психологічною і фізичною напругою [24]. Частота епізодів СЦБ коливається в межах від 1 до 70 щорічно, у середньому до 12 епізодів на рік [30]. Хворі діти можуть блювати до 12 разів на годину, а симптоми можуть тривати протягом багатьох діб. Блювота типово супроводжується болем у животі (80 %), нудотою (72 %), анорексією (74 %), блідістю (87 %), летаргією (91 %). СЦБ можуть супроводжувати симптоми подібні до мігрені: головний біль (40 %), фотофобія (32%), фонофобія і запаморочення (28 %). Пароксизм часто закінчується раптово. Між епізодами діти почувають себе добре, без будь-яких проявів хвороби [7, 14, 30].
Блювота може бути з домішками жовчі, слизу, іноді крові (гематемезис). Кров може зустрічатись протягом епізоду в будь-який час через розвиток гастропатії, езофагіту, геморагічного пошкодження слизової шлунка, синдрому Меллорі — Вейса [34].
Серед інших симптомів, що супроводжують СЦБ, можуть зустрічатись збільшення частоти серцевих скорочень і підвищення артеріального тиску, виражена пітливість, гарячка. Біль у животі та лейкоцитоз можуть призвести до непотрібних хірургічних втручань. Приблизно половина пацієнтів мають досить регулярні рецидиви. Кожен епізод має тенденцію бути стереотипним і особливим для кожного пацієнта [34].
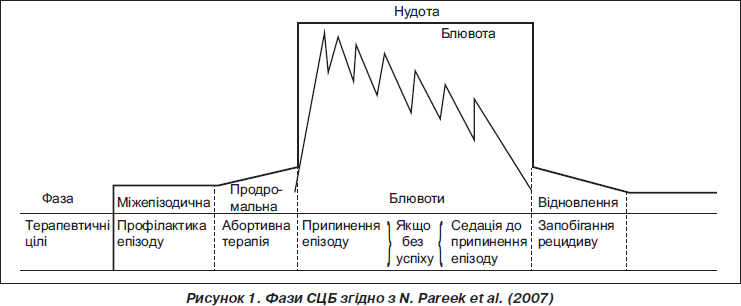
СЦБ має чотири фази: міжепізодичну, продромальну, фазу блювоти й фазу відновлення (рис. 1) [7].
Міжепізодична фаза перебігає без проявів симптомів захворювання й може тривати від 4 тижнів до декількох місяців. Продромальна фаза починається раптово з симптомів нудоти, пітливості, болю в животі, подразливості і анорексії. Вона зазвичай короткотривала і через 1–2 години переходить у наступну блювотну фазу, що характеризується нестримною нудотою і блювотою кожні 5–10 хвилин і зазвичай розпочинається між 2.00–4.00 годинами ранку або після пробудження о 7.00 годині ранку, хоча деякі епізоди розпочинаються пізніше. Фаза блювоти може тривати у дітей у середньому 3–5 діб. Під час фази блювоти в пацієнта може виникати виражена слабкість навіть до стану, подібного до коми, нездатністю пересуватися й розмовляти. Фаза відновлення починається зі зникнення нудоти і блювоти з відновленням апетиту й активності. Ця фаза також може бути досить короткотривалою, як і фаза продрому, і тому в пацієнта може раптово з’явитись активність «включення» з підвищеним апетитом протягом 1–2 годин після припинення блювоти [9].
Діагностика
На теперішній час немає жодних тестів і лабораторних ознак для діагностики СЦБ, діагностика якого базується виключно на клінічних критеріях [24].
Останні критерії діагностики були затверджені Південноамериканською асоціацією дитячої гастроентерології, гепатології і харчування (North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition (NASPGHAN) в 2008 році (табл. 2) [24].
Критерії синдрому циклічної блювоти NASPGHAN (2008):
— Щонайменше 5 нападів у будь-якому інтервалі або щонайменше 3 напади протягом 6-місячного періоду.
— Епізодичні напади інтенсивної нудоти і блювоти, які тривають від однієї години до 10 діб і зустрічаються щонайменше 1 тиждень відокремлено.
— Стереотипна структура і симптоми нападу в кожного окремого пацієнта.
— Блювота протягом нападу зустрічається щонайменше 4 рази на годину протягом щонайменше однієї години*.
— Повернення до здорового стану між епізодами блювоти.
— Не виникає через інше захворювання.
(Всі критерії повинні бути дотримані в постановці діагнозу СЦБ.)
Ці діагностичні критерії були змінені з попередньо погоджених критеріїв 1994 року і критеріїв, встановлених підкомісією Міжнародної класифікації головного болю ІІ перегляду 2004 року. Подані критерії є вірогідними (приблизно 90 %), щоб в остаточному підсумку діагностувати ідіопатичний СЦБ. Диференціації з іншими і більш тяжкими причинами блювоти потребують 10 % хворих, для яких швидке лікування може змінити перебіг захворювання. Діагностика з виключенням усіх можливих діагнозів призвела би багатьох дітей до непотрібних і дороговартісних рентгенографічних і ендоскопічних досліджень. Тому визначені діагностичні принципи створені, щоб допомогти виявляти дітей із циклічною блювотою віком від 2 до 18 років при найбільшому ризику органічної причини блювоти. Хоча діти молодше 2 років можуть мати СЦБ, значні вроджені метаболічні порушення є більш частими й важкодіагностованими в цьому віковому діапазоні [24].
Практичні лікарі, визначаючи СЦБ, можуть починати лікування без проведення широкого діапазону інших досліджень, але вважається необхідним проведення досліджень для визначення прихованих ендокринних і метаболічних розладів у всіх дітей перед призначенням внутрішньовенних інфузій глюкози і електролітів, оскільки вони можуть завадити правильним результатам, а також дослідження ШКТ для виключення мальротації. УЗД органів черевної порожнини необхідно проводити для виключення гідронефрозу й анатомічних аномалій ШКТ, який може бути причиною резистентних до лікування форм СЦБ. Якщо пацієнт має гіпонатріємію або гіпоглікемію, тоді подальше дослідження повинно бути спрямоване на виключення хвороби Аддісона і порушення окислення жирних кислот [24].
Підозрілі симптоми, що потребують подальшого обстеження [24]:
1. Нестримна блювота, болючість живота або сильний біль у животі.
2. Напади, що провокуються інтеркурентним захворюванням, обмеженням уживання їжі і/або вживання їжі з високим умістом білка.
3. Розлади з ознаками неврологічного захворювання, тяжкого порушення психічного статусу, розлади з боку окорухових функцій, набряк диска зорового нерва, моторна асиметрія і/або розлади ходи (атаксія).
4. Прогресивне погіршення епізодів блювоти або їх зміна в безперервний або хронічний перебіг.
Блювота, пов’язана з прогресуючими неврологічними розладами, визначає обов’язкове проведення магнітно-резонансної томографії (МРТ) або комп’ютерної томографії головного мозку (КТ) [34]. Зміни на ЕЕГ і аналіз викликаних зорових потенціалів при СЦБ подібні до таких при мігрені [37].
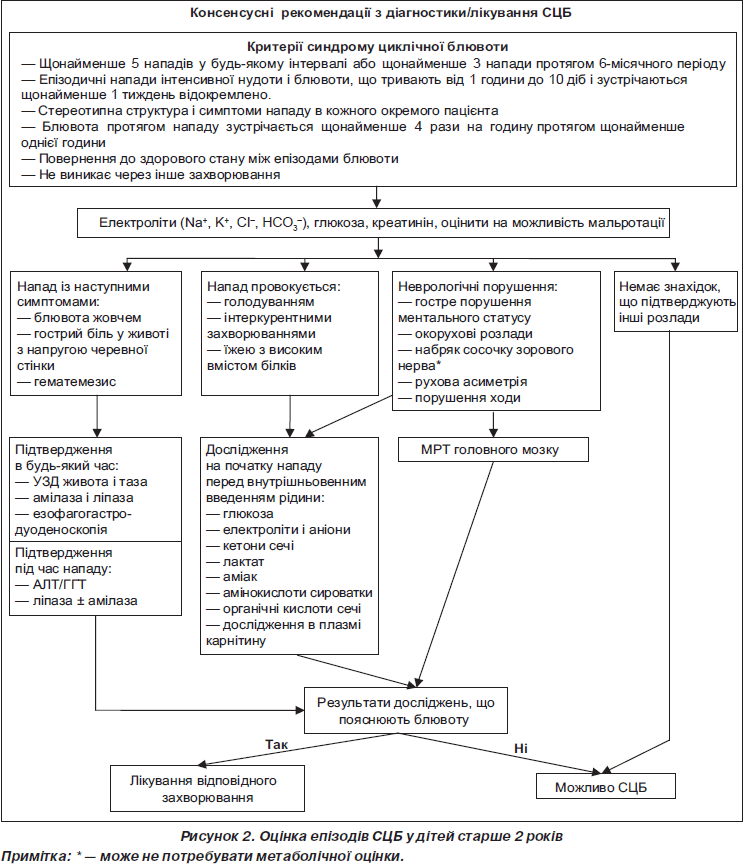
Алгоритм діагностики СЦБ за рекомендаціями NASPGHAN (2008) наведений на рис. 2.
Обстеження дітей із СЦБ (за рекомендаціями NASPGHAN (2008))
Діти з СЦБ часто мають виражену блювоту (80 %) і/або біль у животі (80 %), однак не виключається, що ці порушення можуть бути наслідком виникнення хірургічної патології, а саме: мальротація з заворотом кишок (що може викликати ішемічний некроз), післяопераційні стриктури і спайки, захворювання жовчного міхура, кіста загального жовчного протоку, гепатит, панкреатит і пельвіоуретральна обструкція. За наявності блювоти жовчю й тяжкого стану цільова група рекомендує провести дослідження на амілазу і ліпазу крові, які можуть виявити панкреатит, дослідити рівень аланінамінотрансферази (АлАТ) і глутамілтрансферази-g (ГГТ) для проведення скринінгу на гепатит і захворювання жовчного міхура, УЗД органів черевної порожнини або КТ проводяться з метою визначення стану жовчних і сечовивідних шляхів. Якщо результати дослідження негативні, тоді рекомендується емпіричне лікування СЦБ.
Епізоди блювоти, що супроводжуються невеликими кількостями гематемезису, зазвичай обумовлені езофагітом або пролапсуючою гастропатією. Тому цільова група не рекомендує проводити звичайну ендоскопію, якщо у пацієнтів немає хронічних симптомів між епізодами. Якщо ж гістологічно визначається езофагіт, то до стандартної терапії додаються засоби, які пригнічують кислотність, наприклад інгібітори протонної помпи.
Гостра минуча порфірія, з якою диференціюють СЦБ, зустрічається не часто і може не проявлятись до пубертатного віку. Порфірія також може проявлятись блювотою й болем у животі та імітувати СЦБ. Однак вона проявляється ще й іншими симптомами, такими, як депресія, марення та іншими психопатологічними розладами, ураженням периферичної нервової системи. Діагноз підтверджується збільшенням D-амінолевулінової кислоти і уропорфіріну в сечі, позитивною реакцією аналізу калу на порфобіліноген під час кризу.
Диференційна діагностика з неврологічними порушеннями за рекомендаціями NASPGHAN (2008)
Наявність атаксії, патології з боку окорухових нервів, набряку диска зорового нерва, порушення ходи, поява парезів, розладів особистості не типові для СЦБ і можуть спостерігатись при підвищенні внутрішньочерепного тиску чи метаболічних порушеннях. Підвищення внутрішньочерепного тиску може бути наслідком пухлини задньої черепної ямки й гіпоталамічної ділянки, мальформації Кіарі, гідроцефалії і субдуральної гематоми. За наявності блювоти з прогресуючим неврологічним дефіцитом виникає необхідність проведення МРТ, що переважає КТ у візуалізації задньої черепної ямки. Рентгенографія черепа в даному випадку не несе жодної діагностичної цінності.
Найтяжчим у діагностиці симптомом є порушення психічного статусу. Діти з СЦБ часто мають зміну свідомості протягом епізоду й виглядають летаргічними, млявими, дезорієнтованими і тяжко пробуджуються. Оскільки гостре або епізодичне неврологічне чи метаболічне порушення зазвичай призводить до зміни психічного статусу, важко відрізнити істинну енцефалопатію від апатичності, типової для СЦБ. При СЦБ дитина зазвичай дезорієнтована і здатна відповідати на відповідні команди, але через нудоту може цього не робити. При метаболічній енцефалопатії пацієнт дезорієнтований, свідомість сплутана, роздратований і важко пробуджується.
Рідко, але певні форми складних парціальних епілептичних нападів (наприклад, зі скроневої частки, доброякісна ідіопатична потилична епілепсія) можуть бути пов’язаними з епізодичною блювотою, але при цьому можуть бути присутні інші симптоми, такі як альтерація психічного статусу, післянападна дезорієнтація, судомні посмикування. Якщо підозрюються епілептичні напади, необхідно провести ЕЕГ під час активності та сну.
Ідіопатична потилична епілепсія з раннім початком (синдром Панайотопулоса) являє собою залежну від віку схильність до вегетативних нападів і вегетативного епілептичного статусу. При цьому діти мають нормальний фізичний і нервово-психічний розвиток [6].
Синдром Панайотопулоса — нова форма ідіопатичної форми епілепсії, недавно визнана Міжнародною лігою епілепсії (International League Epilepsy). Це досить поширена доброякісна форма, що маскується під велику кількість відомих хвороб. Клінічні прояви синдрому можуть нагадувати нейроінфекції, мігрень, гастроентерит та інші хвороби. Захворювання починається в 1–14 років з піком у 4–5 років. Саме в цьому періоді збігається підвищена чутливість вегетативних центрів до епілептичних розрядів і дифузна епілептогенна активність кори головного мозку [6].
Дві третини нападів розпочинаються уві сні. Дитина просинається під час нападу з появою відповідних симптомів [25, 26].
Для синдрому Панайотопулоса характерна блювотна тріада (нудота, поклики до блювоти і блювота), що є наслідком розладу автономної регуляції і зустрічається у 74 % випадків. В інших зустрічається лише нудота або блювота. Інші автономні розлади включають блідість (менш часто почервоніння або ціаноз), мідріаз (менш часто міоз), нерегулярне дихання, тахікардію, підвищення температури тіла, гіперсалівацію, порушення моторики кишечника, діарею. Часто зустрічається головний біль [26]. Інші симптоми нападу з’являються після початку блювоти. Може виникати неспокій, збудження, сплутаність свідомості, втрата свідомості. Лише в половини випадків (40 %) напад може закінчуватись геміконвульсіями або генералізованим нападом [25, 26].
Основним дослідженням, що підтверджує наявність синдрому, є електроенцефалографія. Типовому вегетативному нападу відповідає унілатеральна ритмічна тета- або дельта-активність і окремі спайки невеликої амплітуди. Початок епілептичної активності реєструється як у потиличних, так і в лобних відведеннях [6, 25].
Диференційна діагностика СЦБ із нейрометаболічними захворюваннями, які супроводжуються блювотою (за рекомендаціями NASPGHAN (2008))
Для метаболічних або нейрометаболічних розладів характерні такі критерії:
— виникають у віці до 2 років (з циклічною блювотою або з супутньою патологією, наведеною нижче);
— епізоди блювоти пов’язані з інтеркурентними захворюваннями, що передують обмеженню вживання їжі або вживання їжі з великим умістом білка;
— будь-яке неврологічне порушення: атаксія, дистонія або інші розлади ходи, олігофренія, судоми, гостра енцефалопатія (що включає летаргію, збудження, дезорієнтацію, психоз або швидку зміну психічного статусу);
— лабораторні порушення: гіпоглікемія, метаболічний ацидоз, респіраторний алкалоз або гіперамоніємія.
Направлення на консультацію до спеціаліста з метаболічних порушень або невролога є необхідним для пацієнтів із наявністю будь-яких вищенаведених змін.
Блювота, викликана метаболічними розладами (розлад окислення жирних кислот, циклу сечовини, органічного (пропіонова ацидемія) й амінокислотного метаболізму та метаболізму мітохондріальної енергії), часто виникає після катаболічного стану, індукованого гострою хворобою, голодуванням або вживанням їжі з високим умістом білка.
Голодування може бути внаслідок анорексії та блювоти, що супроводжує вірусні респіраторні чи кишкові інфекції, перебування на дієті чи передхірургічна підготовка. Хоча гострий дефіцит ензимів узагалі присутній одразу після народження, діти мають тенденцію до часткового дефіциту ензимів.
Якщо запідозрено порушення обміну речовин, то негайно має бути отримана кров і сеча для дослідження з подальшим внутрішньовенним уведенням 10% розчину декстрози (за необхідності одночасно з болюсним уведенням) і вирішено питання про консультацію зі спеціалістами з метаболічних розладів.
При частковому дефіциті ензимів у циклі сечовини накопичення аміаку може виникати після вживання в їжу продуктів із високим умістом білка або голодування. Хоча ураження спостерігається в осіб обох статей, більшому ризику підлягають дівчата-гетерозиготи з частковим дефіцитом орнітинтранскарбамілази, оскільки ген локалізується на Х-хромосомі. Розлад циклу сечовини є підтвердженим, коли рівень амонію в плазмі і150 мМ/л. Аміно- та органічні ацидемії часто присутні в перші дні життя, але субпопуляції з частковим дефіцитом ензимів залишаються невиявленими до того часу, поки пов’язаний із хворобою голод проявить симптоми, що можуть включати епізоди блювоти. При даному метаболічному порушенні під час кризу може спостерігатись зміна ментального статусу, гострий метаболічний ацидоз, тяжкий кетоз.
Розлади окислення жирних кислот, включаючи дефіцит середнього ланцюга ацил-коензим-А-дегідрогенази, можуть поєднуватись із патернами циклічної блювоти. Діагностика цих розладів базується на визначенні амінокислот плазми та органічних кислот сечі. Чутливість метаболічного тесту є кращою, коли він проведений до внутрішньовенного введення декстрозовмісної рідини. Дослідження ацилкарнітину плазми і ацилгліцину сечі є більш чутливими, ніж органічні кислоти сечі, при розладах окислення жирних кислот, які можуть діагностуватись навіть за відсутності симптомів. Якщо будь-який зі скринінгових тестів є відхиленим від норми, пацієнт має бути направлений до спеціаліста з метаболічних розладів (в Україні — в центр метаболічних порушень лікарні ОХМАТДИТ, м. Київ).
Біохімічні, ензимні дані й дані родвідної (по материнській лінії) підтверджують, що при СЦБ має місце недостатність продукції клітинної енергії, що обумовлено певним ступенем мітохондріальної дисфункції.
У дітей із СЦБ виявлено легкий і помірного ступеня метаболічний ацидоз (рівні Na+, Cl–, HCO3– у сироватці до 15–20 мг/дл), лактат-ацидоз, сечовинний кетоз (рано під час епізоду, але не як наслідок голодування) та/або гіпоглікемію різного ступеня під час нападу. Ці дані сумісні з СЦБ і не потребують всебічного метаболічного дослідження.
У деяких випадках епізодична блювота може бути першим проявом мітохондріальної хвороби і тоді епізоди можуть бути обумовлені тяжким метаболічним ацидозом (> 20 мг/дл).
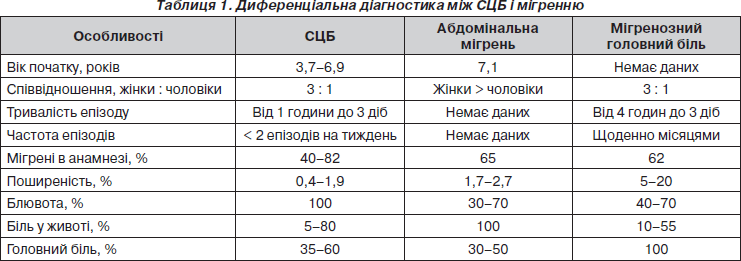
Диференційна діагностика з мігренню
Хоча СЦБ і належить до попередників мігрені, слід диференціювати його з мігренозним головним болем і абдомінальною мігренню (табл. 1) [7].
Список літератури знаходиться в редакції