Журнал «Здоровье ребенка» 4 (31) 2011
Вернуться к номеру
Хронический гломерулонефрит (гематурическая форма) в детском возрасте: клинико-морфологические особенности и прогностические факторы
Авторы: Герасименко О.Н. Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Версия для печати
Клинические особенности гематурической формы хронического гломерулонефрита (ГФХГН) изучены у 110 детей, морфологическая характеристика по данным чрескожной нефробиопсии — у 55 больных. Прогностические факторы в развитии хронической почечной недостаточности (ХПН) выявлены в различные периоды ГФХГН: дебют гломерулонефрита (95 детей), от начала заболевания до 5 лет (95 пациентов), от 6 до 10 лет (65 больных) и более 10 лет (45 случаев). Ведущими клиническими симптомами являются различная степень выраженности эритроцитурии и минимальная протеинурия. Макрогематурия встречается в 40,9 % случаев. Основной морфологический вариант гломерулонефрита — мезангиопролиферативный. Уточнена частота экстракапиллярных (54,5 %), тубулоинтерстициальных изменений (60,0 %), гиалиноза (25,4 %) и склероза (23,1 %) клубочков. Формирование ХПН, в основном І стадии, в течение первых пяти лет заболевания наблюдается у 9,5 %, от 6 до 10 лет — у 18,5 %, более 10 лет — у 40,0 % больных. Клиническими факторами неблагоприятного прогноза ГФХГН являются отягощенность анамнеза по нефропатии, наличие артериальной гипертензии, протеинурии, гипостенурии, ультрасонографических изменений почек в виде утраты кортикомедуллярной дифференцировки, повышение креатинина сыворотки крови, морфологическими признаками — наличие гиалиноза и склероза клубочков, крупноочаговой инфильтрации в интерстиции почек.
Хронический гломерулонефрит, гематурическая форма, дети, клинические особенности, морфология, неблагоприятные прогностические факторы.
Введение
В структуре нефрологической патологии у детей хронический гломерулонефрит (ГН) остается основной причиной развития хронической почечной недостаточности (ХПН). Гематурическая форма хронического гломерулонефрита (ГФХГН) характеризуется стойкостью мочевого синдрома, прогрессирующим течением у отдельных больных [2, 3]. Характер морфологических изменений почечной ткани определяет темпы прогрессирования ГН. В современной литературе имеются единичные сведения о морфологических изменениях в почках при ГФХГН у детей [5, 8]. Отдаленный прогноз ГФХГН остается предметом дискуссий. Результаты отдельных наблюдений показали возможность прогрессирования ГФХГН с развитием ХПН у 13,6 % детей через 13,5 года от начала болезни [1]. При этом недостаточно разработаны подходы к прогнозированию неблагоприятного течения ГФХГН. По данным современной литературы, имеются лишь сведения о прогностических факторах такого морфологического варианта ГФХГН, как IgA-нефропатии, к которым относятся артериальная гипертензия (АГ), протеинурия более 1 г/сут, снижение скорости клубочковой фильтрации (СКФ), наличие гломерулярных полулуний, гломерулосклероза, тубулярной атрофии, интерстициального фиброза, диффузной мезангиальной пролиферации [4, 5]. Данные относительно влияния выраженности гематурии на исход IgA-нефропатии противоречивы [4, 6].
Цель исследования — изучение современных клинических и морфологических особенностей, неблагоприятных прогностических факторов ГФХГН у детей.
Материалы и методы
Клинические особенности ГФХГН изучены у 110 детей. Пациенты в возрасте от 1,5 до 17 лет, в среднем 9,8 ± 0,4 года. Всем больным проведено комплексное нефрологическое обследование, включающее клинические (общие анализы мочи и крови, суточная протеинурия, проба по Нечипоренко, проба по Зимницкому), биохимические (общий белок, холестерин, мочевина, креатинин сыворотки крови), иммунологические (количественное определение IgA, IgМ, IgG, ЦИК крови) методы обследования, ультрасонографию почек. Выраженность гематурии устанавливали в пробе Нечипоренко: при минимальной гематурии содержание эритроцитов не превышало 10 ґ 106/л, при умеренной — от 10 ґ 106/л до 60 ґ 106/л и выраженной — более 60 ґ 106/л. Расчет СКФ проводился по формуле Шварца [7]. Стадии ХПН определяли в зависимости от значений СКФ и креатинина крови согласно приказу МЗ Украины № 365 от 20.07.05.
Морфологическая характеристика ГФХГН изучена у 55 детей на основании прижизненного морфологического исследования почечной ткани при помощи световой микроскопии (гематоксилин-эозин, PAS-реакция). Показания для проведения нефробиопсии — наличие протеинурии более 1 г/сут, рецидивирующая макрогематурия.
Проведен анализ неблагоприятных прогностических факторов ГФХГН у больных в дебюте болезни (95 детей), а также в периоды наблюдения до пяти лет (95 пациентов), от 6 до 10 лет (65 больных) и более 10 лет от начала заболевания (45 случаев).
Статистическая обработка полученных результатов производилась с использованием электронной таблицы статистического анализа Excel 9.0 методами вариационной статистики. При сравнении двух параметрических выборок использовался критерий Стьюдента, при сравнении частоты встречаемости номинальных показателей — c2-критерий для таблиц сопряженности признаков. Достоверными считали отличия при р < 0,05.
Результаты исследования
Отягощенность семейного анамнеза регистрировалась у половины обследованных пациентов — 55 (50,0 ± 4,8 %). В большинстве случаев имела место наследственная отягощенность по заболеваниям органов мочевой системы — 37 (33,6 ± 4,5 %, р < 0,001) больных.
У 65 (59,1 ± 4,7 %) больных удалось установить фактор, предшествующий дебюту ГН. В анамнезе у пациентов чаще имела место связь дебюта ГН с острой респираторной инфекцией — 36 (32,7 ± 4,5 %) детей по сравнению с бактериальной — 17 (15,5 ± 3,5 %), р < 0,001. Повышение титра АСЛО отмечалось достоверно реже — 25 (22,7 ± 4,0 %, р < 0,001) детей. Это позволяет предположить, что стрептококковая инфекция не явилась значимым причинным фактором в развитии ГФХГН.
Анализ мочевого синдрома у детей с ГФХГН показал, что эритроцитурия документирована в большинстве случаев — 98 (89,1 ± 3,0 %). Выраженная эритроцитурия встречалась у 41 (37,3 ± 4,6 %), умеренно выраженная — у 42 (38,2 ± 4,7 %), незначительно выраженная — у 15 (13,6 ± 3,3 %) детей. Макрогематурия отмечалась у 45 (40,9 ± 4,7 %, р < 0,05) больных. Протеинурия у большинства обследованных была минимальной. Умеренная протеинурия (более 1 г/сут) отмечалась достоверно реже — 28 (25,5 ± 4,2 %, р < 0,001).
Уровень мочевины у 97 (88,2 ± 3,1 %) детей с ГФХГН соответствовал возрастной норме. Значение креатинина крови также в большинстве случаев не отличалось от возрастных нормативов — 102 (92,7 ± 2,5 %). Среднее значение расчетной СКФ составило 146,4 ± 4,7 мл/мин. Снижение СКФ в момент первичного обследования больных менее 90 мл/мин отмечалось у 15 (13,6 ± 3,3 %) пациентов (р < 0,001). Нарушение концентрационной способности почек констатировано у 30 (27,3 ± 4,3 %) детей.
Повышение уровня СОЭ регистрировалось в 58 (52,7 ± 4,8 %) случаях.
Средний уровень IgA в сыворотке крови составил 1,83 ± 0,09 г/л, IgМ — 0,97 ± 0,03 г/л, IgG — 11,00 ± ± 0,37 г/л, ЦИК — 38,1 ± 2,1 г/л. Повышение IgA отмечалось у 16 (14,5 ± 3,4 %), IgМ — у 6 (5,5 ± 2,2 %), IgG — у 29 (26,4 ± 4,2 %), ЦИК — у 9 (8,2 ± 2,6 %) больных.
Нормальная ультрасонографическая картина почек наблюдалась достоверно чаще — 79 (71,8 ± 4,3 %) больных (р < 0,01). Патологические изменения касались в основном повышенной эхогенности коркового вещества — 17 (15,4 ± 3,4 %) детей. Увеличение почек в размере наблюдалось у 11 (10,0 ± 2,9 %) пациентов, утрата кортикомедуллярной дифференцировки — у 9 (8,2 ± 2,6 %), сочетание утраты кортикомедуллярной дифференцировки с повышенной эхогенностью коркового вещества — у 5 (4,5 ± 2,0 %) больных.
При прижизненном морфологическом исследовании почечной ткани диагностирован мезангиопролиферативный ГН — 47 (85,4 ± 6,4 %), пролиферативный ГН — 6 (10,9 ± 4,2 %), мембранопролиферативный ГН — 1 (1,8 ± 1,8 %). У одного (1,8 ± 1,8 %) ребенка диагностирована болезнь тонких базальных мембран.
Изменения со стороны капсулярного пространства имели место у 30 (54,5 ± 6,8 %) обследованных в виде наличия белковых масс и/или экссудата — 20 (36,4 ± 6,5 %) детей, тенденции к пролиферации эпителия капсулы — 13 (23,6 ± 5,8 %), образования микрополулуний и полулуний — 8 (14,5 ± 4,8 %) пациентов. Утолщение базальной мембраны капсулы отмечалось у 23 (41,8 ± 6,7 %) больных.
Сращение капилляров с капсулой клубочка наблюдалось в 30 (54,5 ± 6,8 %) случаях, наличие гиалиноза клубочков — у 14 (25,4 ± 5,9 %) больных, р < 0,001 (распространенность в среднем 34,8 %), склероза клубочков — у 12 (23,1 ± 5,9 %), р < 0,001 (выраженность от 3,0 до 33,3 %).
Тубулярные изменения в виде дистрофии эпителия канальцев выявлены у 54 (98,2 ± 4,3 %) пациентов. Некроз эпителия канальцев отмечался у 45 (81,8 ± 5,2 %) детей (р < 0,001), признаки атрофии эпителия канальцев — у 22 (40,0 ± 6,7 %). Инфильтрация интерстиция выявлена у 33 (60,0 ± 6,7 %) обследованных, очаговый склероз стромы — у 25 (45,4 ± 6,8 %) больных.
Формирование ХПН в течение первых 5 лет течения ГФХГН наблюдалось у 9 (9,5 %) детей, из которых ХПН I стадии имела место у 8 (8,5 %), ХПН IV — у одного (1,0 %) пациента. При длительности заболевания от 6 до 10 лет — у 12 (18,5 %), из которых ХПН I стадии имела место у 9 (14,0 %), ХПН II — у одного (1,5 %), ХПН III — у одного (1,5 %), ХПН IV — у одного (1,5 %) больного. В периоде наблюдения более 10 лет — в 18 (40,0 %) случаях, из которых ХПН I стадии имела место у 12 (26,6 %), ХПН II — у 3 (6,7 %), ХПН IV — у 3 (6,7 %) детей.
Для выявления неблагоприятных прогностических факторов в различные периоды ГФХГН проведено сопоставление показателей пациентов с наличием ХПН в исходе заболевания и отсутствием данного признака.
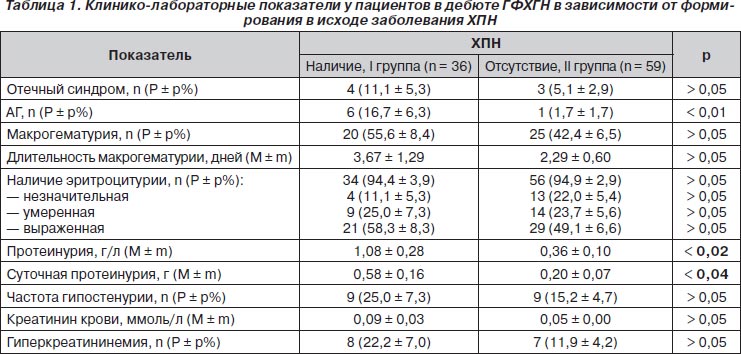
У больных с отягощенностью анамнеза по нефропатии достоверно чаще развивалась ХПН: 26 (72,2 ± 7,6 %) детей против 29 (49,1 ± 6,6 %, p < 0,03). Неблагоприятными прогностическими факторами дебюта ГФХГН являлись АГ, протеинурия в общем анализе мочи и суточная протеинурия (табл. 1). Другие клинико-лабораторные признаки не оказывали влияния на развитие ХПН. Утрата кортикомедуллярной дифференцировки при ультрасонографии почек чаще регистрировалась у больных со сформировавшейся ХПН: 6 (16,7 ± 6,3 %) против 3 (5,1 ± 2,9 %) соответственно (р < 0,05).
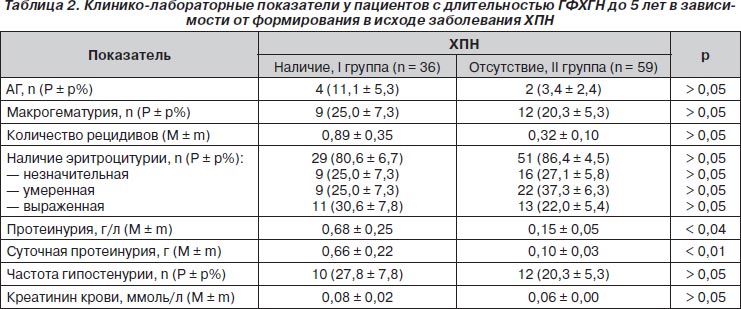
В периоде наблюдения до пяти лет из всех клинико-лабораторных признаков ГФХГН прогностически неблагоприятным был лишь средний уровень протеинурии в общем анализе мочи и суточной протеинурии (табл. 2). Утрата кортикомедуллярной дифференцировки при ультрасонографии почек регистрировалась только у больных со сформировавшейся ХПН: 8 (22,2 ± 7,0 %) детей (р < 0,001).
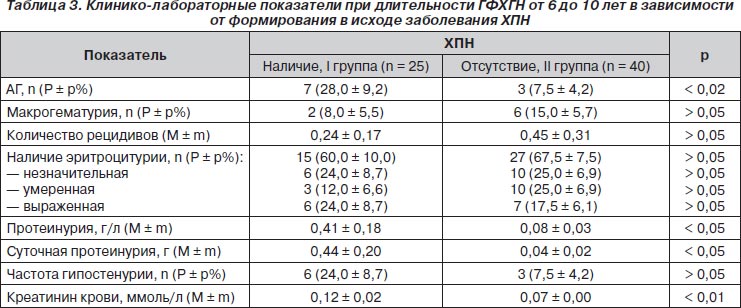
Неблагоприятными прогностическими факторами при длительности ГФХГН от 6 до 10 лет являлись протеинурия в общем анализе мочи и суточная протеинурия, повышение уровня креатинина крови, АГ (табл. 3). Ультрасонографические изменения почек в виде утраты кортикомедуллярной дифференцировки по-прежнему чаще встречались в группе больных с неблагоприятным прогнозом: 8 (32,0 ± 9,5 %) против 2 (5,0 ± 3,5 %) соответственно (р < 0,005).
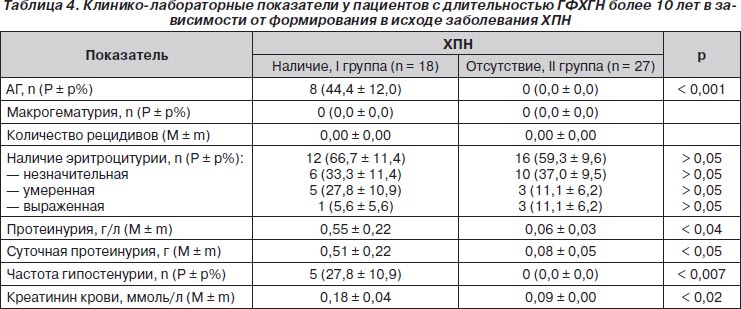
При длительности ГФХГН более 10 лет факторами риска развития ХПН явились протеинурия в общем анализе мочи и суточная протеинурия, креатинин крови, АГ, гипостенурия (табл. 4). Утрата кортикомедуллярной дифференцировки при ультрасонографии почек имела прогностическую значимость: 4 (22,2 ± 10,1 %) больных против 1 (3,7 ± 3,7 %, р < 0,05).
Для установления неблагоприятных морфологических изменений почечной ткани проведено сопоставление данных чрескожной нефробиопсии у больных со сформировавшейся ХПН (21 пациент — І группа) и больных с отсутствием данного признака (22 пациента — ІІ группа). Основным морфологическим вариантом являлся мезангиопролиферативный ГН, который одинаково часто регистрировался в исследуемых группах: 18 (85,7 ± 8,7 %) против 19 (86,4 ± 9,1 %, р > 0,05). Степень увеличения мезангиального матрикса не имела прогностической значимости: незначительная отмечалась у 6 (28,6 ± 10,1 %) больных І группы против 10 (45,4 ± 10,9 %) ІІ группы (р > 0,05), умеренная — у 7 (33,3 ± 10,5 %) против 4 (18,2 ± 8,4 %), р > 0,05, выраженная — у 5 (23,8 ± 9,5 %) против 5 (22,7 ± 9,1 %) соответственно, р > 0,05. Степень пролиферации мезангиальных клеток также не имела статистически значимых отличий: незначительная — у 2 (9,5 ± 6,6 %) пациентов против 2 (9,1 ± 6,3 %), р > 0,05, умеренная — у 10 (47,6 ± 11,2 %) против 11 (50,0 ± 10,9 %), р > 0,05, выраженная — у 6 (28,6 ± 10,1 %) против 4 (18,2 ± 8,4 %) соответственно, р > 0,05.
Гиалиноз клубочков был характерен для І группы: 8 больных (38,1 ± 10,9 %) против 1 (4,5 ± 4,5 %, р < 0,008) и имел степень распространенности от 5,3 до 100 % клубочков. Частота встречаемости склероза клубочков также была статистически значимой у больных с неблагоприятным прогнозом заболевания: 9 (42,9 ± 11,1 %) детей против 2 (9,1 ± 6,3 %, р < 0,01).
Тенденция к пролиферации эпителия капсулы — 4 (19,0 ± 8,8 %) против 6 (27,3 ± 9,7 %, р > 0,05), наличие белковых масс и экссудата в капсулярном пространстве — 6 (28,6 ± 10,1 %) против 6 (27,3 ± 9,7 %, р > 0,05) — регистрировались одинаково часто в исследуемых группах. Наличие полулуний и/или микрополулуний отмечалось у единичных больных — 3 (14,3 ± 7,8 %) детей І группы и 2 ( 9,1 ± 6,3 %) ІІ группы (р > 0,05) и не имело прогностической значимости.
У больных с неблагоприятным исходом заболевания наблюдалась крупноочаговая инфильтрация интерстиция — 9 (42,9 ± 11,1 %) против 1 (4,5 ± 4,5 %, р < 0,003), тенденция к более частому выявлению тубулоинтерстициального компонента — 14 (66,7 ± 10,5 %) против 10 (45,4 ± 10,9 %, р > 0,05).
Таким образом, предшествующим фактором в развитии ГФХГН чаще всего является острая респираторная инфекция. Ведущий клинический симптом ГФХГН — изолированный мочевой синдром в виде различной степени выраженности эритроцитурии и минимальной протеинурии. Протеинурия более 1 г/сут наблюдается у 25,5 % больных. Макрогематурия встречается у 40,9 % больных, нарушение концентрационной способности почек — у 27,3 % пациентов. Нормальная ультрасонографическая картина почек наблюдается достоверно чаще.
Основным морфологическим вариантом ГФХГН является мезангиопролиферативный ГН. Более чем в половине случаев имеет место экстракапиллярный компонент: наличие белковых масс и/или экссудата отмечается у 36,4 % детей, тенденция к пролиферации эпителия капсулы — у 23,6 %, образование микрополулуний и полулуний — у единичных пациентов. Гиалиноз и склероз клубочков выявляются у каждого четвертого ребенка. Инфильтрация интерстиция наблюдается у 60,0 % пациентов, у 45,4 % детей — ее очаговый склероз. Изменения в эпителии канальцев в виде дистрофии регистрируются у 98,2 %, некроза — у 81,8 %, признаков атрофии эпителия канальцев — у 40,0 % больных.
Формирование ХПН, в основном І стадии, в течение первых пяти лет заболевания наблюдается у 9,5 %, от 6 до 10 лет — у 18,5 %, более 10 лет — у 40,0 % больных. Неблагоприятными прогностическими факторами являются отягощенность семейного анамнеза по нефропатии, АГ, протеинурия, гипостенурия, повышение креатинина крови, утрата кортикомедуллярной дифференцировки при ультрасонографии почек, наличие гиалиноза и склероза клубочков, тубулоинтерстициального компонента в виде крупноочаговой инфильтрации интерстиция.
1. Лоскутова С.А., Чупрова А.В., Мовчан Е.А. Выживаемость больных первичным гломерулонефритом, дебютировавшим в детском возрасте // Педиатрия. — 2005. — № 4. — С. 29-33.
2. Ни А., Лучанинова В.Н. Результаты катамнестического наблюдения детей, перенесших гломерулонефрит // Педиатрия. — 2009. — Т. 87, № 3. — С. 39-42.
3. Возианов А.Ф., Майданник В.Г., Бидный В.Г. и др. Основы нефрологии детского возраста. — Книга плюс. — 2002. — С. 101-164.
4. Сукало А.В., Крылова-Олефиренко А.В., Черствый Е.Д. и др. Распространенность и морфологические особенности IgA-нефропатии у детей и подростков в республике Беларусь // Педиатрия. — 2009. — Т. 87, № 3. — С. 28-32.
5. Nozawa R., Suzuki J., Takahashi A. et al. Clinicopathological features and the prognosis of IgA nephropathy in Japanese children on long-term observation // Clin. Nephrol. — 2005. — Vol. 64. — Р. 171-179.
6. Halling S.F. Predictors of оutcome in IgA nephropathy // Pediatr. Nephrol. — 2010. — Vol. 25. — P. 1801-1802.
7. Hogg R.J. National kidney foundation’s kidney disease outcomes quality initiative clinical practice guidelines for chronic kidney disease in children and adolescents: evaluation, classification, and stratification // Pediatrics. — 2003. — Vol. 111, № 6. — Р. 823-829.
8. Batinic D., Scukanec-Spoljar M., Milosevic D. et al. Renal biopsy in children with isolated microhematuria // Acta Med. Croatica. — 2002. — Vol. 56, № 5. — Р. 163-166.