Журнал «Здоровье ребенка» 4 (31) 2011
Вернуться к номеру
Опыт оптимизации патогенетической терапии атопического дерматита в детском возрасте
Авторы: Буряк В.Н., Пошехонова Ю.В., Шабан Н.И., Дудко М.В., Скачкова Л.П., Бессараб П.А. Донецкий национальный медицинский университет им. М. Горького Городская детская клиническая больница № 4 г. Донецка
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье приводятся результаты изучения безопасности применения и эффективности влияния на ведущие клинико-патогенетические проявления препарата Эдем при атопическом дерматите в детском возрасте. Анализ полученных данных исследования позволил доказать наличие значительного антигистаминного эффекта у препарата Эдем, обусловленного не только блокадой Н1-рецепторов гистамина, но и снижением выделения его из тучных клеток в результате стабилизации их мембран. Установленные обстоятельства дают возможность рекомендовать Эдем в качестве высокоэффективного и безопасного средства лечения при различных патогенетических вариантах атопического дерматита в детском возрасте.
Атопический дерматит, детский возраст, терапия, Эдем.
Проблема атопического дерматита представляет собой одну из наиболее значимых нерешенных задач современной детской аллергологии. Помимо снижения качества жизни, связанного часто с выраженным зудом, указанный патологический процесс может трансформироваться в инфицированную экзему, а также нередко оказаться первым этапом «аллергического марша», завершающим звеном которого является формирование бронхиальной астмы [4, 8]. С каждым годом в детской популяции регистрируется возрастание заболеваемости атопическим дерматитом, что обусловлено в первую очередь поливалентностью сенсибилизации детей, а также количественным увеличением аллергенной нагрузки, появлением новых аллергенов [4, 5, 10]. Проведение комплексного аллергологического обследования позволяет установить повышенную чувствительность к тем или иным аллергенам и степень выраженности этой чувствительности у каждого конкретного ребенка. Однако, во-первых, указанные данные аллергологического обследования могут измениться уже через 2–3 недели, а во-вторых, если причинно-значимые аллергены не являются пищевыми, то ликвидировать контакт с ними и, соответственно, добиться излечения пациента порой бывает практически невозможно. Кроме того, следует учитывать и все возрастающую роль в качестве этиологического начала при атопическом дерматите эндоаллергенов, образующихся, как правило, при различной патологии желудочно-кишечного тракта [4, 5, 8, 10].
Вышеуказанные обстоятельства не дают возможности эффективно препятствовать попаданию в организм ребенка даже тех аллергенов, этиологическую роль которых удалось установить. Указанная ситуация диктует необходимость разработки патогенетических подходов к терапии рассматриваемого страдания.
Суть патогенеза атопического дерматита сводится к усиленному выбросу биологически активных веществ, и прежде всего гистамина, из тучных клеток, который, в свою очередь, непосредственно инициирует развитие кожной аллергической реакции [4, 5, 7]. Способствует этому высокий уровень IgЕ-антител, обусловленный генетически запрограммированной направленностью функционирования иммунной системы с преимущественным ее переходом на Th2-ответ на антигенную стимуляцию [4, 5, 7, 10]. Именно последний и приводит к избыточной продукции IgЕ-антител [4, 10]. Данные антитела образуют множественные иммунные комплексы с причинно-значимыми аллергенами, после чего указанные иммунные комплексы разрушают мембраны тучных клеток, из которых в большом количестве выходят гистамин и другие биологически активные вещества [4, 7, 10]. В последнее время доказана и роль Th1-ответа в генезе аллергических реакций, и в частности в развитии атопического дерматита [11, 13].
В создавшейся ситуации в качестве патогенетической может быть использована терапия, блокирующая гистамин, а также направленная на укрепление и стабилизацию мембран тучных клеток. До недавнего времени ведущую роль при лечении атопического дерматита играли антигистаминные препараты первого поколения, основным используемым эффектом которых было блокирование рецепторов гистамина. К сожалению, указанные препараты обладают целым рядом побочных действий. В частности, они вызывают сонливость, чувство усталости, нарушение координации движений, концентрации внимания, головокружение, головные боли, понижение давления [7, 10]. Данных побочных действий лишены антигистаминные препараты второго и третьего поколения. При этом препараты третьего поколения в несколько раз активнее препаратов второго [7]. Одним из наиболее эффективных представителей первых является дезлоратадин — активный метаболит лоратадина, хорошо известного селективного блокатора Н1-гистаминовых рецепторов второго поколения. В настоящее время отечественной фирмой «Фармак» дезлоратадин производится под названием Эдем.
Целью настоящего исследования явилось изучение безопасности применения Эдема и эффективности его влияния на ведущие клинико-анамнестические проявления при атопическом дерматите в детском возрасте.
Материалы и методы исследования
Нами обследовано 36 детей в возрасте от 2 до 12 лет с атопическим дерматитом и 30 их здоровых сверстников, составивших группу контроля. У больных детей выяснялся характер наследственности по аллергической патологии и заболеваемости желудочно-кишечного тракта, анализировалась динамика клинических проявлений атопического дерматита под влиянием терапии Эдемом. Кроме того, до и после лечения Эдемом у всех детей изучалось содержание эозинофилов и лимфоцитов периферической крови; методом иммуноферментного анализа с использованием тест-систем ЗАО «Вектор Бест» (Россия) на иммуноферментном фотометре-анализаторе SUNRISE (NECAN, Австрия) устанавливался уровень IgЕ в крови; с помощью метода Л.Я. Прошиной [9] устанавливалась концентрация в крови гистамина; с использованием метода В.Б. Гаврилова [1] в крови исследовалось содержание диеновых конъюгат (ДК); в реакции с a-тиобарбитуровой кислотой по образованию окрашенного тримежинового комплекса по методу М.С. Гончаренко, В.Н. Литвиновой [2] определяли концентрацию малонового диальдегида (МДА); методом J.N. Thompson et al. [14] в модификации Р.Г. Черняускене [12] в сыворотке крови по флюоресценции в гексановом экстракте сыворотки исследовался уровень a-токоферола и с помощью метода М.А. Королюк и соавт. [6] по способности перекиси водорода образовывать окрашенный комплекс с солями молибдена с измерением оптической плотности на спектометре СПФ-43 («ЛОМО», Санкт-Петербург, Россия) изучалась активность каталазы. На проведение всех исследований получено разрешение комиссии по биоэтике Донецкого национального медицинского университета им. М. Горького. Все исследования были проведены в соответствии с этическими принципами, принятыми Хельсинкской декларацией и Качественной клинической практикой (GCP) относительно медицинского исследования, которое проводится на людях. От родителей всех детей, которые принимали участие в исследовании, было получено письменное информированное согласие на проведение исследований. Статистическая обработка полученных результатов проводилась с помощью методов вариационной статистики с использованием пакета прикладных программ Microsoft Excel.
Результаты и их обсуждение
Проведенное исследование позволило констатировать различные проявления атопического дерматита у обследованных детей. Так, у 58,3 % пациентов отмечалась папулезная сыпь на коже туловища и конечностей, сочетавшаяся у двоих детей с явлениями нейродермита. У 26,1 % больных атопический дерматит проявлялся гиперемией отдельных участков кожи лица и туловища. При этом 87,5 % детей с кожной папулезной сыпью имели патологию желудочно-кишечного тракта. Чаще всего (в 62,5 % случаев) у них выявлялся дисбиоз кишечника, сочетавшийся в 18,8 % наблюдений с обострением хронического холангита. Четверть пациентов с атопическим дерматитом в виде папулезной сыпи имели дискинезию желчевыводящих путей. Чрезвычайно важным обстоятельством является развитие экземы у двоих пациентов с патологией желудочно-кишечного тракта в виде хронического колита. У обследованных детей с атопическим дерматитом, проявлявшимся гиперемией кожных покровов лица и туловища, во всех случаях определялась четкая связь манифестации патологического процесса с пищевыми аллергенами, среди которых наибольшую значимость имели клубника, малина, абрикосы, персики, арбузы, томаты, морковь, орехи, яйца, рыба, мясо курицы, творог. Кроме того, у 11,1 % обследованных пациентов нами констатировалась аллергическая реакция на прием медикаментов (жаропонижающие средства, антибиотики) в виде геморрагической сыпи на коже лица и туловища.
Следует отметить, что у 30,6 % больных детей регистрировался повторный эпизод атопического дерматита. При этом анамнез тактики ведения данной группы пациентов при развитии предыдущих эпизодов позволил установить недостаточность обследования больных, что не давало возможности в ряде случаев выявить причины кожных аллергических проявлений и, соответственно, назначить адекватную терапию; неполный комплекс терапевтических мероприятий, использование в качестве антигистаминных средств только препаратов первого поколения.
Немаловажные особенности обследованных детей с атопическим дерматитом удалось обнаружить при выяснении характера наследственности. В частности, у 61,1 % пациентов один или оба родителя страдали проявлениями атопического дерматита. В 19,4 % случаев у одного из родителей, а в 16,7 % наблюдений — у ближайших родственников по отцовской либо материнской линии обследованных больных имела место бронхиальная астма. Кроме того, 69,4 % пациентов имели ближайших родственников с различными хроническими заболеваниями желудочно-кишечного тракта.
Вышеизложенное свидетельствует о ведущей причинной значимости при возникновении атопического дерматита в детском возрасте хронической патологии пищеварительной системы, ряда пищевых аллергенов, некоторых лекарственных препаратов, неполноты и неадекватности терапевтических мероприятий при первых эпизодах аллергии, а также неблагоприятной наследственности по атопическому дерматиту, бронхиальной астме, заболеваниям желудочно-кишечного тракта.
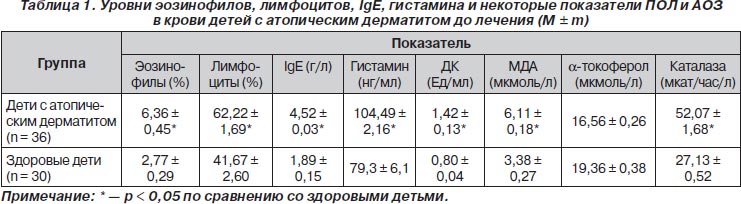
С целью выяснения особенностей вышеописанных патогенетических механизмов атопического дерматита у обследованных детей изучено содержание в крови эозинофилов, лимфоцитов, уровень IgЕ, гистамина, а также отражающих состояние перекисного окисления липидов (ПОЛ) мембран тучных клеток, диеновых конъюгат и малонового диальдегида и характер антиоксидантной защиты (АОЗ) a-токоферола и каталазы. Значения данных показателей у больных детей достоверно (р < 0,05) отличались от их значений у здоровых сверстников (табл. 1). При этом у 63,9 % пациентов регистрировалась эозинофилия, у 77,8 % больных — лимфоцитоз. В 80,6 % случаев у детей с атопическим дерматитом отмечалось повышение уровня IgЕ, в 88,9 % наблюдений — содержания гистамина. Состояние ПОЛ характеризовалось у 91,7 % обследованных больных превышением значений ДК, у 94,4 % — МДА. Из показателей АОЗ у обследованных детей с атопическим дерматитом в 86,1 % случаев выявлялось снижение уровня a-токоферола, в 88,9 % наблюдений — повышение активности каталазы.
Полученные результаты позволили констатировать у обследованных пациентов включение иммунных механизмов аллергического воспаления с выраженной активацией ПОЛ и угнетением АОЗ, следствием чего явилась дестабилизация клеточных мембран иммунокомпетентных клеток с высвобождением повышенных количеств гистамина. В связи с указанными обстоятельствами в качестве патогенетической терапии детей с атопическим дерматитом нами был выбран антигистаминный препарат третьего поколения Эдем, действующим веществом которого является дезлоратадин. Наш выбор был продиктован наибольшим среди антигистаминных препаратов сродством Эдема к Н1-рецепторам гистамина, способностью к стабилизации клеточных мембран, дополнительными противовоспалительными свойствами, отсутствием седативного эффекта, тахифилаксии, большой продолжительностью (27 часов) терапевтического эффекта. Обследованным больным Эдем назначался в сиропе 1 раз в сутки независимо от приема пищи: детям от 2 до 6 лет — по 2,5 мл, детям старше 6 лет — по 5 мл на протяжении 14 дней.
Все пациенты были повторно обследованы после окончания курса лечения Эдемом. У всех детей с гиперемией кожных покровов и кожными геморрагическими элементами проявления атопического дерматита подверглись полному обратному развитию. Существенная положительная динамика под влиянием Эдема зарегистрирована и в отношении папулезных аллергических высыпаний у лиц с сопутствующей хронической патологией желудочно-кишечного тракта. В частности, ни у кого из них не отмечалось появления новых элементов сыпи. У 89,1 % больных данной группы, в том числе у детей с нейродермитом и экземой, сыпь побледнела. В 10,9 % случаев констатировано ее полное угасание.
Отчетливая положительная динамика получена у обследованных детей с атопическим дерматитом и в отношении содержания в крови эозинофилов, лимфоцитов, IgЕ, гистамина, показателей ПОЛ и АОЗ (рис. 1). Так, в 65,2 % случаев констатирована нормализация уровня эозинофилов, в 78,6 % наблюдений — лимфоцитов, у 86,2 % пациентов — IgЕ, у 71,8 % — гистамина. Кроме того, у 42,4 % детей с атопическим дерматитом нормализовалось содержание ДК, у 76,5 % больных — МДА, в 70,9 % случаев — a-токоферола, в 76,5 % наблюдений — каталазы.
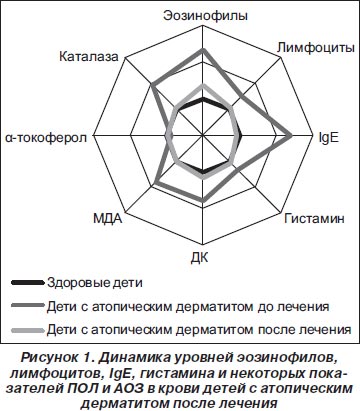
Результаты динамического лабораторного обследования позволяют связать обратное развитие клинической симптоматики кожных аллергических проявлений у больных детей прежде всего с угнетением аллергической воспалительной реакции, что, в свою очередь, обусловлено выраженным антигистаминным эффектом Эдема. Четкая тенденция к нормализации параметров ПОЛ и АОЗ под влиянием Эдема свидетельствует об очевидном мембраностабилизирующем эффекте данного препарата. Стабилизация же мембран тучных клеток при применении Эдема позволяет добиться уменьшения выброса из них гистамина.
Таким образом, проведенное исследование доказало наличие значительного антигистаминного эффекта у препарата Эдем, обусловленного не только блокадой Н1-рецепторов гистамина, но и снижением выделения последнего из тучных клеток в результате стабилизации их мембран. Установленные обстоятельства позволяют рекомендовать Эдем в качестве высокоэффективного и безопасного средства лечения при различных патогенетических вариантах атопического дерматита в детском возрасте.
1. Гаврилов В.Б. Измерение диеновых конъюгатов в плазме крови по УФ-поглощению гептановых и изопропиловых экстрактов / В.Б. Гаврилов, А.Р. Гаврилова, Н.Ф. Хмара // Лабораторное дело. — 1988. — № 2. — С. 60-64.
2. Гончаренко М.С. Метод оценки перекисного окисления липидов / М.С. Гончаренко, В.Н. Литвинова // Лабораторное дело. — 1985. — № 1. — С. 60-61.
3. Гущин И.С. Антигистаминные препараты: Пос. для врачей / И.С. Гущин. — М., 2000. — 64 с.
4. Детская аллергология: Рук-во для врачей / Под ред. А.А. Баранова, И.И. Балаболкина. — М.: Изд. группа «ГЭОТАР-Медиа», 2006. — 687 с.
5. Дранник Г.Н. Клиническая иммунология и аллергология / Г.Н. Дранник. — Одесса: Астро Принт, 1999. — 604 с.
6. Королюк М.А. Метод определения активности каталазы / М.А. Королюк, Л.И. Иванова, И.Г. Майорова и др. // Лабораторное дело. — 1988. — № 1. — С. 16-19.
7. Недельская С.Н. Аллергия и антигистаминные препараты / С.Н. Недельская, Т.Г. Бессикало // Новости медицины и фармации. — 2007. — № 8. — С. 3-4.
8. Охотникова Е.Н. Вопросы, которые часто задают педиатры детскому аллергологу / Е.Н. Охотникова // Современная педиатрия. — 2006. — Т. 12, № 3. — С. 148-150.
9. Прошина Л.Я. Определение гистамина и серотонина в одной пробе крови / Л.Я. Прошина // Лабораторное дело. — 1981. — № 2. — С. 90-93.
10. Пыцкий В.И. Аллергические болезни / В.И. Пыцкий, Н.В. Адрианова, А.В. Артомасова. — М.: Триада-Х, 1999. — 470 с.
11. Чернишов П.В. Експресія хемокінових рецепторів та продукція внутрішньоклітинних цитокінів Т-лімфоцитами-хелперами як єдина система в імуногенезі атопічного дерматиту та її зв’язок з клінічним перебігом захворювання / П.В. Чернишов // Український медичний часопис. — 2009. — № 2. — С. 108-110.
12. Черняускене Р.Г. Одновременное флюориметрическое определение концентрации витаминов Е и А в сыворотке крови / Р.Г. Черняускене // ПИК ВИНИТИ ЦИОКТ. — 1982. — № 5. — С. 1-3.
13. Shimada Y. Both Th2 and Th1 hemokines (TARC/CCL17, MDC/CCL22 and Mig/CXCL9) are elevated in sera from patients with atopic dermatitis / Y. Shimada, K. Takehara, S. Sato // J. Dermatol. Sci. — 2004. — Vol. 34, № 3. — P. 201-208.
14. Thompson J.N. Simultaneous fluorometric determinations of vitamin A and E human serum and plasma // J.N. Thompson, P. Erdody, W.B. Maxwell // Biochen. Med. — 1973. — Vol. 8, № 3. — P. 403-414.