Журнал «Здоровье ребенка» 4 (31) 2011
Вернуться к номеру
Ремоделирование сердца как результирующая метаболических и гемодинамических влияний у подростков с избыточной массой и ожирением
Авторы: Сенаторова А.С., Чайченко Т.В., Харьковский национальный медицинский университет
Рубрики: Педиатрия/Неонатология
Версия для печати
С целью совершенствования диагностики стадий ремоделирования сердца обследовано 100 подростков в возрасте от 10 до 18 лет с избыточной массой тела и ожирением. Установлено, что процесс ремоделирования в виде увеличения индекса массы миокарда и толщины межжелудочковой перегородки инициируется уже при избыточной массе тела на начальной стадии инсулинорезистентности при повышении систолического и диастолического артериального давления в ночное время. Раннее вовлечение в процесс ремоделирования межжелудочковой перегородки на фоне метаболических расстройств является причиной нарушения ее кинетики и, по-видимому, является специфичным для метаболической кардиомиопатии при ожирении. Колебания артериального давления на фоне повышения его средних и максимальных значений могут рассматриваться как гемодинамическая компенсаторная «антиремоделирующая» реакция.
Ожирение, избыточная масса тела, подростки, ремоделирование сердца.
Актуальность
Ремоделирование сердца — молекулярные, клеточные, интерстициальные изменения, которые манифестируют клинически в виде изменений размера, формы и функции сердца вследствие повреждения или стресса [1]. Гипертрофия миокарда является наиболее распространенным вариантом ремоделирования сердца, поскольку кардиомиоциты увеличиваются в размерах компенсаторно с целью поддержания сердечного выброса.
Ремоделирование при ожирении имеет две основные причины — гемодинамическую и метаболическую [2]. Метаболическая предрасположенность заключается в прямом воздействии регулирующих метаболитов, отложении адипоцитов между волокнами миокарда с возможным прямым токсическим влиянием.
Избыточное накопление жировой ткани у подростков происходит не за счет увеличения числа адипоцитов (как во внутриутробном периоде и раннем возрасте), а за счет увеличения их размеров, что, учитывая факт экспрессированности инсулиновых рецепторов на адипоцитах, ведет к снижению плотности этих рецепторов и формированию инсулинорезистентности (ИР), которая, в свою очередь, вызывает компенсаторный гиперинсулинизм. ИР ведет к снижению уровня поступающего в клетку инсулина с последующим энергодефицитом в инсулинозависимых тканях и компенсаторной стимуляцией симпатоадреналовой системы с активацией ренин-ангиотензин-альдостероновой системы с последующим повышением артериального давления (АД) и формированием компенсаторной гипертрофии из-за увеличения нагрузки на миокард.
Цель настоящего исследования — совершенствование диагностики стадий ремоделирования сердца у подростков с избыточной массой тела и ожирением.
Материал и методы исследования
Под наблюдением находилось 100 подростков в возрасте от 10 до 18 лет с избыточной массой тела и ожирением. Проводилось стандартное антропометрическое исследование. Диагноз устанавливался согласно международным рекомендациям и действующему украинскому протоколу диагностики и лечения эндокринных заболеваний у детей. Среди обследованных — 60 мальчиков и 40 девочек. Подростки были разделены на 3 группы относительно перцентильного значения индекса массы тела: с избыточной массой тела (+ 1 стандартное отклонение (СО)) и ожирением (+ 2–3 СО и + > 3 СО) при отсутствии достоверной разницы в возрасте (р > 0,05).
Для характеристики углеводного обмена оценивали уровень глюкозы и инсулина натощак с расчетом индекса тощаковой инсулинорезистентности НОМА, а также проводили стандартный оральный глюкозотолерантный тест.
Эхокардиография проводилась с использованием ультразвуковых аппаратов Sigma-21 (Kontron, Франция) и AU-3 Partner (фирмы Esaote Biomedica, Италия) с оценкой толщины задней стенки левого желудочка, толщины межжелудочковой перегородки (ТМЖП), линейных размеров левого и правого желудочков с расчетом конечного систолического и диастолического объемов левого желудочка, диаметров правого и левого предсердий, кинетики стенок в разные фазы сердечного цикла, с расчетом параметров систолической функции левого желудочка. Использовалась методика эхокардиоскопии, рекомендованная Американским эхокардиографическим сообществом [3] с расчетом базовых параметров согласно методике L. Teicholz.
Индекс массы миокарда (ИММ) рассчитывали по формуле [4], общую толщину стенок (ОТС) по формуле Сanau (1992) [5], для характеристики геометрии левого желудочка использовали метод P. Verdecchia (1994) [6].
Всем обследованным проводилось измерение офисного артериального давления (АД). Диагноз АГ устанавливался согласно The Fourth Report on the diagnosis, evaluation and treatment of high blood pressure in children and adolescents [7]. При проведении суточного мониторирования артериального давления использовали стандартные нормативы для детей подросткового возраста [8].
Полученные данные анализировались с помощью стандартных методов статистического анализа с использованием персонального компьютера с применением пакета прикладных программ Microsoft Office Exсel.
Результаты и обсуждение
В ходе настоящего исследования установлено, что избыточное жироотложение происходит по абдоминальному типу у всех обследованных подростков и ассоциируется с формированием инсулинорезистентности, а затем гиперинсулинизма на фоне инсулинорезистентности.
Пороговое значение (95-й перцентиль) по показателю индекса массы миокарда для детей старше 9 лет в норме составляет для девочек 40 г/м2,7, а для мальчиков 45 г/м2,7. По нашим данням, у подростков с избыточной массой тела его значение — 28,313 ± 1,230 г/м2,7, при ожирении +2–3 СО — 42,611 ± 1,210 г/м2,7, а при ожирении + > 3 СО — 49,62 ± 2,88 г/м2,7. Причем разница между группами (р < 0,001 и p < 0,05 соответственно) является достоверной и свидетельствует о нарастании гипертрофии миокарда в зависимости от степени избытка массы.
Проведенный по формуле Canau расчет общей толщины стенок (ОТС) выявил преимущественно эксцентрическую гипертрофию миокарда левого желудочка — значение ОТС 0,311 ± 0,040 при избытке массы 1–2 СО; 0,328 ± 0,011 при +2–3 СО; 0,333 ± 0,025 при + > 3 СО без достоверной разницы значений между группами.
Характеристика геометрии левого желудочка по методу P. Verdecchia подразумевает дополнительный расчет ОТС межжелудочковой перегородки (ОТС МЖП) и ОТС задней стенки левого желудочка (ОТС ЗСЛЖ). По нашим данным, среднее значение ОТС ЗСЛЖ составило менее 0,45 и не имело достоверной разницы в группах (p > 0,05). В то же время обращает на себя внимание прогрессирующее увеличение ОТС МЖП в зависимости от степени избытка массы: 0,345 ± 0,009 при избытке массы 1–2 СО; 0,397 ± 0,007 при + 2–3 СО; 0,400 ± 0,021 при + > 3 СО с достоверной (p < 0,01, p < 0,05) разницей между группами. Значимым представляется факт утолщения МЖП на фоне достоверного увеличения полости левого желудочка в диастолу, что в некоторой степени занижает абсолютный прирост толщины МЖП.
Таким образом, значимым компонентом гипертрофии миокарда левого желудочка сердца у обследованных является изменение морфологии межжелудочковой перегородки. Проанализировав детально толщину МЖП на ее протяжении, пришли к выводу о преимущественной гипертрофии в апикальной части у 53 % подростков с ожирением, что согласуется с литературными данными [9, 10].
Исходная оценка уровней офисного АД продемонстрировала его повышение более 95-го перцентиля относительно пола и роста у 49,5 ± 8,3 % подростков с избыточной массой тела, у 61,3 ± 4,4% подростков с ожирением при ИМТ в диапазоне + 2–3 СО и у 69,7 ± 7,3 % подростков с ИМТ в диапазоне + > 3 СО.
По нашим данным, количество лиц с нормальным артериальным давлением прогрессивно уменьшается в зависимости от степени избытка массы тела с одновременным увеличением доли более тяжелых форм АГ. Интересным представляется факт отсутствия достоверной разницы в доле гипертензии «белого халата» в каждой из групп.
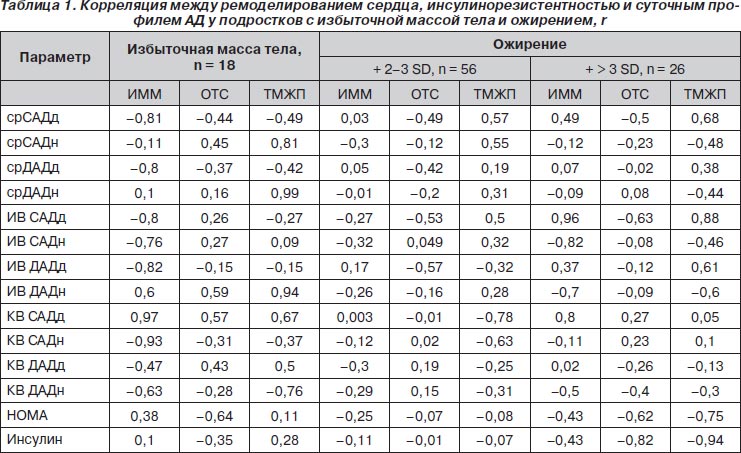
Исходя из факта вторичности изменений в миокарде по отношению к инсулинорезистентности с энергодефицитом и компенсаторной гиперсимпатикотонией с последующим повышением уровней артериального давления, провели анализ зависимости геометрических параметров от ИР и суточных профилей АД (табл. 1).
Как видно из представленных данных, наиболее значимо гемодинамическое влияние (преимущественно уровень и вариабельность ДАД) на увеличение массы миокарда как за счет общей толщины стенок, так и ТМЖП у пациентов с избыточной массой тела в присутствии инсулинорезистентности. То есть уже при избыточной массе тела начинается процесс ремоделирования сердца. Причем ночные воздействия САД и ДАД напрямую связаны с увеличением ТМЖП.
При дальнейшем увеличении массы тела на увеличение ТМЖП влияют уровни САД как днем, так и ночью, а также длительность повышенного САД. Интересным представляется факт сильной отрицательной зависимости ТМЖП с вариабельностью давления в ночное время. То есть высокая вариабельность АД при условии его повышения может рассматриваться как проявление компенсации, направленной на предупреждение дальнейшего эксцентрического ремоделирования.
У пациентов со значительным увеличением массы тела (+> 3 СО) длительность повышенного САД при увеличении его вариабельности продолжает оказывать «проремоделирующий эффект» преимущественно за счет ТМЖП, а колебания ДАД — «антиремоделирующий». Причем значимость инсулинорезистентности и гиперинсулинизма на этой стадии максимальна.
В литературе имеются описания колебания диастолического АД у пациентов с ожирением и предполагается их гемодинамическая и метаболическая значимость [11], в том числе и ассоциированность с инсулинорезистентностью [12]. Однако не проводятся четкие параллели со стадийностью ремоделирования. В то же время результаты недавно проведенного исследования у взрослых женщин свидетельствуют в пользу ремоделирования миокарда уже при увеличении ИМТ на 5 пунктов с предположением факта существования метаболитов с прямым кардиотоксическим влиянием [13], что, собственно, и подтверждается нашими данными, т.к. именно при неморбидном ожирении продолжается увеличение массы миокарда, но теряются корреляционные связи со стандартными патогенетическими факторами — инсулинорезистентностью и артериальной гипертензией. Таким образом, имеется необходимость в продолжении исследований в данном направлении.
Выводы
1. Метаболические нарушения, ассоциированные с избытком массы тела, ведут уже в подростковом периоде к формированию ремоделирования миокарда левого желудочка сердца, проявляющегося в виде прогрессивной дилатации его полости в диастолу, увеличения индекса массы миокарда, эксцентрического ремоделирования при избытке массы тела и эксцентрической гипертрофии миокарда при ожирении за счет преимущественно апикальной гипертрофии межжелудочковой перегородки с одновременной ее гипокинезией.
2. Процесс ремоделирования в виде увеличения ИММ и ТМЖП инициируется уже при избыточной массе тела на начальной стадии инсулинорезистентности при повышении САД и ДАД в ночное время.
3. Раннее вовлечение в процесс ремоделирования МЖП на фоне метаболических расстройств является причиной нарушения ее кинетики и, по-видимому, является специфичным для метаболической кардиомиопатии при ожирении.
4. Колебания артериального давления на фоне повышения его средних и максимальных значений могут рассматриваться как гемодинамическая компенсаторная «антиремоделирующая» реакция.
5. Терапевтическое воздействие как на метаболизм, так и на гемодинамику должно начинаться при избыточной массе тела, когда возможно предупреждение дальнейшего ремоделирования миокарда.
1. Cohn J.N., Ferrari R., Sharpe N. Cardiac remodeling-concepts and clinical implications: a consensus paper from an international forum on cardiac remodeling. Behalf of an International Forum on Cardiac Remodeling // J. Am. Coll. Cardiol. — 2000. — 35. — 569.
2. Hutan Ashrafian, Thanos Athanasiou, Carel W le Roux. Heart remodelling and obesity: the complexities and variation of cardiac geometry // Heart. — 2011. — 97. — 171-172. 5ad doi:10.1136/hrt.2010.207092 Editorial
3. Leo Lopez, Steven D. Colan, Peter C. Frommelt et al. Recommendations for Quantification Methods During the Performance of a Pediatric Echocardiogram: A Report From the Pediatric Measurements Writing Group of the American Society of Echocardiography Pediatric and Congenital Heart Disease Council // J. Am. Soc. Echocardiogr. — 2010. — 23. — 465-95.
4. Khoury P.R., Mitsnefes M., Daniels S.R., Kimball T.R. Age-specific refernce intervals for indexed left ventricular mass in children // J. Am. Soc. Echocardiogr. — Jun 2009. — 22(6). — 709-14.
5. Canau A., Devereux R.B., Roman M.J. et al. Petterns of left ventricular hypertrophy and geometric remodeling in essential hypertension // J. Am. Coll. Cardiol. — 1992. — 19. — 1550-1558.
6. Verdecchia P., Porcellati C., Zampi I. et al. Asymmetric left ventricular remodeling due to isolated septal thickening in patients with systemic hypertension and normal left ventricular masses // Am. J. Cardiol. — 1994. — 73. — 247-252.
7. The Fourth Report on the diagnosis, evaluation and treatment of high blood pressure in children and adolescents // Pediatrics. — Aug 2004. — Vol. 114, № 2.
8. Soergel M., Kirschstein M., Busch C. et al. Oscillometric twenty-four-hour ambulatory blood pressure values in healthy children and adolescents: a multicenter trial including 1141 subjects // J. Pediatr. — Feb 1997. — 130(2). — 178-84.
9. Строгий В.В., Амбросимова Н.Н. Функциональное состояние сердца у детей с артериальной гипертензией и ожирением // Современная педиатрия. — 2009. — № 1(23). — С. 117-120.
10. Khositseth A., Suthutvoravut U., Chongviriyaphan N. Left ventricular mass and geometry in obese children // Asian J. Clin. Nutr. — 2009. — 1. — 58-64.
11. Ruiz Pons M., Garcнa Nieto V., Glez M. Garcнa et al. Reduced nocturnal systolic blood pressure dip in obese children // Nefrologнa. — 2008. — 28(5). — 517-524.
12. Marcovecchio M.L., Patricelli L., Zito M. et al. Ambulatory blood pressure monitoring in obese children: role of insulin resistance // Journal of Hypertension. — 2006. — 24(12). — 2431-6.
13. Rider O.J., Petersen S.E., Francis J.M. et al. Ventricular hypertrophy and cavity dilatation in relation to body mass index in females with uncomplicated obesity // Heart. — 2011. — 97. — 203–8.5cc.