Журнал «Здоровье ребенка» 4 (31) 2011
Вернуться к номеру
Биохимические маркеры костного метаболизма у детей с патологией щитовидной железы
Авторы: Каладзе Н.Н., Иванова Ф.Е. Детский санаторно-оздоровительный центр «Дружба», г. Евпатория, АР Крым
Рубрики: Педиатрия/Неонатология
Версия для печати
обследована группа детей с патологией щитовидной железы, находившихся на санаторно-курортной стадии реабилитации. Обнаружены однонаправленные изменения ремоделирования костной ткани, определяемые по уровню биохимических маркеров при диффузном зобе, аутоиммунном тиреоидите, раке щитовидной железы. У больных с гипотиреозом снижена скорость обеих составляющих ремоделирующего цикла — костной резорбции и костного формирования.
Заболевания щитовидной железы, дети, биохимические маркеры.
Костная ткань (КТ) представляет собой динамическую систему. В ней на протяжении всей жизни человека протекают два разнонаправленных и взаимосвязанных процесса: резорбция старой кости остеокластами и формирование новой кости остеобластами. Причем в физиологических условиях эти процессы строго сбалансированы [1–3].
В настоящее время накоплен материал, позволяющий считать, что среди факторов, оказывающих влияние на состояние метаболизма КТ, важную роль играет гормональный дисбаланс, возникающий при эндокринной патологии [1, 4, 5].
Паратиреоидный гормон (ПТГ), тироксин, кальцитриол (КТр) стимулируют процессы костного ремоделирования, а кальцитонин (КТн) подавляет этот процесс. Маркеры формирования КТ включают фермент щелочную фосфатазу (ЩФ) и побочные продукты синтеза костного матрикса, одним из которых является остеокальцин (ОКЦ) [4, 5].
Исследование тиреоидной функции и современные методы мониторинга костной массы и метаболизма КТ (денситометрия, биохимические маркеры костного обмена) позволили выявить тесную связь между костной массой, риском возникновения переломов костей и длительным избытком тиреоидных гормонов в организме. Снижение функции щитовидной железы (ЩЖ) также приводит к нарушению костного метаболизма [1].
Цель настоящего исследования — провести оценку ремоделирования костной ткани у детей с заболеваниями щитовидной железы по уровню биохимических маркеров резорбции и формирования кости.
Материал и методы
Проведено комплексное клинико-лабораторное обследование 200 детей с патологией ЩЖ, проходивших курс лечения в ДСОЦ «Дружба», в возрасте от 10 до 17 лет. Среди обследованных детей преобладали девочки — 138 (69 %) человек, что подтверждает их исключительно высокую заболеваемость, мальчиков было 62 (31 %). Контрольную группу (КГ) составили 30 детей I–II группы здоровья.
В структуре патологии щж удельный вес диффузного зоба (ДЗ) составил 40 % (80 чел.), аутоиммунного тиреоидита (АИТ) — 40 % (80 чел.), оперированных по поводу рака щитовидной железы (РЩЖ) — 20 % (40 чел.).
Длительность заболевания к моменту поступления детей в санаторий у подавляющего большинства находилась в пределах от 2 до 4 лет — 87 (43,5 %) детей, срок заболевания от 1 до 2 лет имел 51 (25,5 %) пациент, с длительностью заболевания свыше 4 лет наблюдались 62 (31 %) ребенка.
Исследование структурно-функционального состояния костной ткани (СФС КТ) у детей с заболеваниями ЩЖ проводилось с помощью ультразвукового (УЗ) остеоденситометра Achilles+ (Lunar Corp. Madison, USA). Определяли показатели: скорость распространения УЗ (м/с), широкополосное ослабление УЗ (дБ/МГц), индекс прочности костной ткани (ИП КТ, %). Оценка полученных данных проводилась с использованием таблиц соответствующих возрастно-половых нормативных показателей детей Украины, составивших группу сравнения (n = 1495) [6].
Изучение кальций-фосфорного обмена проводили путем определения общего кальция (Саобщ), неорганического фосфора (Рнеорг) в сыворотке крови с помощью общепринятых унифицированных тест-систем на автоматическом биохимическом анализаторе Humalyzer 2000 производства Германии.
В сыворотке крови были исследованы уровни кальцийрегулирующих гормонов. ПТГ и КТн определяли с помощью наборов реактивов I-PTH ELISA (DSL, США) и Calcitonin ELISA (BIOMERICA, США). Уровень КТр в сыворотке крови определяли количественным методом иммуноферментного анализа (ИФА-методом) набором 1,25 Vitamin D ELISA (Immundiagnostik, Германия).
В качестве маркеров костеобразования в сыворотке крови исследовали уровни активности ЩФ и ОКЦ, последний — ИФА-методом набором N-MID Osteocalcin (Nordic Bioscience Diagnostics A/S, Канада).
Для оценки выраженности костной резорбции в утренней моче натощак определяли уровень дезоксипиридинолина (ДПД) набором Metra DPD EIA kit (Quidel Corporation, США) ИФА-методом в соотношении с содержанием креатинина (Сr) в этой же порции мочи.
Статистический анализ проводили с помощью программы Statistica 6.0 с использованием методов параметрической и непараметрической статистики.
Результаты и их обсуждение
Проведенный анализ СФС КТ показал, что у 31 % детей ИП КТ соответствовал возрастной норме — от –1 до +1 SD, у 61 % — от –1 до –2,5 SD (остеопения). В 8 % случаев выявлен остеопороз (ниже –2,5 SD).
Полученные нами результаты содержания биохимических маркеров в основном соответствовали референтным пределам показателей у практически здоровых лиц, приводимым в описании тест-систем. Однако с учетом рекомендаций по установлению собственного диапазона нормальных величин в дальнейшей работе полученные данные сравнивались с собственными результатами КГ детей соответствующего пола и возраста.
При исследовании состояния кальций-фосфорного гомеостаза у детей с заболеваниями ЩЖ в зависимости от нозологических форм были выявлены следующие изменения: достоверное снижение Саобщ при АИТ — 2,26 ± 0,02 ммоль/л (р < 0,05); достоверное снижение Рнеорг в группах детей с ДЗ, АИТ, РЩЖ — 1,29 ± 0,03 (р < 0,001), 1,34 ± 0,03 (р < 0,001), 1,42 ± 0,06 ммоль/л (р < 0,05) соответственно в сравнении с КГ. Содержание Саобщ в сыворотке крови обследованных не зависело от гормонального фона ЩЖ, а содержание в сыворотке крови Рнеорг показало достоверное снижение данного показателя в группах детей с гипо- и эутиреозом (1,33 ± 0,05; 1,34 ± 0,02 ммоль/л (р < 0,001) соответственно) и повышение этого показателя в группе с гипертиреоидным состоянием (1,49 ± 0,15 ммоль/л (р < 0,05)) в сравнении с КГ.
На костную резорбцию влияют три основных гормона — ПТГ, КТр и КТн; первые два — увеличивают, последний — уменьшает резорбцию [4].
Анализ данных зависимости уровня исследуемых гормонов от нозологических форм выявил, что все показатели были достоверно ниже, чем средний показатель КГ (рис. 1). Так, средние показатели ПТГ, КТр и КТн при ДЗ составляли 42,48 ± ± 0,50 пг/мл (р < 0,01), 48,74 ± 0,71 пг/мл и 7,80 ± 0,47 пг/мл (р < 0,001) соответственно; у детей с АИТ — 42,47 ± 0,45 пг/мл (р < 0,05), 48,58 ± 0,71 пг/мл (р < 0,001), 7,40 ± 0,45 пг/мл (р < 0,05) соответственно. У детей, оперированных по поводу РЩЖ, уровень ПТГ — 41,54 ± 0,47 пг/мл (р < 0,005), КТр — 45,58 ± 1,16 пг/мл (р < 0,001).
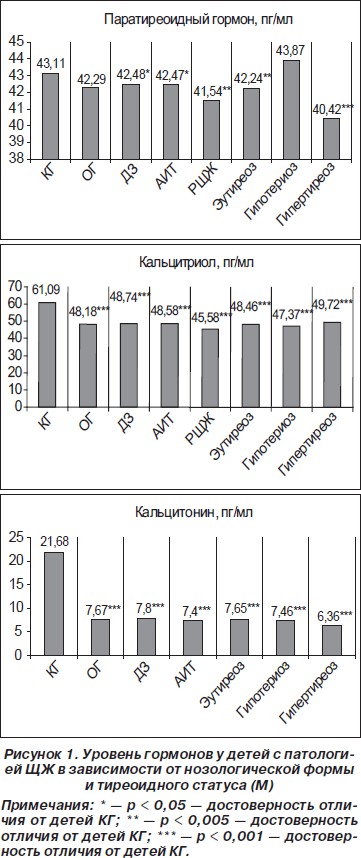
В зависимости от тиреоидного статуса (рис. 1) отмечались следующие изменения. Так, при эутиреоидном состоянии показатели ПТГ, КТр и КТн были достоверно ниже, чем в КГ (42,24 ± 0,33 пг/мл (р < 0,005), 48,46 ± 0,71 пг/мл (р < 0,001) и 7,65 ± ± 0,39 пг/мл (р < 0,001) соответственно). При гипертиреоидном состоянии показатели ПТГ, КТр и КТн (40,42 ± 0,66 пг/мл (р < 0,001), 49,72 ± 3,49 пг/мл (р < 0,001) и 6,36 ± 0,83 пг/мл (р < 0,001) соответственно) были достоверно ниже, чем в КГ. При гипотиреоидном состоянии показатель ПТГ достоверно не отличался от такового КГ (43,87 ± 0,63 пг/мл), но был достоверно выше, чем у детей с эутиреоидным и гипертиреоидным состоянием (р < 0,005 и р < 0,001 соответственно). Уровни КТр и КТн были достоверно ниже КГ (47,37 ± 1,33 пг/мл, 7,46 ± 0,67 пг/мл (р < 0,001) соответственно).
Часто для оценки активности костеобразования используют определение ЩФ в сыворотки крови, но этот показатель недостаточно информативен для оценки костной патологии. При анализе ЩФ по исследуемым группам достоверных различий в сравнении с КГ и между ними не выявлено.
На сегодняшний день одним из основных биохимических маркеров, отражающих активность остеобластов, является ОКЦ.
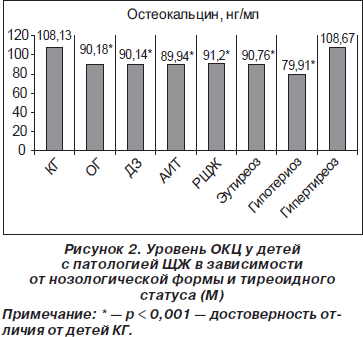
При всех исследуемых нозологических формах патологии ЩЖ отмечено достоверное (р < 0,001) снижение среднего показателя ОКЦ по сравнению с КГ: при ДЗ — 90,14 ± 1,07 нг/мл, при АИТ — 89,94 ± 1,33 нг/мл, у детей, оперированных по поводу РЩЖ, — 91,20 ± 1,37 нг/мл (рис. 2). Уровень ОКЦ в сыворотке крови у детей с патологией ЩЖ зависел от особенностей тиреоидного статуса организма ребенка. Средние значения данного показателя были достоверно ниже (р < 0,001) у детей с гипотиреоидным состоянием (79,91 ± 1,21 нг/мл) в сравнении с детьми с эутиреоидным и гипертиреоидным состоянием (90,76 ± 0,75 и 108,67 ± 2,36 нг/мл соответственно) (рис. 2).
Одним из информативных маркеров костной резорбции считается определение ДПД, соотнесенного с концентрацией Сr в моче.
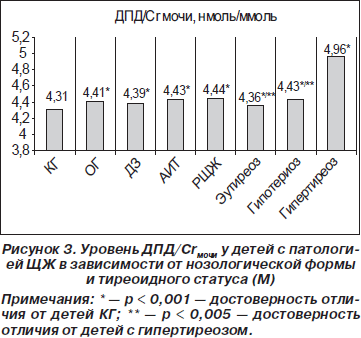
При всех исследуемых нозологических формах патологии ЩЖ отмечено достоверное (р < 0,001) повышение среднего показателя маркера остеорезорбции в отличие от КГ: при ДЗ — 4,39 ± 0,10, при АИТ — 4,43 ± 0,09, при РЩЖ — 4,44 ± 0,13 нмольДПД/ммольСr (рис. 3). В зависимости от особенностей тиреоидного статуса организма ребенка средние значения данного показателя были достоверно выше (р < 0,001) у детей с гипертиреоидным состоянием (4,96 ± 0,19 нмольДПД/ммольСr) в сравнении с детьми с эутиреоидным и гипотиреоидным состоянием (4,36 ± 0,07 и 4,43 ± 0,13 нмольДПД/ммольСr соответственно) (рис. 3).
Выводы
Анализ полученных данных свидетельствовал, что у детей с патологией ЩЖ имеются нарушения гормональной регуляции процессов костеобразования и резорбции. Исследование фосфорно-кальциевого обмена у пациентов с патологией ЩЖ показало, что исходный уровень Саобщ (р < 0,05) и Рнеорг (р < 0,001) был достоверно ниже при АИТ по сравнению с КГ. Данные изменения возникают потому, что тиреоидные гормоны участвуют в регуляции обмена кальция, и дисбаланс последних, который наиболее ярко выражен при АИТ, отражается на дисбалансе основных процессов костного ремоделирования. У больных с гипотиреоидным состоянием в ремоделировании так же, как и в других группах, преобладали процессы резорбции, однако в сравнении с группой детей с гипертиреоидным состоянием выявлено снижение процессов резорбции, сопровождающееся более выраженным снижением костеобразования. Полученные данные могут быть расценены как влияние самого заболевания, измененного гормонального статуса ЩЖ на костное ремоделирование.
1. Рожинская Л.Я. Системный остеопороз. — Москва, 2000. — 177 с.
2. Беневолевская Л.И. Руководство по остеопорозу. — М.: БИНОМ. Лаборатория знаний, 2003. — 524 с.
3. Риггс Б.Л., Мелтон III Л.Дж. Остеопороз. — М.; СПб.: Невский диалект, 2000. — 560 с.
4. Поворознюк В.В. Остеопороз та біохімічні маркери метаболізму кісткової тканини // Лабораторна діагностика. — 2002. — № 1. — С. 53-61.
5. Олейник В.А., Поворознюк В.В., Терехова Г.Н., Орленко В.Л. Эндокринный остеопороз // Проблеми остеології. — 2000. — Т. 3, № 1. — С. 65-78.
6. Поворознюк В.В. Віленський А.Б., Григор’єва Н.В. Остеопенічний синдром у дітей та підлітків: фактори ризику, діагностика, профілактика: методичний посібник. — Київ, 2001. — 28 с.
