Журнал «Здоровье ребенка» 4 (31) 2011
Вернуться к номеру
Метод энтеросорбции в лечении синдрома интоксикации
Авторы: Юлиш Е.И., Кривущев Б.И. Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Версия для печати
Работа посвящена роли развития токсического синдрома и эндоинтоксикации в патогенезе инфекционных и неинфекционных заболеваний. Рассмотрен метод энтеросорбции в лечении эндотоксикоза.
Эндотоксикоз, энтеросорбция, сорбенты.
Интоксикация (лат. in — в, внутрь; греч. toxikon — яд) — нарушение жизнедеятельности, вызванное токсическими веществами, поступающими в организм извне (экзогенная интоксикация) или образующимися в нем (эндогенная интоксикация). Экзогенную интоксикацию часто отождествляют с понятием «отравление», эндогенную обозначают терминами «аутоинтоксикация», «эндотоксикоз», и вызывается она продуктами метаболизма, формирующимися в организме в динамике развития различных патологических состояний, во многом и определяющих тяжесть и исход болезни. Исследование процессов сорбции при моделировании в эксперименте дает возможность определить хронобиологическую последовательность формирования эндотоксикоза: из источника токсемии (толстая кишка) эндогенные патологические субстанции через кровь, где они связываются белковыми молекулами плазмы (альбумином и липопротеидами), попадают в органы фиксации и биотрансформации (печень, иммунная система, легкие), органы выведения (печень, почки, желудочно-кишечный тракт, легкие, кожа), а также в органы и ткани депонирования (жировая ткань, нервная система, костная ткань, органы эндокринной системы, лимфоидная ткань) [1]. Этот синдром сопутствует большому количеству заболеваний, следовательно, является по своему происхождению мультифакторным и развивается при накоплении эндотоксинов разного происхождения и состава. Сюда относят продукты естественного обмена в высоких концентрациях, активированные ферменты, медиаторы воспаления, класс среднемолекулярных веществ разной природы, перекисные продукты и другие биологически активные вещества, разнородные по составу ингредиенты нежизнеспособных тканей, агрессивные компоненты комплемента, бактериальные экзо- и эндотоксины.
В инфекционной патологии чаще всего синдром эндогенной интоксикации встречается при кишечных инфекциях, возбудители которых определяют накопление эндотоксинов — липополисахаридов, связанных с наружной мембраной бактерий и состоящих из липида A, полисахаридного ядра и боковой цепи — O-полисахарида. Наиболее значимы эндотоксины грамотрицательных бактерий. На внешней стенке одной грамотрицательной бактерии может содержаться до 3,5 млн молекул липополисахаридов. После гибели клеток эндотоксины этих бактерий остаются биологически активными молекулами. Помимо липополисахаридов, в состав внешней стенки грамотрицательных бактерий входят и белки, так как внешняя мембрана на 3/4 состоит из липополисахаридов, а 1/4 приходится на белковые компоненты. Эти белки вместе с липополисахаридами образуют белково-липополисахаридные комплексы разного размера и молекулярной массы. Эти комплексы и называют бактериальными эндотоксинами, и именно они обеспечивают структурную целостность бактерий, определяют патогенные и антигенные свойства бактерий [2].
Образующиеся в желудочно-кишечном тракте эндотоксины вызывают деструкцию белков и липидов клеток хозяина, блокируют синтетические и окислительные процессы. Эндотоксины оказывают прямое и опосредованное воздействие на структуру клеток, системы и органы (отдаленное действие) [3].
По действию на уровне клеточных структур эндотоксины обладают цитолитическим эффектом; активируют лизосомальные ферменты; блокируют энергетические процессы в митохондриях; инициируют синтез свободных радикалов; ингибируют синтетические процессы в рибосомах. Отдаленное действие эндотоксинов выражается поражением системы микроциркуляции в виде изолированных вне- и внутрисосудистых расстройств и комбинированных изменений. Внесосудистые изменения касаются регуляции тонуса периферических сосудов, среди внутрисосудистых изменений основное место занимают нарушения реологического состояния крови, нарушения транскапиллярного и трансмембранного обмена.
Понятие «эндотоксин» указывает, что токсин — это часть клетки, а не секретируемое во внешнюю среду вещество. Эндотоксин является мощным стимулятором синтеза цитокинов, особенно фактора некроза опухоли (ФНО) и других провоспалительных интерлейкинов, которые, в свою очередь, активируют функции нейтрофилов, эндотелиальных клеток, тромбоцитов. Кроме того, эндотоксины вызывают выброс других медиаторов: фактора активации тромбоцитов, компонентов комплемента, кининов, гистамина, эндорфинов. То есть на фоне эндотоксикоза формируется так называемый «медиаторный хаос» с развитием клеточной гипоксии, нарушениями метаболических процессов. Образующиеся биологически активные вещества, воздействуя на сердечно-сосудистую систему, снижают общее периферическое сосудистое сопротивление, сосудистый тонус. Под влиянием бактериальных эндотоксинов происходит активация внутренних механизмов свертывания с развитием коагуляционных нарушений в микроциркуляторном русле, нарушение кровотока, ишемия тканей. В результате свертывания крови возникают тромбозы и эмболии мелких сосудов. Липид A, входящий в состав липополисахаридов, обусловливает лихорадку, ДВС-синдром и шок. Участвующие в этом процессе цитокины — ИЛ-1 и ФНО, вырабатываемые макрофагами, увеличивают сосудистую проницаемость, изменяют свойства эндотелия и, воздействуя на терморегуляторный центр гипоталамуса, вызывают гипертермию.
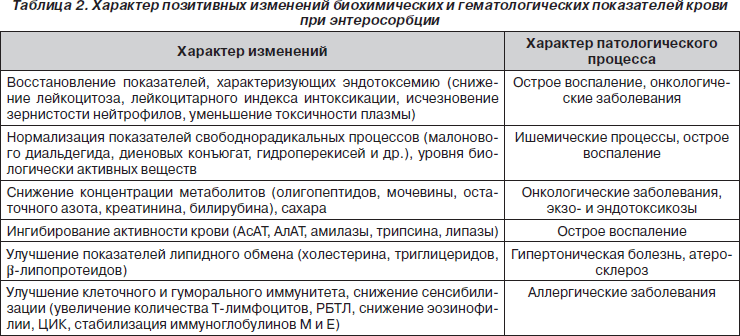
Эндотоксиновая агрессия квалифицируется как универсальный механизм, участвующий в патогенезе большинства заболеваний инфекционного и неинфекционного генеза [4]. Доказано значение патологии различных органов и систем желудочно-кишечного тракта (ферментопатии, хеликобактерная инфекция, нарушения микробиоценоза кишечника) в повреждении пищеварительного барьера слизистой оболочки ЖКТ, сопровождающемся снижением активности факторов неспецифической защиты, уменьшением продукции секреторного IgA, повышением накопления гистамина, кининов, провоспалительных цитокинов. Развивающийся при этом патологический процесс определяет увеличение проницаемости слизистой оболочки для токсинов, аллергенов, их усиленное всасывание с формированием хронического эндотоксического синдрома, что является одним из значимых пусковых механизмов сенсибилизации и реализации аллергического воспаления в коже [5, 6]. Согласно данным Б.А. Шамова с соавт. [4], концентрация плазменного эндотоксина при обострении атопического дерматита у детей превышает норму в десятки раз. Проведение терапии, купирующей патологические нарушения желудочно-кишечного тракта, снижающей активность эндотоксикоза, достоверно снижает активность и выраженность аллергического процесса [7].
О значимости эндоинтоксикации при рецидивирующих и латентных формах пиелонефрита, при почечной недостаточности у детей свидетельствуют исследования И.В. Багдасаровой с соавт. [8]. Определение маркеров эндотоксикоза — лейкоцитарного индекса интоксикации, активности аутологической сыворотки крови — позволило авторам прийти к выводу о значимости его в усугублении течения пиелонефритов. Это нашло подтверждение в эффективности элиминационной терапии методом энтеросорбции в комплексном лечении заболевания.
Развитие эндоинтоксикации (метаболической интоксикации) на фоне нарушений обменных процессов у больных с острой и хронический патологией печени различного генеза описано академиком Л.Л. Громашевским [9]. Накопление на этом фоне токсических продуктов, в частности молекул средней массы, во многом определяет исход заболевания. Энтеросорбция при печеночной недостаточности по эффективности сравнима с другими методами детоксикации. При ее использовании выявлено значимое уменьшение токсической и метаболической нагрузки на печень, что способствует купированию тяжести печеночной недостаточности [10]. На фоне энтеросорбции также отмечается нормализация пищеварительной функции кишечника и кишечного микробиоценоза.
Поскольку желудочно-кишечный тракт выполняет секретообразующую и выделительную функцию, инфекционно-воспалительные заболевания различных органов сопровождаются накоплением в кишечнике продуктов распада, токсинов, различных факторов, сопровождающих любой воспалительный процесс. То есть при тяжелом патологическом процессе, особенно инфекционно-воспалительного генеза, в кишечном тракте «складируются» продукты обмена токсического характера. Так, при ожогах [11] наряду с инвазией микроорганизмов в ожоговой ране выявляются микробные нарушения в кишечнике с нарушением процессов пищеварения, бактериальной обсемененностью, развитием синдромов мальдигестии и мальабсорбции, повышенным образованием бактериальных аминокислотных метаболитов (индол, скатол) и, как следствие, усугублением процесса эндоинтоксикации. И в этом случае усиление проницаемости кишечной стенки для образующихся эндотоксинов на протяжении длительного времени вызывает хронический токсикоз, создаются условия для сенсибилизации и аутоаллергизации организма. Присоединение кишечного эндотоксикоза характерно для гнойно-септических заболеваний — менингоэнцефалитов, перитонитов, абсцессов и т.д. в связи с имеющимся сбросом бактериальных токсинов из крови в желудочно-кишечный тракт [12–14].
Кишечные инфекции как вирусной, так и бактериальной этиологии всегда сопровождаются эндотоксикозом [15–17].
Тяжелый токсикоз вызывают и экзогенные соединения, попадающие в желудочный тракт извне. Это могут быть ядовитые вещества различного происхождения, а также ксенобиотики — тяжелые металлы, пестициды, препараты бытовой химии, красители, консерванты, лекарственные средства и т.д. [18].
Таким образом, эндотоксиновая агрессия квалифицируется как универсальный механизм, участвующий в патогенезе большинства заболеваний инфекционного и неинфекционного генеза, развивающийся при массивном поступлении эндотоксина на фоне недостаточной активности элиминирующих систем. При этом современные методы лечения, направленные на нейтрализацию эффектов эндотоксина (использование антител к липиду A и ФНО-a, блокаторов рецепторов ИЛ-1), малоэффективны. В этих условиях важную роль в комплексном лечении больных приобретают сорбционные методы [19].
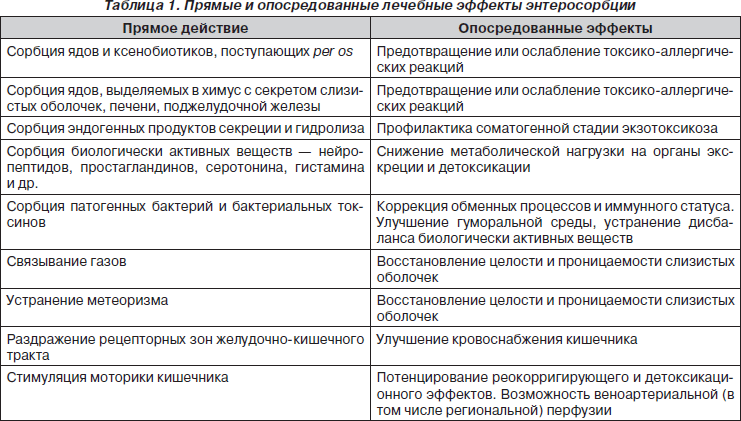
Среди методов купирования токсикозов, связывания и элиминации токсинов энтеросорбция является наиболее простым, дешевым и физиологичным методом с возможным применением длительное время и даже пожизненно, например при хронической печеночной или почечной недостаточности. Энтеросорбция — метод лечения интоксикационного синдрома при различных заболеваниях, основанный на способности энтеросорбентов связывать и выводить из организма различные экзогенные вещества, микроорганизмы и их токсины, эндогенные промежуточные и конечные продукты обмена, способные накапливаться или проникать в полость желудочно-кишечного тракта в ходе течения патологического процесса. Энтеросорбция входит в группу средств эфферентной терапии (от латинского efferens — выводить), то есть группы лечебных мероприятий, целью которых является прекращение действия токсинов различного происхождения и их элиминация из организма. Помимо энтеросорбции, в эту группу входят гемодиализ, перитонеальный диализ, плазмаферез, гемосорбция и некоторые другие.
Энтеросорбенты обладают высокой сорбционной емкостью, не разрушаются в желудочно-кишечном тракте и способны связывать экзо- и эндогенные вещества (микроорганизмы и их токсины, яды, излишек продуктов обмена и другие вредные для организма субстанции) путем ад- и абсорбции, ионообмена или комплексообразования. Энтеросорбенты поглощают из многокомпонентных растворов эндо- и экзотоксины, а вещества с макро- и мезопорами, кроме того, могут фиксировать на своей поверхности возбудителей бактериальной и вирусной природы, т.е. оказывать этиотропный эффект. В то же время, практически не изменяя состав нормальной кишечной микрофлоры, энтеросорбенты связывают токсические продукты, образующиеся в кишечнике в норме. Но патогенетически наиболее существенен детоксикационный эффект энтеросорбции, связанный с поглощением токсических продуктов, не только образующихся в кишечнике, но и секретируемых в него. Определенное значение имеет модификация сорбентами состава химуса.
Терапевтический эффект действия энтеросорбентов обусловлен физико-химическими свойствами сорбирующего вещества, способного связывать и выводить из организма токсические продукты (сорбаты). Сорбционная емкость (мощность сорбента) определяется способностью препарата поглощать, прочно удерживать и выводить вещества. Сорбционная емкость сорбентов обусловлена наличием пористой структуры, обладающей активной поверхностью. В зависимости от радиуса поры делятся на три типа: микропоры с радиусом менее 1,5 нм, мезопоры с радиусом от 1,5 до 200 нм и макропоры — свыше 200 нм. Перечисленные разновидности пор отличаются по механизму происходящих в них процессов. Молекулы небольшого размера сорбируются в основном в микропорах, а мезо- и макропоры являются для них транспортными каналами. Для молекул средней и высокой молекулярной массы микропоры практически недоступны, и они сорбируются в мезопорах. Макропоры предназначены для сорбции надмолекулярных структур и клеток.
Процессы сорбции осуществляются четырьмя основными путями. Первый из них — это адсорбция, представляющая собой взаимодействие между сорбентом и сорбатом на границе раздела сред. Адсорбенты имеют пористую основу, которая способствует накоплению и фиксации в порах веществ за счет их физико-химических свойств. Это приводит к снижению концентрации сорбируемых веществ в окружающей среде, т.е. в просвете желудочно-кишечного тракта. Второй путь — это абсорбция, которая состоит в поглощении сорбата всем объемом сорбента, т.е. имеет место растворение вещества. Третий путь — ионообмен, когда происходит замещение ионов на поверхности сорбента ионами сорбата (ионообменные смолы). Четвертый путь сорбции — комплексообразование, являющееся сложным комбинированным процессом нейтрализации, транспорта и выведения из организма антигенов, продуктов метаболизма (билирубин) и др.
История применения энтеросорбентов насчитывает тысячи лет: в Египте более трех тысяч лет назад использовали древесный уголь для наружного и внутреннего применения. Врачеватели Китая, Индии, Греции тысячи лет назад использовали древесный уголь, глину, растертые туфы, пережженный рог для лечения отравлений, кишечных расстройств, желтух и других заболеваний. В Древней Руси для этого применяли березовый или костный уголь. По исторической версии назначение знахарем древесного угля продлило после отравления жизнь Александра Невского. Древесным углем и порохом присыпали раны, толченый уголь давали внутрь детям и взрослым при диареях. Авиценна впервые предложил методы энтеросорбции с профилактической целью: в «Каноне врачебной науки», говоря об искусстве сохранения здоровья, он из семи постулатов этого искусства на третье место ставил методы очистки организма от излишков. В XVIII веке физиками были описаны сорбционные свойства углей, а в России преемник М.В. Ломоносова Т.Е. Ловиц (1757–1804) в 1785 г., изучая химические свойства древесного угля, обосновал применение метода энтеросорбции.
В конце 70-х годов ХХ века появились сорбенты нового поколения с высокой и селективной сорбционной емкостью для метаболитов и токсичных веществ. Этому способствовала авария на Чернобыльской АЭС, когда возникла острая необходимость выведения из организма пораженных людей радионуклидов. Сегодня растет интерес к энтеросорбентам в связи с ухудшающимся состоянием окружающей среды, особенно в крупных городах, в которых вредные факторы окружающей среды вышли за пределы допустимого, а пищевые продукты не отвечают нормативам. Потребность в энтеросорбции и гемосорбентах многократно возрастает при стихийных бедствиях, авариях на промышленных объектах. В настоящее время повышается значение энтеросорбции в диетологии и диетотерапии. Пероральный путь введения энтеросорбентов наиболее эффективен, так как процесс сорбции начинается в желудке и завершается в тонкой кишке.
Метод энтеросорбции тесно соприкасается с вопросами диетологии и диетотерапии, интерес к которым резко повысился в последние годы и стал иметь в ряде стран социальную значимость. Сформировались и начали реализовываться национальные и международные программы по профилактике и лечению атеросклероза, где сорбция холестерина и желчных кислот занимает одно из главных мест.
Связывание газов при гнилостном брожении дает возможность устранить метеоризм и улучшить кровоснабжение кишечника в процессе энтеросорбции. Продвигаясь по желудочно-кишечному тракту, сорбенты за счет раздражения рецепторных зон способны усиливать моторику кишечника и эвакуацию кишечного содержимого.
Перечень прямых и опосредованных механизмов лечебного воздействия энтеросорбентов намного больше, чем в приведенном материале. Этот метод эфферентной терапии затрагивает функцию всех органов и систем, о чем свидетельствуют разнообразные клинические эффекты при лечении больных с различными патологическими процессами.
Используемые в настоящее время энтеросорбенты классифицируют следующим образом:
— углеродные адсорбенты на основе активированного угля (карболен, карбоктин, гастросорб), гранулированных углей (марки СКН, СКТ-6А, СУГС, СКАН и др.) и углеволокнистых материалов (ваулен, актилен, «Днепр»);
— ионообменные материалы или смолы (кайексилит, холестирамин);
— энтеросорбенты на основе лигнина (полифепан, лигносорб);
— производные поливинилпирролидона (энтеродез, энтеросорб);
— полиметилсилоксановый полимер (Энтеросгель);
— сорбенты, применяемые при заболеваниях желудочно-кишечного тракта, эффекты которых обусловлены их вязкостью, а не связывающей способностью (белая глина, алюминия гидроокись, альмагель, гастал, сукральфат, силикагели, цеолиты);
— природные пищевые волокна: отруби злаковых, целлюлоза, альгинаты (детоксал), пектины (полисорбовит-50, полисорбовит-95), хитозан. Наиболее часто применяют углеродные сорбенты и энтеросорбенты на основе поливинилпирролидона.
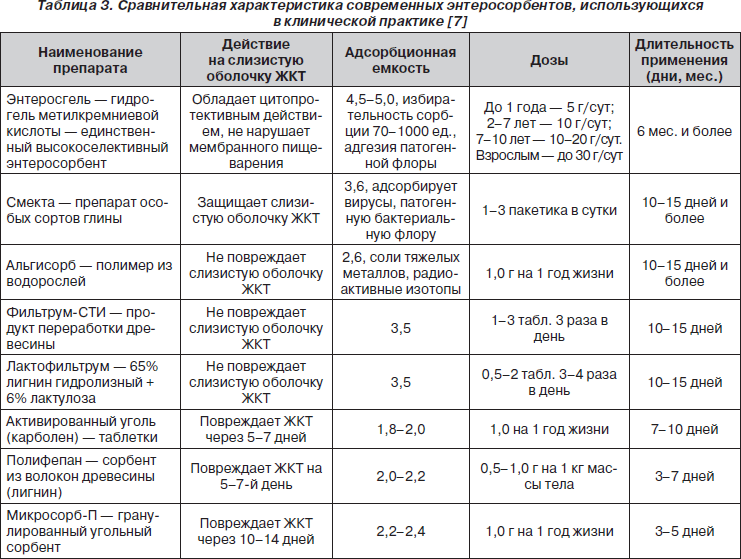
При выборе препарата врачу необходимо учитывать следующие требования к имеющимся энтеросорбентам: высокая эффективность сорбции при полной безвредности и нетоксичности; хорошая биосовместимость с тканями; высокая сорбционная емкость по отношению к удаляемым компонентам; селективная сорбция среднемолекулярных токсических метаболитов; отсутствие повреждающего действия на слизистые оболочки желудка и кишечника; отсутствие воздействия или позитивное влияние на процессы секреции и микробиоценоз кишечника; удобная фармацевтическая форма.
Спектр используемых энтеросорбентов в настоящее время обширен. Сравнительная характеристика современных энтеросорбентов, использующихся в клинической практике, представлена в табл. 3. Среди них широкое распространение в практике, в том числе и в педиатрической, отведено Энтеросгелю.
Энтеросгель наряду с элиминацией токсических веществ и коррекцией микробиоценоза кишечника способствует восстановлению эпителия слизистых оболочек ЖКТ [20]. Сорбционно-детоксикационные свойства Энтеросгеля обусловлены пористой глобулярной структурой (подобно губке), преимущественно с порами среднего диаметра. Это позволяет связывать и выводить токсические вещества с молекулярной массой 70–1000 Да — продукты распада белка, билирубин, холестерин, мочевину, креатинин [21]. Препарат отличается высокой биосовместимостью.
Бактерицидные свойства Энтеросгеля обусловлены тем, что он связывает и выводит патогенные микроорганизмы из ЖКТ, продукты их жизнедеятельности и распада и не связывает микроэлементы, витамины и необходимые, важные для жизнедеятельности человека вещества [22, 23]. Энтеросгель связывает и выводит грамположительные и грамотрицательные микробы, грибы рода Candida, вирусы [24, 25]. При этом не адгезируется и не угнетается сапрофитная микрофлора кишечника (лактобактерии, бифидобактерии и т.д.) [26, 27].
Представленные данные свидетельствуют, что Энтеросгель является высокоселективным энтеросорбентом, имеет широкий диапазон и наиболее высокий коэффициент избирательности сорбции, возможно его очень длительное использование — до полугода. Энтеросгель обладает следующими свойствами:
— безопасен при применении, безвреден;
— имеет большую сорбционную емкость, в 2,5 раза превосходит другие типы сорбентов;
— обладает цитопротективными свойствами;
— имеет высокую биосовместимость с тканями кишечника;
— нетравматичен, не повреждает слизистые оболочки органов ЖКТ;
— гидрофобен, не проникает через слизистые оболочки органов ЖКТ;
— образует гидрогель, обволакивающий слизистую оболочку;
— осуществляет адгезию патогенной микрофлоры;
— избирательно действует на микробиоценоз кишечника.
При различной патологии, сопровождающейся эндотоксикозом, выявлена высокая детоксикационная эффективность Энтеросгеля. При тяжелых ожогах у детей отмечено значимое снижение уровня интоксикационного синдрома, улучшение течения заболевания и уменьшение осложнений [11]. При этом на фоне восстановления нормальной микрофлоры кишечника авторами выявлено улучшение показателей неспецифической резистентности и снижение маркеров интоксикации.
При использовании Энтеросгеля купирование патологических симптомов со стороны кожи при атопическом дерматите у детей происходит значительно быстрее, чем при обычных методах терапии: гиперемия и инфильтрация кожи значимо уменьшаются на 3-и — 4-е сутки курсового лечения Энтеросгелем, зуд кожи существенно ослабляется к 7-му дню терапии [7, 28, 29].
При атопическом дерматите у детей авторы рекомендуют принимать Энтеросгель внутрь 2 раза в сутки за 1,5–2 часа до еды (утром натощак) и/или через 2 часа после ужина и приема лекарств. Способ приготовления Энтеросгеля для маленьких детей — разведение в теплой кипяченой воде в соотношении 1 : 10. Продолжительность приема Энтеросгеля при атопическом дерматите у детей — до 2–4 недель [30, 31].
Высокая клиническая эффективность применения Энтеросгеля у гастроэнтерологических больных, его положительное влияние на состояние слизистой оболочки кишечника, процессы пищеварения и всасывания, состав кишечной микрофлоры, иммуномодулирующий эффект определены в большом количестве исследований [9, 24, 26, 32, 33]. Значимый терапевтический эффект при лечении Энтеросгелем достигнут при тяжелом токсикозе, обусловленном кишечными инфекциями у детей [34], что обусловливалось как его детоксикационными свойствами, так и нейтрализацией самого инфекционного агента.
Энтеросгель со сладким вкусом, паста для перорального применения, имеет улучшенные лечебные и вкусовые свойства и в большей степени ориентирован на детский контингент [35]. Препарат принимают внутрь 3 раза в сутки, запивая достаточным количеством воды. Применять между приемами пищи и лекарственных препаратов (за 1,5–2 ч или через 2 ч после еды или приема лекарственных препаратов). Разовая доза для взрослых — 15 г (1 столовая ложка), суточная — 45 г. Для детей в возрасте до 3 лет доза препарата на прием составляет 5 г (чайная ложка) 2 раза в сутки, суточная доза — 10 г. Для детей в возрасте от 3 до 5 лет доза Энтеросгеля на прием составляет 5 г (чайная ложка), суточная — 15 г; в возрасте 5–14 лет: разовая — 10 г (десертная ложка), суточная — 30 г. В лекарственной форме паста Энтеросгеля полностью готова к применению. Продолжительность курса лечения — 7–14 дней. При хронических интоксикациях Энтеросгель назначают в дозе 30 г в сутки в течение 7–10 дней ежемесячно, при аллергических состояниях — 2–3 недели.
При тяжелой интоксикации и острых отравлениях в течение первых 3 дней назначают удвоенную дозу; при необходимости возможен длительный (і 60 дней) прием препарата (при циррозе печени, механической желтухе и т.п.).
Таким образом, процессы дисметаболизма, развивающиеся при тяжелом течении различных заболеваний, определяют повышенное образование токсических метаболитов, биологически активных веществ, факторов воспаления и т.д., токсически действующих на организм человека. В большинстве случаев место их накопления — желудочно-кишечный тракт. В органы пищеварения попадают токсические продукты и извне — отравляющие вещества, ксенобиотики, инфекции. Поэтому нейтрализация эндо- и экзотоксинов, инфекционных агентов (вирусов и патогенных бактерий) в кишечнике и их элиминация методом энтеросорбции — важнейшая часть в купировании токсических проявлений инфекционных, аллергических, гнойно-септических, онкологических, гастроэнтерологических и других заболеваний, что способствует уменьшению тяжести их течения и ускорению выздоровления.
1. Yakovlev M. Elements of Endotoxin Theory of Human Physiology and Pathology: «Sistemic Endotoxinemia», «Endotoxin Agression» and «Endotoxin Insuficancy» // J. of Endotoxin Research. — 2000. — 2. — 120.
2. Аниховская И. А., Опарина О. Н., Яковлева М. М. и др. Кишечный эндотоксин как универсальный фактор адаптации и патогенеза общего адаптационного синдрома // Физиология человека. — 2006. — 2. — 87-91.
3. Вышегуров Я. Х., Аниховская И. А., Батманов Ю. Е. и др. Кишечный эндотоксин в патогенезе воспалительной патологии глаза и антиэндотоксиновая составляющая ее лечения // Патологическая физиология и экспериментальная терапия. — 2007. — 1. — 12-14.
4. Шамов Б.А., Маланичева Т.Г. Эффективность энтеросорбции в коррекции синдрома эндотоксинемии при атопическом дерматите у детей // Лечащий врач. — 2010. — № 8. — С. 21-26.
5. Holgate S.T., Puddicombe S.M., Mullings R.E. et al. New insights into asthma pathogenesis // Allergy Clin. Immunol. Int. — 2004. — Vol. 16, № 5. — P. 196-201.
6. Kay A.B. Modulation of inflammation in allergic disease // Allergy Clin. Immunol. Int. — 2004. — Vol. 16, № 5. — P. 206-210.
7. Смирнова Г.И. Энтеросорбция в лечении атопического дерматита у детей // Лечащий врач. — 2009. — № 1. — С. 34-38.
8. Багдасарова И.В., Фомина С.П., Лавренчук О.В., Осадчая О.И., Шейман Б.С., Багдасарова Р.В. Применение препарата Энтеросгель со сладким вкусом в комплексной терапии пиелонефрита у детей // Consilium Medicum Ukraina. — 2008. — Т. 2, № 8. — С. 12-14.
9. Палий И.Г. Роль энтеросорбции в лечении заболеваний печени // Consilium Medicum Ukraina. — 2009. — № 3. — С. 13-16.
10. Беляева О.А., Семенов В.Г. Применение энтеросорбции в комплексной терапии заболеваний печени // Аптека. — 2003. — № 30. — С. 7.
11. Боярская А.М., Осадчая О.И., Жернов А.А., Коваленко О.Н. Применение препарата Энтеросгель в комплексном лечении дисбиоза кишечника у детей с ожоговой болезнью // Медицина неотложных состояний. — 2006. — № 1(2). — С. 21-25.
12. Виноградова О.П., Коршунов Г.В., Блинохватов А.Ф., Шуваева Л.А. Роль SE в течении эндотоксикоза при гнойно-воспалительных заболеваниях в гинекологии // Успехи современного естествознания. — 2003. — № 5. — С. 42-45.
13. Ушакова Н.Д. Патогенез, диагностика и коррекция эндотоксикоза при гнойно-воспалительных урологических заболеваниях: Дис... канд. мед. наук. — Москва, 2004. — 216 c.
14. Самсонов К.В. Системный анализ в диагностике эндотоксикоза при гнойно-некротических заболеваниях легких // Информатика и системы управления. — 2008. — № 2. — С. 16-22.
15. Сухов Ю.А., Гебеш В.В. Влияние энтеросорбции на уровень провоспалительных цитокинов при кишечной инфекции и кори // Клиническая иммунология. — 2007. — № 1 (6). — С. 76-78.
16. Учайкин В.Ф., Новокшонов А.А., Соколова Н.В., Сахарова А.А., Бережкова Т.В., Ларина Т.С. Место и значение энтеросорбции в этиопатогенетической терапии острых кишечных инфекций у детей // Педиатрия. — 2007. — № 2. — С. 44-50.
17. Новокшонов А.А.,Соколова Н.В. Энтеросорбция — эффективный метод эфферентной этиопатогенетической терапии острых кишечных инфекций у детей // Лечащий врач. — 2011. — № 3.
18. Нагорная Н.В., Дубовая А.В. Детоксикационные свойства и клиническая эффективность энтеросорбента Энтеросгель в комплексном лечении различных заболеваний у детей // Здоровье ребенка. — 2010. — № 3. — С. 28-33.
19. Чернихова Е. А., Аниховская И. А., Гатауллин Ю. К. и др. Энтеросорбция как важное средство устранения хронической эндотоксиновой агрессии // Физиология человека. — 2007. — 3. — 135-136.
20. Алешина Р.М. Сорбенты в практике аллерголога // Клінічна імунологія. Алергологія. Інфектологія. — 2006. — № 4(05). — С. 12-16.
21. Шейман Б.С., Багдасарова І.В., Осадча О.І., Семенов В.Г. Селективні детоксикаційні властивості ентеросорбенту ентеросгель та оптимізація показань до його застосування // Сучасні проблеми токсикології. — 2004. — № 3. — С. 79-83.
22. Шейман Б.С., Багдасарова И.В., Осадчая О.И., Семенов В.Г. Изучение детоксикационных свойств и клинической эффективности энтеросорбента «Энтеросгель» в комплексном лечении детей с пиелонефритом // Мистецтво лікування. — 2007. — № 2. — С. 11-16.
23. Неделяева А.В. Сравнительный анализ эффективности различных сорбентов на модели термического поражения // Сб. работ по применению препарата энтеросгель в медицине. — М., 2002. — Ч. I. — С. 28-37.
24. Мосунов А.И., Поздняков А.В. Клиническое исследование эффективности препарата сорбционно-детоксикационного действия Энтеросгеля при диффузной патологии печени, сопровождающейся гепатодепрессивным синдромом // Клиническое применение препарата Энтеросгель у больных с патологией органов пищеварения: новые подходы к терапии. Методические рекомендации для врачей / Под ред. И.А. Маева, Ю.Н. Шевченко, А.Б. Петухова. — М., 2000. — С. 61-63.
25. Ильенко Л.Н., Иванова Е.В. Оценка эффективности применения препарата Энтеросгель в комплексном лечении рецидивирующих форм неспецифического вагинита // Мистецтво лікування. — 2008. — № 5. — С. 24-27.
26. Чернобровый В.Н., Палий И.Г. Применение препарата Энтеросгель для лечения дисбактериоза кишечника // Мистецтво лікування. — 2003. — № 5. — С. 74.
27. Палий И.Г., Резниченко И.Г. Применение детоксиканта Энтеросгель для лечения заболеваний органов желудочно-кишечного тракта // Мистецтво лікування. — 2008. — № 4. — С. 15-19.
28. Смирнова Г.И. Энтеросорбция в лечении атопического дерматита у детей // Лечащий врач. — 2009. — № 1. — С. 34-38.
29. Шамов Б.А., Маланичева Т.Г. Эффективность энтеросорбции в коррекции синдрома эндотоксинемии при атопическом дерматите у детей // Лечащий врач. — 2010. — № 8. — С. 21-26.
30. Смирнова Г.И. Современная концепция атопического дерматита у детей. — М., 2006. — 132 с.
31. Нагорная Н.В., Бордюгова Е.В., Дубовая А.В. Использование энтеросорбции в лечении атопического дерматита // Современная педиатрия. — 2005. — № 4(9). — С. 67-70.
32. Петухов А.Б., Лысиков Ю.А., Шаховская А.К. и др. Результаты использования Энтеросгеля для лечения заболеваний органов пищеварения, связанных с нарушением пищеварения и всасывания // Клиническое применение препарата Энтеросгель у больных с патологией органов пищеварения: новые подходы к терапии. Методические рекомендации для врачей / Под ред. И.А. Маева, Ю.Н. Шевченко, А.Б. Петухова. — М., 2000. — С. 21-27.
33. Маев И.В., Вьючнова Е.С., Лебедева Е.Г. и др. Клиническое лечебно-профилактическое использование препарата Энтеросгель у больных с патологией органов пищеварения // Клиническое применение препарата Энтеросгель у больных с патологией органов пищеварения: новые подходы к терапии. Методические рекомендации для врачей / Под ред. И.А. Маева, Ю.Н. Шевченко, А.Б. Петухова. — М., 2000. — С. 15-21.
34. Новокшонов А.А., Соколова Н.В. Клиническая эффективность этиопатогенетической терапии энтеросорбентами острых кишечных инфекций у детей // Педиатрия. — 2009. — № 1. — С. 27-31.
35. Нагорная Н.В., Лимаренко М.П.. Энтеросорбция в педиатрической практике: выбор оптимального сорбента // Здоровье ребенка. — 2010. — № 2. — С. 28-31.