Журнал «Здоровье ребенка» 4 (31) 2011
Вернуться к номеру
Роль местных ингибиторов протеаз в неспецифической защите респираторного тракта
Авторы: Абатуров А.Е. Днепропетровская государственная медицинская академия
Рубрики: Педиатрия/Неонатология
Версия для печати
В обзоре представлены данные о местных ингибиторах сериновых протеаз SLPI и PI3, которые кроме антипротеазного действия выполняют и другие биологические функции. В респираторном тракте они оказывают антибактериальное, противогрибковое и противовирусное действие, модулируют активность воспалительного процесса, участвуют в ремоделировании ткани, регуляции дифференцировки клеток.
Введение
Развитие инфекционных и воспалительных процессов в легких сопровождается высвобождением и активацией большого семейства протеаз — сериновых протеаз, экстрацеллюлярных матриксных металлопротеиназ (ММР), которые играют основную роль в деградации компонентов экстрацеллюлярного матрикса, определяя характер и прогноз течения заболеваний [25, 65]. Регуляция уровня активности протеаз осуществляется многочисленными системными и местными ингибиторами, которые предупреждают чрезмерный протеолиз, поддерживая целостность органа-мишени [62]. Важнейшими ингибиторами пептидаз, функционирующих в респираторном тракте, являются: ингибитор секреторной лейкоцитарной пептидазы (SLPI), ингибитор протеиназы 3 (PI3), тканевые ингибиторы металлопротеиназ, цистатин и a1-протеиназный ингибитор, синтезируемый в печени. Три пептидазных ингибитора — SLPI, PI3, a1-протеиназный ингибитор — представляют «антиэластазный щит» легкого [25, 47].
Краткая характеристика SLPI и PI3
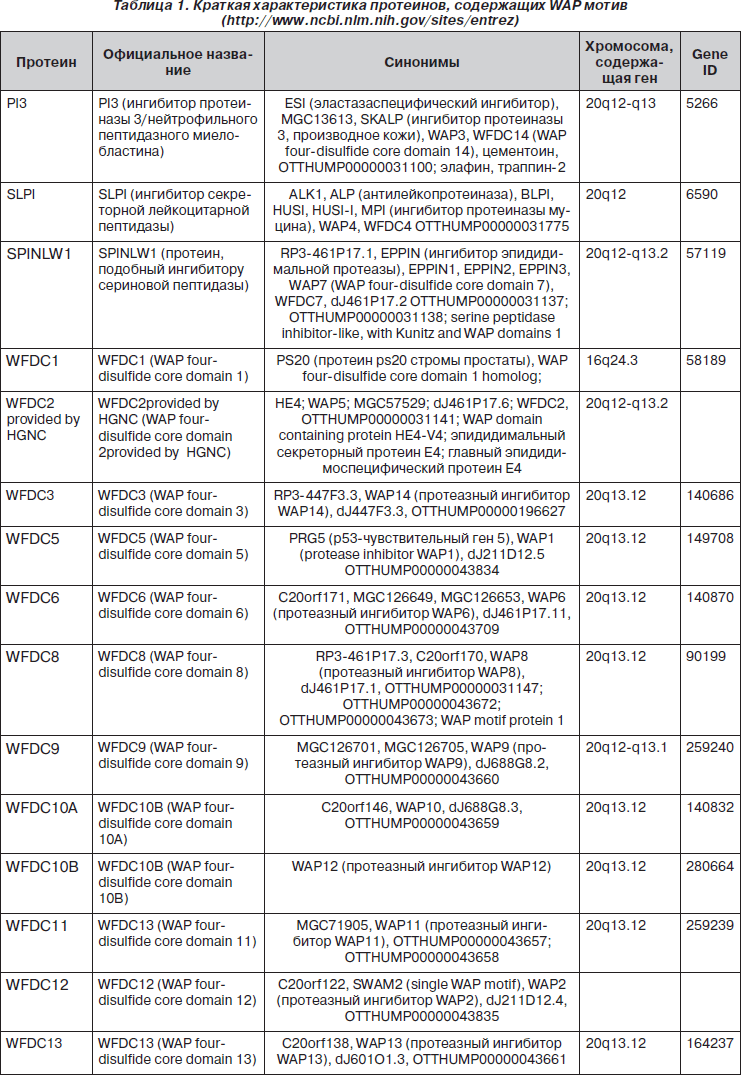
Представители семейства протеинов, содержащих WAP (whey acidic protein) мотив, местные ингибиторы протеаз SLPI и PI3, а также протеин, подобный ингибитору сериновой пептидазы (SPINLW1/EPPIN), генный продукт 4 человеческого эпидидимиса (HE4), протеазный ингибитор WAP2 и многие другие обладают как антипротеазной, так и антибактериальной активностью (табл. 1) [23, 63]. Дефицит SLPI и PI3 сопровождается увеличением вероятности хронизации острых респираторных инфекций и частоты обострений хронических заболеваний легких [21, 28, 81]. Гены, ответственные за синтез белков WAP-семейства, расположены на хромосоме 20q12-13.12 [15, 64].
WAP-мотив состоит из 50 аминокислотных остатков. Наличие в структуре молекулы 8 цистеиновых остатков обусловливает возникновение четырех дисульфидных связей, формирующих плотное ядро [10, 33]. Считают, что WAP является важным белковым структурным предшественником многих антимикробных пептидов [46].
В слизистой оболочке респираторного тракта, преимущественно в регионе верхних дыхательных путей, характерно присутствие местных ингибиторов сериновых протеаз — SLPI и PI3, молекулярная структура которых на 40 % соответствует друг другу. SLPI — белок с молекулярной массой 11,7 кДа, который состоит из 107 аминокислотных остатков, включая 16 цистеиновых остатков, образующих 8 дисульфидных связей (два гомологичных WAP-мотива). Молекула SLPI, по форме напоминающая бумеранг (рис. 1), содержит два терминальных домена. C-терминальный домен, функциональный центр которого сформирован аминокислотными остатками Leu72-Met73, обладает антипротеазной активностью; N-терминальный домен — антибактериальной активностью, которая связана с областью WAP-мотива [2, 20, 31, 77, 86]. Ингибитор сериновых протеаз PI3 (9,8 кДа) является представителем траппинового семейства (термин «траппин» является акронимом TRansglutaminase substrate and wAP domain containing ProteIN) и состоит из 95 аминокислотных остатков, включая 8 цистеиновых остатков, образующих 4 дисульфидные связи. N-терминальный домен (цементоин — от 1 до 38 аминокислотных остатков) обладает антибактериальной, C-терминальный домен, содержащий WAP-мотив (от 39 до 95 аминокислотных остатков), молекулы PI3 — антипротеазной и антибактериальной активностью (рис. 1) [7, 24, 63, 96]. Молекула PI3 имеет уникальное строение N-терминального домена, которое характеризуется наличием нескольких VKGQ мотивов, что позволяет ей ковалентно связываться с протеинами экстрацеллюлярного матрикса, в частности с ламинином [24, 54]. В естественных условиях от PI3 (преэлафина, траппина-2) отщепляется цементоин с образованием молекулы элафина [91].
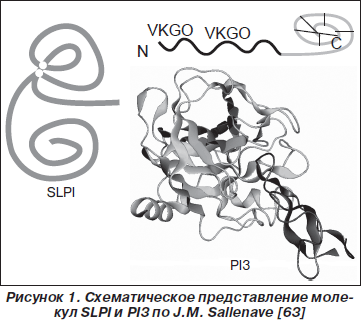
В респираторном тракте SLPI конституционально продуцируют эпителиоциты трахеи и бронхов, бронхиолярные клетки Клара, альвеолоциты II типа, альвеолярные макрофаги, моноциты, нейтрофилы; PI3 — эпителиоциты трахеи, клетки Клара, альвеолоциты II типа, альвеолярные макрофаги [44, 63, 77, 85]. SLPI является основным ингибитором местных солютабных протеаз бронхопульмональной системы (за счет SLPI ингибируется до 50 % NE) [18]. PI3 обусловливает 20 % антиэластазной активности бронхоальвеолярной жидкости. У лиц в состоянии клинического здоровья уровень концентрации SLPI в бронхоальвеолярной жидкости колеблется в пределах 0–50 пикомоль/л, PI3 — 0–25 пикомоль/л, в сыворотке крови SLPI — 25–125 пг/мл, PI3 — 2–18 пг/мл [37, 54, 73]. В слюне физиологический уровень концентрации SLPI необычайно высок и составляет 0,1–10 мкг/мл [61, 74]. Воспалительный процесс слизистой оболочки сопровождается индуцибельной продукцией SLPI, PI3. Показано, что у пациентов с острым респираторным дистресс-синдромом, острой пневмонией отмечается достоверно более высокий уровень концентрации SLPI, PI3 в бронхоальвеолярной жидкости [63, 73, 84].
На основании анализа активации 292 генов было показано, что индукция синтеза ингибиторов протеаз, наряду с синтезом кератинов, S-100 кальцийсвязывающих белков и цитокинов семейства IL-1, является самым ранним проявлением воспалительного процесса [88]. Синтез SLPI индуцируют липополисахарид (ЛПС), нейтрофильная эластаза (NE), дефензины, эпидермальный фактор роста (EGF) и ранние цитокины, такие как IL-1, TNF-a. Возбуждение индуцибельной продукции PI3 связано с действием NE, IL-1, TNF-a [40, 58, 59, 89, 96]. Однако чувствительность индуцибельной продукции данных ингибиторов протеаз различных клеток имеет некоторые особенности. Так, макрофаги в отличие от эпителиоцитов продуцируют SLPI в ответ на воздействие IL-6, IL-10 и не отвечают на действие IL-1, TNF-a [40]. Процессы активации синтеза SLPI, PI3 обусловлены возбуждением таких внутриклеточных сигнальных компонентов, как c-jun, p38 MAPK, фактор транскрипции NF-kB [96].
Продукция SLPI ингибируется трансформирующим фактором роста TGF-b через Smad путь [53, 62]. SLPI инактивируется катепсинами B, L и S. Все три катепсина расщепляют SLPI между остатками Thr67 и Tyr68, что приводит к потере активного участка SLPI и потере антиэластазной активности [12].
Полиморфизм гена PI3 T34P (вариабельная аллель rs2664581) ассоциирован с риском развития острого респираторного дистресс-синдрома [27]. До настоящего времени не найдены как полиморфизмы гена SLPI, так и врожденные состояния его дефицита [17].
Механизм действия SLPI и PI3
Местные антипротеазы — SLPI, PI3 — ингибируют некоторые сериновые пептидазы. SLPI является ингибитором NE, катепсина G, трипсина нейтрофилов, химазы и триптазы тучных клеток, трипсина и химотрипсина панкреатических ацинарных клеток. Однако основной молекулярной целью SLPI является NE [11]. PI3 в отличие от SLPI имеет более строгую направленность антипротеазного действия — он инактивирует NE и нейтрофильный пептидазный миелобластин/протеиназу 3 (NPM). PI3 и SLPI не обладают антигранзимной активностью [23, 64, 93].
В настоящее время у приматов идентифицировано около 500 пептидазных генов, 150 из которых кодируют сериновые пептидазы. Гены человеческих сериновых пептидаз в зависимости от хромосомной принадлежности организованы в 4 группы — 5q11.2 (GZMA/гранзим A, GZMK/гранзим К), 14q11.2 (CMA1/химаза, CTSG/катепсин G, GZMH/гранзим H, GZMB/гранзим B), 16p13.3 (TPSG/триптаза g, TPSAB1/триптаза bI&a, TPSB2/триптаза b II, TPSD/триптаза d) и 19p13.3 (NE/ELA2/ NE, DF/фактор D, PRTN3/протеиназа 3, AZU1/азурицидин, GZMM/гранзим M) [13]. Основными солютабными сериновыми пептидазами респираторного тракта являются NE и NPM, уровень продукции которых резко возрастает при заболеваниях органов дыхания. Целевыми белками сериновых пептидаз являются белки экстрацеллюлярного матрикса (коллаген, ламинин, фибронектин, эластин и др.), солютабные протеины (иммуноглобулины, компоненты комплемента, системы коагуляции крови и др.) [30, 42, 49]. Деструкция компонентов экстрацеллюлярного матрикса, особенно эластина, ведет к нарушению легочной паренхимы и развитию эмфиземы легкого. Критическим уровнем концентрации NE в сыворотке крови считают 220 нг/мл [50, 76]. Высокая чувствительность эндотелиоцитов к действию NE приводит к редукции капиллярного русла легкого [28].
Сериновые пептидазы NE и NPM, кроме деструктивного, обладают антибактериальным, провоспалительным, иммунорегулирующим, мукоактивным действиями [25].
Сериновые пептидазы NE и NPM участвуют и в антибактериальной защите макроорганизма. Показано, что NE и NPM оказывают бактерицидное действие против грамотрицательных бактерий (Klebsiella pneumoniae и Escherichia coli). NE также индуцирует продукцию антимикробного пептида — b-дефензина 2 [1, 6, 51, 52, 75].
Под влиянием NE усиливается экспрессия MUC5AC, MUC1, MUC4, но снижается эффективность мукоцилиарного механизма бронхиального дерева. NE участвует в ремоделировании респираторного тракта: индуцирует метаплазию клеток, увеличивает синтез p27 и вызывает арест клеточного цикла [94].
Пептидазы NPM и NE активно участвуют в модуляции воспалительного процесса, проявляя провоспалительные и противовоспалительные свойства. Провоспалительное действие NPM и NE обусловлено их способностью: 1) вызывать хемотаксис провоспалительных клеток через индукцию синтеза IL-8 и моноцитарного хемоаттрактного протеина 1; 2) ингибировать апоптоз нейтрофилов; 3) возбуждать рецепторы эпидермального фактора роста, протеиназактивируемые рецепторы, Toll-подобные рецепторы 4 (TLR4); 4) активировать синтез IL-1b, IL-6, TNF-a. А противовоспалительное действие связано с их способностью препятствовать адгезии нейтрофилов, расщеплять провоспалительные цитокины (IL-1b, IL-2, IL-6, TNF-a) и CD14 [43, 60].
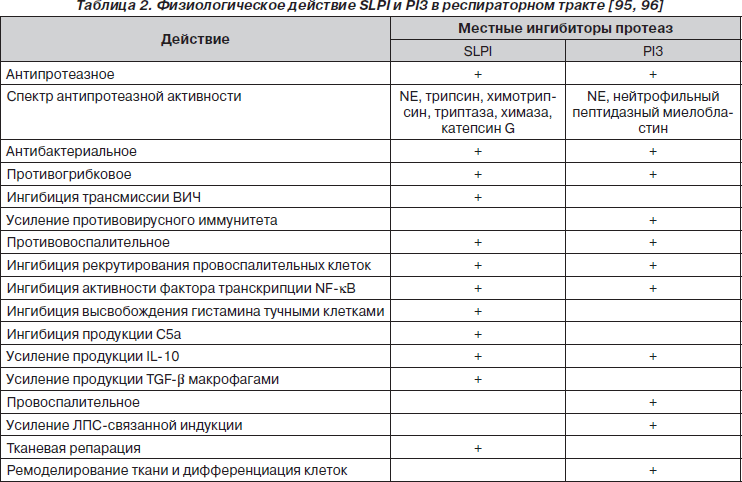
SLPI, PI3 и ингибитор протеиназы 1a (a1-PI), подавляя активность пептидаз нейтрофилов, защищают клетки от их разрушающего действия и предупреждают развитие эмфизематоза и фиброза легкого [9, 30, 60, 92]. Помимо антипротеазного SLPI, PI3 обладают другими разнообразными физиологическими свойствами (табл. 2) [95, 96].
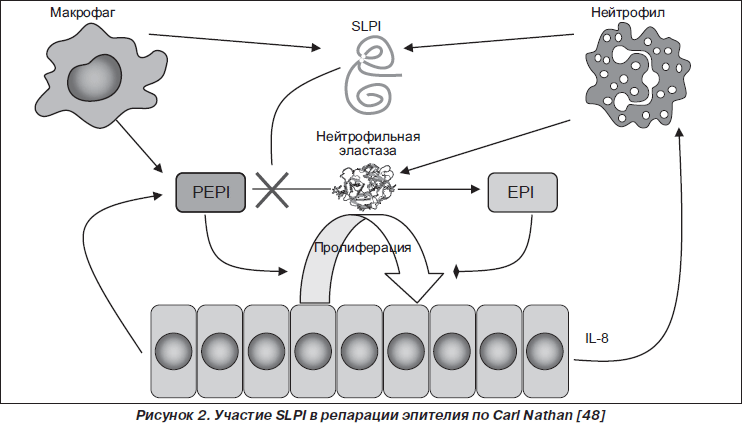
SLPI активно участвует в репарации эпителия слизистой оболочки (рис. 2).
По мнению Carl Nathan [48], высвобожденный из нейтрофилов, макрофагов, эпителиоцитов SLPI блокирует NE, которая обусловливает конверсию эпителиально-клеточного проэпителина (PEPI — epithelial-cell-derived proepithelin) в эпителин (EPI). Сохраненный PEPI индуцирует пролиферацию эпителиальных клеток, способствуя восстановлению эпителия. А дефицит EPI отражается на активности продукции эпителиоцитами CXC-хемокинового лиганда 8 (CXCL8; IL-8), привлекающего макрофаги. SLPI непосредственно обладает пропролиферативным, усиливая экспрессию циклина D1, и антипролиферативным действием, ингибируя Ras-путь [69].
Противоинфекционное действие SLPI и PI3
SLPI обладает антибактериальным действием по отношению к грамположительным и грамотрицательным бактериям, противогрибковым и противовирусным действиями, PI3 — антибактериальным [2, 5, 21, 38, 61, 87]. Показано, что SLPI и PI3 активны против Pseudomonas aeruginosa, Escherichia coli, Staphylococcus aureus, Staphylococcus epidermis [7, 21, 96]. PI3 в концентрации 5–20 микромоль/л оказывает бактерицидное действие против Haemophilus influenzae, Branhamella catarrhalis [80]. Согласно данным J. Nishimura и соавт. [55], SLPI обладает мощным антимикобактериальным действием. Мыши с нокаутным геном Slpi высокочувствительны к M.tuberculosis. По всей вероятности, SLPI играет роль образраспознающего рецептора. SLPI инактивирует микобактерии, связываясь с такими их РАМР, как липоарабиноманнан и фосфатидилинозитол маннозид. Микобактерии, несущие на своей поверхности SLPI, более активно фагоцитируются, чем микобактерии, не связанные с SLPI. Однако механизм антибактериального действия SLPI пока еще остается неизвестным [72].
Предполагают, что антибактериальная активность семейства протеинов с WAP-мотивом обусловлена положительно заряженными лизиновыми и аргининовыми аминокислотными остатками WAP-региона [2, 41]. По мнению Audrey Bellemare и соавт. [7], механизм действия антипептидазных агентов зависит от их концентрации. При низких концентрациях (< 8 микромоль/л) они оказывают бактериостатическое действие за счет C-терминального домена, ингибирующего секретируемые сериновые пептидазы оппортунистических бактерий; при высоких концентрациях проявляют бактерицидное действие за счет N-терминального домена.
Некоторые грамположительные бактерии в процессе эволюции выработали механизмы защиты от антибакте-риального действия ингибиторов пептидаз. Так, b- гемо-литический стрептококк группы A продуцирует стрептококковый ингибитор комплемента (SIC), который обладает более выраженным аффинитетом к N-терминальному домену молекулы SLPI, чем к протеолитическим сайтам SLPI, а также лизоцима и комплемента [26].
SLPI оказывает противогрибковое действие. Показано, что он подавляет рост колоний Aspergillus fumigatus и Candida albicans [96]. J.F.C. Tomee и соавт. [87] считают, что 50 % естественной антифунгальной активности слизистых оболочек связано с функционированием SLPI. K. Baranger и соавт. [80] в 2008 году показали, что и PI3 (преэлафин) обладает фунгицидным действием против Aspergillus fumigatus и Candida albicans.
SLPI проявляет и противовирусное действие. Betsy C. Herold и соавт. [14, 36] установили, что SLPI предотвращает инфицирование эпителиоцитов вирусом простого герпеса. SLPI, как протеин, связывающийся с белком скрамблазой PLSCR1, который непосредственно взаимодействует с рецептором CD4 и аннексином II на цитоплазматической мембране макрофагов, является мощным ингибитором закрепления и проникновения ВИЧ-1 в макрофаг [38, 45, 71, 84]. По мнению Colin D. Bingle и Annapurna Vyakarnam [8], изучение взаимодействия ВИЧ с белками WAP-семейства не только поможет выяснить неизвестные функции филогенетически древнего WFDC (whey four disulphide core domain), но и может стать основой для разработки новых лекарственных средств, обладающих противовирусным действием как против ВИЧ, так и против других вирусных агентов.
Влияние SLPI и PI3 на иммунную систему
SLPI и PI3 действуют как регуляторы местного и системного воспалительного процесса [8, 67, 95].
Ингибиторы сериновых пептидаз SLPI и PI3 проявляют выраженное противовоспалительное действие [91]. Показано, что PI3 подавляет активность воспалительного процесса в условиях экспериментального инфаркта миокарда, вирусного миокардита, атеросклероза, а введение рекомбинантного SLPI снижает уровень поражения легких при экспериментальной эмфиземе легких у животных. Данные эффекты действия SLPI и PI3 нельзя объяснить только их антипротеазной активностью [96].
Одним из основных механизмов противовоспалительного действия SLPI и PI3 является ингибиция NE и NPM, которая предотвращает их провоспалительные и деструктивные эффекты [8, 9].
PI3 ингибирует миграцию провоспалительных клеток в пораженный регион легкого [3]. При некоторых условиях SLPI подавляет рекрутирование нейтрофилов и эозинофилов в очаг воспаления [83].
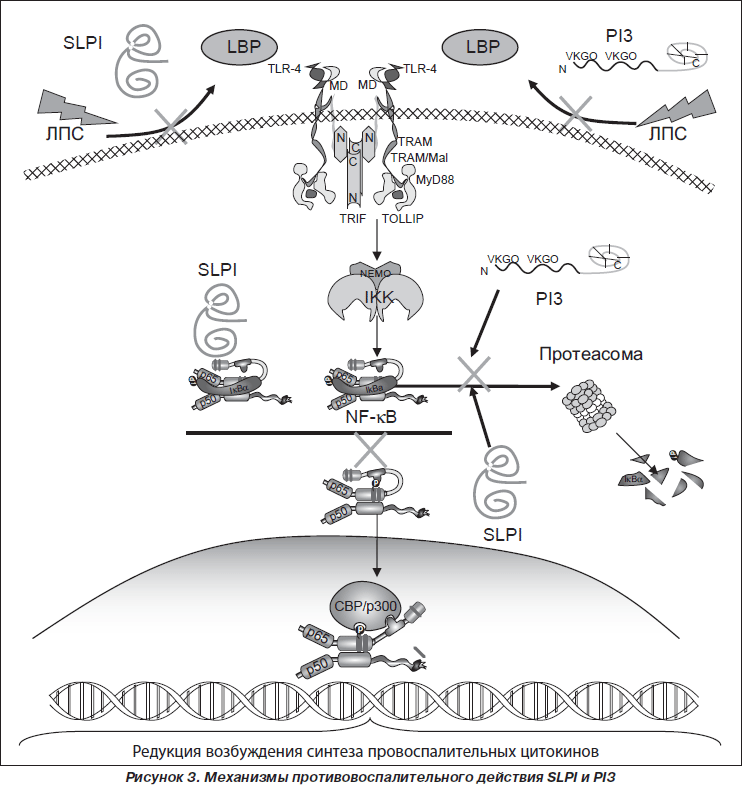
Основным механизмом противовоспалительных эффектов ингибиторов сериновых пептидаз SLPI и PI3 является их действие на процессы распознавания патогенассоциированных молекулярных структур (РАМР) бактериальных агентов и внутриклеточные сигнальные пути (рис. 3).
SLPI и PI3 принимают участие в регуляции распознавания РАМР бактериальных агентов трансмембранными TLR2 и TLR4. SLPI и PI3 обладают способностью связываться с R-формами и S-формами ЛПС грамотрицательных бактерий, конкурируя с ЛПС-связывающим протеином (LBP), который транспортирует ЛПС к CD14. Нарушение передачи ЛПС к LBP ингибирует дальнейшее связывание ЛПС с CD14 и предупреждает возбуждение TLR4 [68, 79, 81]. Catherine M. Greene и соавт. [29] было показано, что SLPI препятствует возбуждению TLR2 липотейхоевой кислотой (РАМР грамположительных бактерий), ингибируя возбуждение внутриклеточных сигнальных путей, приводящих к синтезу провоспалительных цитокинов. В частности, снижая продукцию IL-6, что обусловливает ингибицию трансформации В-клеток в плазматические клетки и активности синтеза иммуноглобулинов.
Установлено, что солютабные ингибиторы сериновых пептидаз могут импортироваться макрофагами как в цитоплазму, так и в ядро клетки [66, 78], в связи с чем противовоспалительный эффект SLPI и PI3 может быть обусловлен их непосредственным действием на внутриклеточные сигнальные пути. Показано, что SLPI и PI3, используя несколько механизмов действия, снижают активность фактора транскрипции NF-kB [16]. Так, SLPI подавляет индуцированное ЛПС или липотейхоевой кислотой возбуждение NF-kB, непосредственно взаимодействуя с энхансерсвязывающей областью NF-kB, ингибируя трансактивность p65 [66]. С другой стороны, ингибиция активности фактора транскрипции NF-kB обусловлена способностью SLPI и PI3 защищать его ингибитор IkBa как от убиквитин-протеасомно-зависимой, так и от убиквитин-протеасомно-независимой деградации [22, 29, 37, 79].
Ингибиторы пептидаз SLPI и PI3 подавляют ЛПС и IFN-g-индуцированный синтез провоспалительных медиаторов заболевания [34, 40, 65]. В частности, показано, что под влиянием SLPI и PI3 ингибируется продукция воспалительного протеина-2, ТНФ-a, IL-1, IL-6, молекул адгезии [29, 39]. SLPI подавляет высвобождение гистамина тучными клетками, уменьшает степень дегрануляции эозинофилов [32], ингибирует продукцию матриксных металлопротеиназ 1 и 9 [70].
SLPI и PI3 увеличивают продукцию противовоспалительного цитокина IL-10, а SLPI усиливает активность синтеза макрофагами и TGF-b[19, 34, 97].
SLPI ингибирует переход лейкоцитарных β2-интегринов в активную конформацию, подавляет реорганизацию цитоскелета нейтрофилов в ответ на стимуляцию IgG [4].
Ингибиторы сериновых пептидаз SLPI и PI3 оказывают и провоспалительное действие. SLPI ингибирует ЛПС-индуцированную продукцию простагландина E2, который является антиапоптотическим фактором для дендритных клеток и ингибитором продукции хемокинов CCL3 и CCL4 моноцитами и Т-лимфоцитами, тем самым поддерживая Th1-ответ [96].
Однако основное провоспалительное действие принадлежит PI3 (рис. 4). Ali Roghanian и соавт. [82] было показано, что PI3 обладает хемотаксическим действием на макрофаги и нейтрофилы. PI3 увеличивает рекрутирование провоспалительных клеток в ответ на действие ЛПС и, предупреждая деградацию CD14, усиливает ЛПС-индуцированное возбуждение макрофагов, способствуя элиминации бактериальных агентов в самом раннем периоде инфекционного процесса [56, 57, 81, 90]. В ткани легкого PI3 активирует дендритные клетки (CD11c+/MHCII+). У экспериментальных животных, получивших экзогенный PI3, в респираторном тракте наблюдалось увеличение представительства клеток CD11c+/MHCII+, которые характеризовались высокой степенью экспрессии костимулирующих молекул CD80 и CD86 [96].
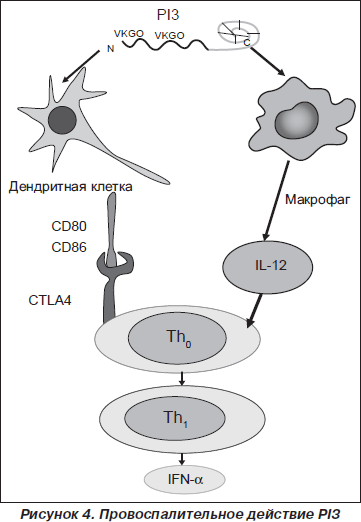
PI3 способствует генерации Th1-хелперов и продукции IL-12, IFN-g, IgG2a и IgА [82], способствуя формированию Th1-ответа.
Заключение
Ингибиторы сериновых пептидаз SLPI и PI3 кроме антипротеазного действия выполняют многочисленные биологические функции. В респираторном тракте они оказывают антибактериальное, противогрибковое и противовирусное действие, модулируют активность воспалительного процесса, участвуют в ремоделировании ткани, регуляции дифференцировки клеток. Антипротеазы SLPI и PI3 в сравнении с известными антибактериальными средствами, используемыми в клинической практике, обладают множеством различных биологических преимуществ и, по мнению Jean-Michel Sallenave и соавт. [96], являются важнейшими субстратами, на основе которых будут разработаны новые антибактериальные средства.
Список литературы находится в редакции