Журнал «Травма» Том 12, №3, 2011
Вернуться к номеру
Сучасний підхід до ранньої діагностики ювенільного ревматоїдного артриту
Авторы: Бур’янов О.А.1, Марушко Т.В.2, Пшеничний Т.Є.1, 1Національний медичний університет ім. О.О. Богомольця, м. Київ, 2Національна медична академія післядипломної освіти ім. П.Л. Шупика, м. Київ
Рубрики: Травматология и ортопедия
Версия для печати
Ювенільний ревматоїдний артрит — одне з найтяжчих захворювань дитячого віку. У зв’язку з труднощами ранньої діагностики ювенільного ревматоїдного артриту впродовж перших 3 місяців правильний діагноз був установлений лише у 46 % випадків. Упровадження в практику нових діагностичних тестів (визначення антитіл до цитрулінованих протеїнів) дозволяє поставити діагноз на ранніх етапах захворювання та розпочати лікування.
Ювенільний ревматоїдний артрит, цитрулінування, антигени, імунні комплекси.
Ювенільний ревматоїдний артрит (ЮРА, клас ХІІІ, М 08.0) — хронічне системне запальне захворювання або гетерогенна група захворювань сполучної тканини із складним автоімунним патогенезом, що характеризується прогресуючим ураженням переважно периферичних (синовіальних) суглобів за типом ерозивно-деструктивного поліартриту й призводить до порушення функції суглобів, їх деформації, а в майбутньому — до інвалідизації хворого (В.А. Насонова, М.Г. Астапенко, 1989; Я.А. Сигидин, 1996).
Поширеність захворювання в Україні, згідно з даними різних авторів, становить 0,41 на 1 тис. дитячого населення, і на сьогодні по Україні нараховується близько 3 тис. хворих дітей. Захворювання вражає дітей усіх вікових груп, але найчастіше дебют припадає на вік до 7 років, приблизно в 50 % випадків — до 5 років. Соціальне значення захворювання пов’язане не тільки з прогресуючим характером захворювання та поширеністю його серед дітей, а і з його наслідками. Через 3–5 років майже в 50 % випадків захворювання призводить до значної втрати активного способу та зниження якості життя та в 25–60 % — до інвалідності [1, 2, 4]. Смертність від ЮРА серед дітей сягає 0,5–1 % випадків.
Окрім того, на відміну від ревматоїдного артриту в дорослих, ЮРА характеризується значним поліморфізмом первинних проявів, перебігу, уражень внутрішніх органів, що в 27,5 % приводить до помилкової діагностики навіть через рік після початку захворювання.
Таким чином, проблема ЮРА на сьогодні є актуальною з урахуванням частоти виявлення, початку захворювання з раннього віку, розвитку інвалідності з дитинства, можливого несприятливого прогнозу. Не можна недооцінювати соціальний та економічний аспекти проблеми ЮРА: труднощі в процесі виховання та навчання таких дітей, значні матеріальні витрати на діагностику та лікування, витрати на працю медичного персоналу. Розпочавшись у дитячому віці, ЮРА, часто з ускладненнями, становить значну проблему в кардіоревматології дорослих.
Нами було проаналізовано результати обстеження та лікування 198 пацієнтів із ЮРА, які зверталися по допомогу до ДУ НДІ травматології та ортопедії АМН України, на кафедру травматології та ортопедії НМУ ім. О.О. Богомольця, кафедру педіатрії № 2 Національної медичної академії післядипломної освіти ім. П.Л. Шупика.
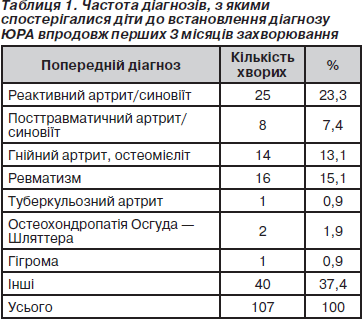
У зв’язку з труднощами діагностики раннього ЮРА впродовж перших 3 місяців правильний діагноз був установлений лише у 46 % випадків (91 пацієнт). Серед діагнозів у цей період найчастіше зустрічались: реактивний артрит (синовіїт), посттравматичний синовіїт (артрит), ревматизм, гнійний артрит, туберкульозний артрит (табл. 1).
Лише 29,8 % пацієнтів звернулось по кваліфіковану ортопедичну допомогу впродовж першого року захворювання, отримуючи лікування у педіатрів та ревматологів, що, на нашу думку, негативно впливає на якість подальшого лікування. Варто також відзначити досить поверхневу обізнаність ортопедів з особливостями саме ювенільної форми ревматоїдного артриту та використання підходів у діагностиці та лікуванні, прийнятих при ревматоїдному артриті в дорослих, що приводить до діагностичних і лікувальних помилок. Відсутність специфічних лабораторних маркерів діагностики та низька чутливість існуючих методів, недосконалість існуючих діагностичних критеріїв із адаптацією для дитячого віку роблять ранню діагностику ЮРА складним завданням [2, 3].
За даними літератури, переважно суглобова форма ЮРА зустрічається майже в 70 % випадків, а ураження колінного суглоба, найбільш характерне при переважно суглобовій формі, зустрічається у 2/3 пацієнтів [1, 3, 4]. На основі аналізу джерел літератури можна стверджувати, що труднощі в діагностиці артритів у дітей пов’язані як з анатомо-морфологічними особливостями дитячого організму, так і з відсутністю чітких клініко-лабораторних, морфологічних критеріїв діагностики, схем та методик обстеження пацієнтів залежно від перебігу та стадії захворювання. Для більшості пацієнтів характерні моно- (24,5 %) та олігоартритичний (24 %) варіанти перебігу захворювання. Однак при перебігу захворювання можливе залучення інших суглобів, що в 50–80 % випадків залишається нерозпізнаним (субклінічний синовіїт) [2–4].
Перспективи прогнозу ЮРА напряму пов’язані з раннім встановленням діагнозу та початком лікування на додеструктивному етапі захворювання. До цього часу використовуються критерії діагностики ЮРА, запропоновані А.В. Долгополовою та співавторами (1980), що не відображають ранніх проявів ЮРА та орієнтовані здебільшого на розгорнуту клінічну картину.
Оцінка традиційних лабораторних показників (ШОЕ, С-реактивний білок (СРБ), ревматоїдний фактор (РФ)) у діагностиці ЮРА мають другорядне значення, оскільки зміни гострофазових показників є нехарактерними при ЮРА, а РФ виявляється лише у 6–12 % випадків, переважно при системному та поліартикулярному варіантах захворювання та у дітей старших вікових груп, з перебігом процесу за типом РА у дорослих. Окрім того, позитивний РФ виявляють і при ряді інших колагенозів (системний червоний вовчак, хвороба Бехтерева, псоріатичний артрит тощо), що в дебюті може значно ускладнити проведення диференціальної діагностики.
Дотепер немає єдиної точки зору щодо ролі РФ у ланцюзі патогенетичних реакцій, які розвиваються у хворого на РА. РФ зустрічається не у всіх хворих на РА. За даними літератури, РФ серед дорослих хворих зустрічається у 70 %, а серед дітей — до 10 %, але можливо, це результат недосконалості методів дослідження. Іноді РФ є присутнім у синовіальній рідині або в тканинах (20–70 % плазматичних клітин продукують РФ), а в сироватці крові він відсутній. У ряду авторів склалась думка, що серонегативний варіант РА перебігає більш доброякісно, має більш сприятливий прогноз, оскільки при ньому уражується менша кількість суглобів, не виявляється тяжкої деструкції, рідко уражуються внутрішні органи.
Для ранньої діагностики визначення РФ малоінформативне, тому що він виявляється не раніше чим через 6 місяців від початку захворювання, а частіше через 1–3 роки від початку, а в другому півріччі РФ виявляється лише у 20–30 % хворих. Окрім цього, РФ не є патогномонічною ознакою РА, він може бути присутнім і при інших ревматичних хворобах: при системному червоному вовчаку — у 30–40 % хворих, склеродермії — у 35 %, дерматоміозиті — у 10–15 % пацієнтів, а тому розробка інших методик констатації наявності автоімунного процесу в організмі хворого є актуальною задачею.
Варто звернути увагу на С-реактивний білок. СРБ є ланкою неспецифічної гострофазової відповіді на запальний процес інфекційного або неінфекційного походження [6]. Синтез цього білка відбувається в гепатоцитах під контролем прозапальних інерлейкінів, у першу чергу ІЛ-6. У нормі середня концентрація СРБ становить 0,8 мг/л і при запаленні може зростати в десятки тисяч разів [6, 8]. Функція СРБ полягає у зв’язуванні залишків фосфохоліну та виведенні його з організму через активацію системи комплементу та фагоцитозу [8]. Таким чином, функція СРБ полягає в попередженні розвитку автоімунних процесів завдяки видаленню автоантигенів та зменшенню вірогідності утворення автоантитіл. Однак, як виявилось, під час зв’язування зруйнованих клітинних мембран і активації системи комплементу СРБ залучається до стимуляції синтезу прозапальних цитокінів, а отже, до прогресування запального процесу [5, 7]. Оскільки активність процесу синтезу СРБ залежить від рівня ФНП-a, ІЛ-1, ІЛ-6, СРБ виступає в ролі зручного об’єктивного маркера активності хвороби [7, 9]. Саме тому СРБ включений до загальновизнаної європейської шкали активності захворювання [9]. Хоча РФ у діагностичних титрах корелює з вираженістю проявів хвороби, СРБ, за даними J. Sheldon, виступає надійнішим показником для моніторингу захворювання чи відповіді на проведене лікування, особливо зважаючи на невисоку частку серопозитивних пацієнтів серед хворих на ЮРА [5, 8]. Окрім того, рівень СРБ швидше, ніж ШОЕ, реагує на зміну активності запалення та на відміну від ШОЕ не залежить від супутніх чинників — віку, статі, якісних та кількісних характеристик еритроцитів. Проведені дослідження свідчать про кращу кореляцію СРБ з активністю захворювання за DAS порівняно з ШОЕ [8, 9].
Водночас для ранньої діагностики РА у дорослих дедалі частіше використовуються нові імунологічні тести — визначення антитіл до циклічного цитрулінованого пептиду (anti-ССР) та модифікованого цитрулінованого віметину (anti-MCV).
Цитрулінування — процес, якому підлягає тільки невелика група білків організму. В ураженій ревматоїдним процесом синовіальній оболонці знаходиться кілька типів цитрулінованих білків — віметин, пістони, колагени типу І та ІІ, альфа-єнолаза та ін. Згідно з дослідженнями C. Masson-Bessiere et al. (2001), цитруліновані білки при РА в синовіальній рідині представлені переважно віметином та фібрином, однак є можливість цитрулінування інших протеїнів у ході апоптозу при змінених умовах [5, 7]. Чутливість та специфічність даних тестів у дорослих сягає 70–90 %.
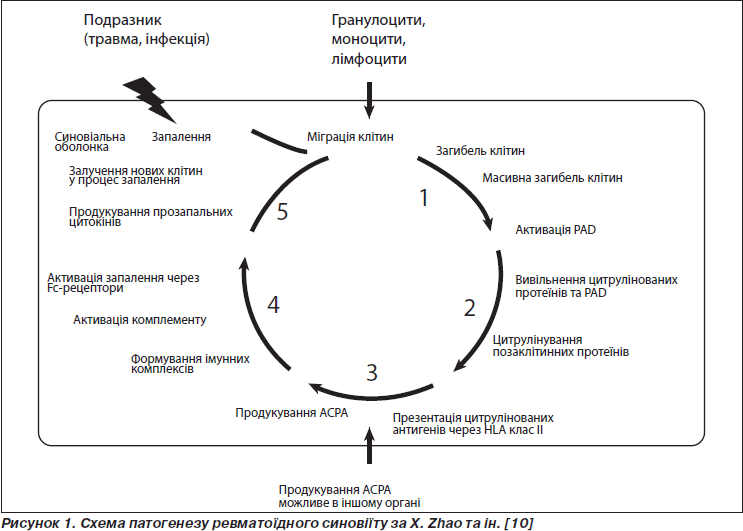
Згідно з Zhao та ін. (2008), у процесі цитрулінування виділяється 5 важливих етапів.
1-й етап. Будь-який запальний процес в суглобових тканинах супроводжується процесом інфільтрації тканин клітинами імунної відповіді — лімфоцитами, гранулоцитами, моноцитами. У стандартних умовах більшість цих клітин гине шляхом апоптозу та видаляється фагоцитами. Однак за умов масивного апоптозу, що може відбуватись під впливом токсинів, інфекційних агентів або генетичних дефектів фагоцитарної системи, деякі апоптичні клітини гинуть шляхом некрозу. Гранулоцити і моноцити містять специфічний фермент — пептидиларгініндеїміназу (PAD), який активується внаслідок підвищення концентрації цитозольного Са++, що відбувається під час апоптозу.
2-й етап. Коли клітини, що гинуть, не фагоцитуються в повному обсязі й починається некроз, вони виділяють свої внутрішньоклітинні цитруліновані протеїни та активовані PAD-ферменти. Саме ці ферменти (PAD2 і/або PAD4) здатні згодом цитрулінувати позаклітинні протеїни синовіальної оболонки (наприклад, фібрин). Однак проста поява цитрулінованих протеїнів не призведе до розвитку хронічного запалення, оскільки в 99 % випадків вони піддаються деградації без залучення гуморальної ланки імунної системи.
3-й етап. У випадках, коли цитруліновані фрагменти протеїнів презентуються Т-клітинам за посередництвом HLA, відбувається імунна відповідь на цитруліновані антигени, що проявляється синтезом IgG ACPA (ACPA — антитіла до цитрулінованого протеїну) з високим ступенем специфічності. Активація автореактивних клітин може відбуватися локально, у суглобі, а також може виникати й в інших тканинах. Внаслідок процесу цитрулінування ACPA або плазматичні клітини, що їх продукують, прямують у суглобові тканини. За даними літератури, процес цитрулінування в таких випадках безпосередньо пов’язують з особливостями головного комплексу гістосумісності (МHС).
4-й етап. Після надходження до синовіальної оболонки ACPA реагують з достатньою кількістю цитрулінованих антигенів, що знаходяться там. Zhao та співавтори вперше довели існування таких імунних комплексів (ІК) як у плазмі, так і в синовіальній рідині пацієнтів із РА. Ці ІК стимулюють запалення шляхом активації системи комплементу та подальшим залученням гранулоцитів, моноцитів та макрофагів шляхом комлементарного та Fcg-рецепторного шляхів активації. Таким чином, ACPA призводять до пролонгування запального процесу та його хронізації, що зумовлює тяжкість РА (рис. 1).
5-й етап. Нові моноцити та гранулоцити надходять до синовіальної оболонки, де вони будуть активовані та згодом загинуть, вивільнюючи нову частину активованих PAD-ферментів. Новий виток появи цитрулінованих антигенів та синтезу ACPA призведе до продовження та посилення запального процесу. Також було відмічено, що нові В-клітини, які синтезують IgM, постійно надходять до суглобу, ураженого ревматичним запаленням, підтверджуючи уявлення про те, що процес синтезу ACPA постійно стимулюється протягом усього періоду артриту [5–7].
Існування такого порочного кола в підсумку призведе до розвитку хронічного запалення, що проявляється типовою для РА клінікою.
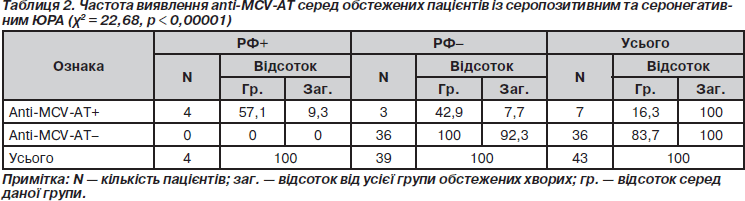
Обстеження на виявлення anti-MCV-антитіл (anti-MCV-АТ) було проведено 43 пацієнтам із ЮРА. Серед обстежених було 36 дівчаток та 7 хлопчиків. Серопозитивних пацієнтів було 4 (9,3 %) (3 дівчаток та 1 хлопчик). Підвищені титри anti-MCV-АТ зустрічаються приблизно з однаковою частотою (р < 0,05) у серопозитивних та серонегативних пацієнтів (відповідно 57,1 та 42,9 %). Проте в жодного з пацієнтів із нормальним титром anti-MCV-АТ не було виявлено РФ, що свідчить про високу специфічність (100 %) даного показника (табл. 2).
Серед серопозитивних пацієнтів підвищені титри anti-MCV-АТ були виявлені у всіх випадках, тоді як поміж серонегативних — у 7,7 % (р < 0,001), що також розцінюється нами як перспективний діагностичний результат.
Отже, встановлена вірогідна різниця за частотою виявлення РФ між групами пацієнтів з підвищеним та нормальним показником титрів anti-MCV (c2 = 22,68, р < 0,00001).
Результати розподілу частоти виявлення підвищених титрів anti-MCV-АТ свідчать про відсутність статистично значимої різниці (оцінка за критерієм c2) виявлення anti-MCV-АТ залежно від тривалості, форми, стадії та фази, активності захворювання під впливом вищевказаних ознак (р = 0,50–0,83).
Повторні аналізи на виявлення anti-MCV-АТ у дітей із початково негативним результатом, проведені через 6–12 місяців у 17 дітей, не дали результатів, що відрізняються від раніше отриманих даних.
Таким чином, підвищені титри anti-MCVбули виявлені в 7 пацієнтів, що становить 16,3 % від загальної кількості обстежених хворих. Отримані дані не дають можливості з упевненістю виключати діагноз ЮРА в пацієнтів із негативним результатом обстеження, однак, зважаючи на ще меншу інформативність РФ у діагностиці даного захворювання, ми вважаємо можливим використання anti-MCV-АТ як одного з ранніх діагностичних критеріїв ЮРА.
Серед інструментальних методів досліджень для ранньої та диференціальної діагностики ЮРА з іншими колагенозами широко використовуються рентгенографія, ультрасонографія (УЗД), денситометрія. В останні роки значної популярності в діагностиці уражень суглобів різної етіології набула магнітно-резонансна томографія (МРТ).
Нами було проведено та оцінено результати МРТ колінних суглобів 25 хворих на ЮРА, переважно із суглобовою формою. Середній вік пацієнтів був 11,5 років (від 6 до 17 років). Переважна більшість пацієнтів мала невелику тривалість захворювання — до 1 року — 60 %.
Серед отриманих результатів були виявлені зміни, недоступні для оцінки при виконанні попередньо проведеної рентгенографії та ультрасонографії, що стосуються м’якотканинних та кістково-хрящових структур суглоба.
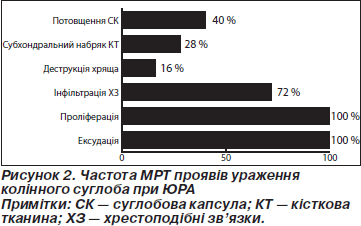
У ході проведення МРТ-дослідження були виділені такі зміни (рис. 2).
Отже, аналізуючи отримані дані МРТ, можна виділити такі ознаки:
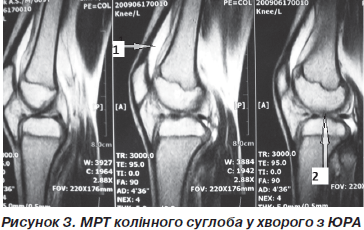
1. Збільшення об’єму верхнього завороту колінного суглоба (рис. 3, стрілка 1). Дані зміни простежувались вже на ранніх етапах розвитку синовіїту й були спричинені ексудативним компонентом запалення. По мірі тривалості захворювання ексудативний компонент доповнювався та зрештою майже повністю змінювався проліферацією синовіальної оболонки, що свідчило про прогресування суглобового синдрому. Збільшення об’ємів верхнього завороту спостерігалось у 25 пацієнтів (100 %).
2. Проліферація, потовщення синовіальної оболонки. Потовщення синовіальної оболонки візуалізувалося у всіх (100 %) хворих. Середня товщина синовіальної оболонки в пацієнтів становила 6,5 мм (від 1 до 12 мм).
3. Інфільтрація хрестоподібних зв’язок. У 18 пацієнтів (72 %) було виявлено інфільтрацію хрестоподібних зв’язок колінного суглоба, що проявлялося потовщенням та неоднорідністю їх контуру.
4. Стоншення, деструкція суглобового хряща. У 4 хворих (16 %) було виявлено стоншування та часткову деструкцію суглобового хряща, що являли собою поодинокі узурації, розташовані по краю суглобових виростків, та мали протяжність, що не перевищувала товщини суглобового хряща. У 3 хворих (12 %) з ознаками ерозій хрящової тканини були виявлені підвищені титри anti-MCV-АТ.
5. Субхондральний набряк кісткової тканини (рис. 3, стрілка 2). У 7 пацієнтів (28 %) визначалось дифузне посилення інтенсивності сигналу кісткового мозку на рівні епіфізів стегнової та великогомілкової кісток. Інтенсивність сигналу не залежала від ступеня проліферації синовіальної оболонки та спостерігалась як при виражених проліферативних змінах, так і в суглобах із переважно ексудативним компонентом. Дане явище пов’язане з набряком та гіперемією субхондральних тканин і призводить надалі до розвитку ерозій. У 4 пацієнтів з ознаками субхондрального набряку було виявлено підвищені титри anti-MCV-АТ, і тільки 1 пацієнт був серопозитивним. Таким чином, підвищені титри anti-MCV-АТ можуть визначати негативний прогноз у розвитку ерозій хрящової тканини.
6. Потовщення капсули колінного суглоба було виявлено в 40 % (10 пацієнти), воно проявлялось у вигляді смуги з інтенсивністю сигналу, що перевищувала таку від навколишніх м’яких тканин.
Висновки
1. Включення до алгоритму діагностики ЮРА визначення антитіл до цитрулінованих протеїнів доповнює загальноприйняті критерії й орієнтоване на потреби сучасної ревматологічної практики — якомога більш раннє виявлення хворих і проведення диференціальної діагностики з іншими артритами з метою своєчасного призначення адекватної комплексної терапії, що знайшло відображення в нових діагностичних критеріях РА (ELAR, 2010).
2. За відсутності належних лабораторних підтверджень діагнозу вирішальне значення будуть мати результати клінічного та інструментальних методів діагностики. МРТ-обстеження суглобів при встановленні діагнозу ЮРА має високу діагностичну цінність для виявлення внутрішньосуглобових, хрящових та кісткових ушкоджень, що сприятиме ранньому призначенню адекватної терапії.
Бережний В.В., Марушко Т.В. Характеристика клінічного перебігу ювенільного ревматоїдного артриту на сучасному етапі // Здоровье женщины. — 2005. — № 4(25).
Бережний В.В., Марушко Т.В., Гавриленко Т.І. Роль аутоантитіл до тканинних антигенів у розвитку патологічного процесу при ювенільному ревматоїдному артриті // Перинатология и педиатрия. — 2006. — № 1(25). — С. 109-113.
Бережний В.В., Марушко Т.В., Марушко Ю.В. Особливості клінічного перебігу ревматоїдного артриту у дітей підліткового віку // Здоровье ребенка. — № 1. — 2006.
Лукьянова Е.М., Омельченко Л.И., Ципкун А.Г. и др. / Под ред. Е.М. Лукьяновой, Л.И. Омельченко. Ревматоидный артрит у детей: Современные аспекты патогенеза, клиники, диагностики и лечения. — К.: Книга-плюс, 2002.
Cassidy J.T. Juvenile rheumatoid arthritis / J.T. Cassidy // Ruddy S., Harris E.D. Jr., Sledge C.B. [eds]. Kelley’s text- book of rheumatology. — Philadelphia: W.B. Saunders Co, 2001. — 6th ed. — P. 1297-1313.
Early predictors of poor functional outcome in systemic-onset JRA. A multicenter cohort study / Spiegel L.R., Schneider R., Lang B.A. [et al.] // Arthr. Rheum. — 2000. — Vol. 43. — P. 2402-2409
Tak P.P. The pathogenesis and prevention of joint damage in rheumatoid arthritis — advances from synovial biopsy and tissue analysis / P.P. Tak, B. Bresnihan // Arthritis Rheum. — 2000. — Vol. 43. — P. 2619-2633.
Vossenaar E.R., Zendman A.J., Van Venrooij W.J. Citrullination, a possible functional link between susceptibility genes and rheumatoid arthritis // Arthritis Res. Ther. — 2004. — 6. — 1-5.
Walther J. van Venrooij, Ger J.M. Pruijn. An important step towards completing the rheumatoid arthritis cycle // Arthritis Research & Therapy. — 2008. — 10. — 117 (doi:10.1186/ar2504)
Zhao X., Okeke N.L., Sharpe O., Batliwalla F.M., Lee A.T., Ho P.P., Tomooka B.H., Gregersen P.K., Robinson W.H. Circulating immune complexes contain citrullinated fibrinogen in rheumatoid arthritis // Arthritis Res. Ther. — 2008. — 10. — R94.