Журнал «Здоровье ребенка» 5 (32) 2011
Вернуться к номеру
Опыт применения полного или частичного парентерального питания у детей младшей возрастной группы (до 5 лет), страдающих онкогематологическими заболеваниями
Авторы: Карелин А.А., Ласков М.С. НИИ ДОГ РОНЦ им. Н.Н. Блохина РАМН, г. Москва, Россия
Рубрики: Педиатрия/Неонатология
Версия для печати
Парентеральное питание является важной составляющей лечения детей со злокачественными новообразованиями ЦНС, гемобластозами и другими заболеваниями. В отделении химиотерапии гемобластозов в течение нескольких лет применялось парентеральное питание препаратом ОлиКлиномель у маленьких детей, страдающих различными онкологическими и гематологическими заболеваниями. Наблюдали группу из 25 детей различного возраста, в том числе до 2 лет. Накоплен ценный опыт, позволяющий говорить о возможности использования препарата ОлиКлиномель в детской практике у пациентов младшей возрастной группы.
Дети, злокачественные новообразования ЦНС, гемобластозы, парентеральное питание.
Введение
Одной из наиболее актуальных проблем современной онкопедиатрии является питание ребенка, получающего курс противоопухолевого лечения. Зачастую в клинику поступают дети, имеющие выраженный дефицит массы тела, что является не только признаком основного заболевания, но и тяжелым преморбидным фоном, который значительно ухудшает переносимость лечения и прогноз заболевания. Маленькие дети имеют характерные особенности метаболизма, проявляющиеся высокими энергетическими и пластическими затратами. Они дополняются у больных детей повышенным катаболизмом, обусловленным наличием опухоли. Поэтому важно своевременное решение проблемы качественного полноценного и сбалансированного питания для детей младшей возрастной группы [7]. Одним из первых симптомов болезни ребенка, как правило, является ухудшение аппетита, что вызывает достаточно быстрое развитие нутритивной недостаточности [1]. Считается [6, 7], что синдром недостаточности питания развивается при дефиците основных пищевых веществ (белки, жиры, углеводы, витамины, макро- и микроэлементы).
Своевременная и адекватная поддержка нутритивного статуса ребенка позволяет восполнить сформировавшийся дефицит питательных веществ, в значительной степени сократить частоту инфекционных осложнений и летальность больных. Существуют разные способы коррекции энергетической недостаточности и дефицита основных питательных веществ: коррекция суточного рациона пероральными диетами, зондовым энтеральным питанием, частичным или полным парентеральным питанием, а также их комбинациями. Бесспорно, энтеральное питание является наиболее физиологичным, оно экономически выгоднее, как правило, не вызывает тяжелых осложнений и не требует соблюдения специальных правил асептики и антисептики, способствует участию желудочно-кишечного тракта в процессе пищеварения и препятствует развитию атрофических процессов слизистой стенки кишечника [10].
Показания к проведению искусственной нутритивной поддержки многообразны, и в целом их можно описать как заболевания или состояния, при которых потребность ребенка в нутриентах не может быть обеспечена естественным путем, т.е. не позволяющие проводить пероральное питание: кома, сопор, другие нарушения сознания, неэффективность энтерального зондового питания, выражающаяся клинически в отсутствии прибавки массы тела, сохранение низких биохимических показателей белкового обмена — нарушение азотистого баланса, выраженный дефицит массы тела при поступлении в клинику, проведение противоопухолевого лечения и применение других медикаментов, снижающих аппетит [7].
Применение любого препарата, тем более вводимого внутривенно парентерального питания, может вызвать массу побочных эффектов, таких как аллергические реакции, гипертермия, диспептические расстройства, тошнота, токсическое воздействие препарата на печень — нарастание трансаминаз, билирубина, появление желтухи, гепатоспленомегалия, метаболические нарушения, «синдром жировой перегрузки» [12].
Ранее считалось [9], что длительное проведение парентерального питания может быть сопряжено с большим количеством осложнений. Как правило, применявшиеся препараты для искусственного питания изготавливались на основе растворов глюкозы, их длительное введение приводило к тяжелым метаболическим, респираторным, септическим расстройствам, тяжело поддающимся коррекции (гипергликемия, дыхательная недостаточность, стеатоз печени, осмотический диурез, гипофосфатемия, задержка жидкости, дефицит незаменимых жирных кислот). В настоящее время концепция искусственного питания изменилась.
Известно [4], что инфузии липидных эмульсий, представляющих собой изоосмолярные растворы, способны обеспечить восполнение высоких энергетических потребностей.
При полном парентеральном питании с введением препаратов на основе глюкозы и без жировой эмульсии через некоторое время (в течение 7–10 дней) формируется доказанный биохимическими исследованиями дефицит высокомолекулярных и других жирных кислот [2].
Поскольку у тяжелобольных пациентов растет необходимость введения растворов с большой энергетической емкостью, парентеральное применение препаратов на основе жировых эмульсий снижает зависимость пациента от глюкозы как источника энергии [3, 5, 11, 15], уменьшая риск развития побочных эффектов.
Материалы и методы
В данной статье описывается опыт практического применения парентерального питания у детей младшей возрастной группы, страдающих различными онкологическими заболеваниями, в том числе опухолями ЦНС различной локализации. Эти дети зачастую находятся в стационаре без сознания, имеют нарушения глотательных и пищеварительных функций центрального генеза, получают высокоинтенсивную химиотерапию, имеющую тяжелые побочные эффекты.
В таких случаях возрастает важность применения препаратов парентерального питания, позволяющих независимо от состояния пациента обеспечивать ему восполнение энергии и основных питательных веществ в виде вводимых внутривенно легкоусвояемых компонентов.
В отделе химиотерапии гемобластозов НИИ ДОГ РОНЦ накоплен незаменимый клинический опыт применения препарата ОлиКлиномель (Baxter) в условиях работы с тяжелобольными детьми раннего возраста. ОлиКлиномель относится к группе препаратов для парентерального питания «все в одном»: в одном пластиковом мешке, разделенном на три секции, совмещены все необходимые питательные вещества — растворы аминокислот, глюкозы и жировых эмульсий. У такой системы есть ряд неоспоримых преимуществ по сравнению с флаконной методикой:
— промышленный метод приготовления, исключающий возможность ошибок при разведении;
— удобство применения — перегородки между секциями легко разрушаются после выполнения ряда простых действий, обеспечивая равномерное смешивание ингредиентов непосредственно перед применением;
— стабильность готового препарата в течение длительного времени;
— удобство расчета необходимой дозировки и контроля введения: используется один инфузионный насос и одна инфузионная система;
— уменьшение количества манипуляций медицинского персонала;
— снижение риска контаминации.
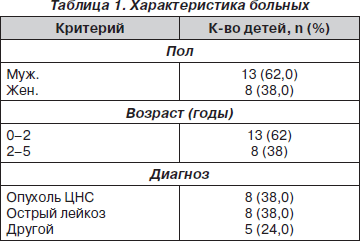
Несмотря на указанные преимущества, до недавнего времени данная группа препаратов не имела широкого использования в детской практике в связи с имевшимися представлениями о возможных тяжелых осложнениях при введении большого объема жировых эмульсий в организм ребенка. Однако проведенные исследования и наблюдения свидетельствуют о наличии преимуществ в/в жировых эмульсий на основе оливкового масла по сравнению с эмульсиями на основе соевого масла и с растворами глюкозы. Эти преимущества реализуются в обеспечении достаточного и сбалансированного поступления высокомолекулярных жирных кислот, предотвращающего развитие их дефицита [13], в уменьшении риска поступления полиненасыщенных жирных кислот, стимулирующих усиление процессов перекисного окисления липидов и повреждение мембранных структур клеток, снижение иммунитета [8, 14]. Учитывая описанные преимущества жировых эмульсий на основе оливкового масла, применение парентерального питания препаратом ОлиКлиномель у детей имеет важное клиническое значение. Наблюдение проводилось с 01.2006 по 10.2009 г. За это время проанализирована клиническая эффективность полного и частичного парентерального питания у 21 ребенка возрастной категории до 5 лет, страдающих различными онкологическими заболеваниями (включая острый лейкоз и опухоли ЦНС различной локализации) и получающих высокоинтенсивную химиотерапию. В группе 13 мальчиков и 8 девочек. Данные суммированы в табл. 1.
Для пациентов изучаемой группы были определены следующие показания к проведению парентерального питания:
— выраженный дефицит массы тела;
— невозможность перорального питания в связи с нарушениями сознания;
— неэффективность проводимого энтерального питания.
Как правило, необходимость проведения коррекции нутритивного статуса продиктована тяжестью заболевания.
В изучаемой группе требовали проведения парентерального питания пациенты:
1) с новообразования ЦНС (эпендимомы, медуллобластомы, АТРО, ПНЭО, хориоидкарциномы) — 8 (38 %) детей;
2) с опухолями:
— в задней черепной ямке;
— полушариях;
— полостях боковых желудочков;
— III и IV желудочках мозга;
3) с острыми лейкозами:
— лимфобластным — 3 ребенка (14 %);
— миелобластным — 5 детей (24 %);
4) с другими заболеваниями.
Необходимый суточный объем и скорость введения препарата рассчитывали индивидуально исходя из рекомендаций, приведенных в инструкции по применению препарата, учитывая:
— состояние ребенка;
— суточную потребность организма в энергии и основных питательных веществах;
— наличие инфекционного процесса.
Длительность приема препарата была различной и зависела от того, как быстро:
1) стабилизируется состояние ребенка;
2) восстановится должная масса тела;
3) появится возможность для достаточного энтерального питания.
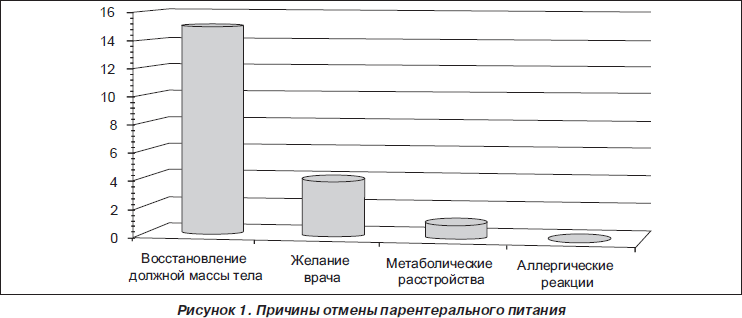
Проведение парентерального питания прекращали, если ребенок набрал должную массу тела и была возможность дальнейшего полноценного энтерального питания, если у ребенка возникли метаболические расстройства, выраженные клинически и подтвержденные лабораторно, если в процессе применения появились аллергические реакции (не возникли ни в одном случае в нашей серии наблюдений).
Также в некоторых случаях применение препарата прекращали, если ребенок начинал самостоятельно питаться и объем питания и его энергетическая ценность могли покрыть суточные потребности организма (рис. 1).
Результаты
За время наблюдения препарат ОлиКлиномель применялся в виде полного или частичного парентерального питания у 21 ребенка с различными онкологическими заболеваниями в течение длительного времени. Отмечались выраженное нарастание массы тела, улучшение общего состояния, нормализация основных обменных процессов.
Результаты и выводы
ОлиКлиномель при длительном применении в качестве полного и частичного парентерального питания показал себя как высокоэффективный препарат для качественной коррекции нутритивного статуса больного ребенка. ОлиКлиномель содержит все необходимые для организма вещества в достаточном количестве и надлежащих соотношениях друг с другом, препятствует обезвоживанию организма, безвреден в применении у маленьких детей и очень удобен в практической работе.
Инфузией препарата ОлиКлиномель в разных режимах (в виде круглосуточного или продленного введения) удавалось не только восполнить суточную потребность организма больного ребенка в энергии, но и обеспечить поступление достаточного количества пластического материала, позволяющего при длительном полном или частичном парентеральном питании получить восстановление должной массы тела и процессов нормального метаболизма.
Применение препаратов парентерального питания позволяет не только четко регулировать поступление энергии и питательных веществ в организм по часам, но и контролировать водно-электролитный баланс. При интенсивном применении препарата побочная реакция возникла лишь у одного ребенка из группы до 2 лет. Она проявилась в виде так называемого метаболического синдрома возобновления питания (refeeding syndromе) и характеризовалась гипокалиемией, гипофосфатемией, одышкой, метаболическим ацидозом, нарастанием pCO2. Ребенок исходно был очень истощен, метаболические расстройства возникли на фоне основного заболевания. Развившиеся осложнения скорректированы посредством временной отмены препарата и симптоматической терапии без опасных для жизни осложнений. Исходя из практического опыта применения препарата ОлиКлиномель у маленьких детей целесообразно рекомендовать его для применения тяжелобольным пациентам младшего возраста, по показаниям нуждающимся во введении препаратов полного и частичного парентерального питания.
Клинический пример
Больная Полина К., 2 лет 10 мес., поступила в отделение химиотерапии гемобластозов с диагнозом АТРО, 5 мес. от начала болезни. Оперирована через 3 нед. (удаление опухоли III желудочка).
Из анамнеза: росла и развивалась нормально, однако отмечалось равномерное снижение росто-весовых показателей, и в 1 год девочка весила 7700 г.
До заболевания в возрасте 2,5 года весила около 10 кг, после чего отмечалось выраженное снижение массы тела.
Ребенок поступил в стационар с весом 8 кг, ростом 87 см, таким образом, дефицит массы тела составил 43 %, по росто-весовым показателям развитие оценено как низкое (ниже 3-го процентиля), дисгармоничное за счет дефицита массы тела.
Состояние тяжелое, сопор, практически не могла получать пищу через рот, так как на фоне нарушения сознания страдала функция глотания.
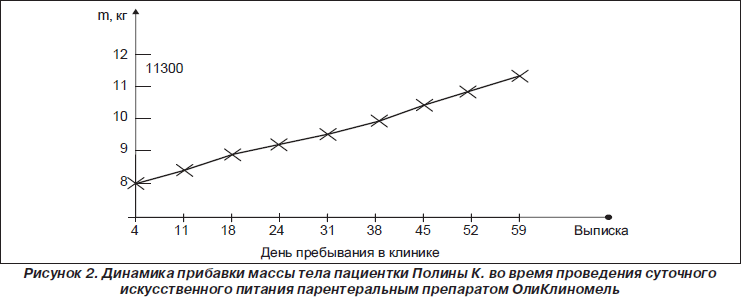
С начала пребывания в клинике ребенку проводилась инфузия препарата ОлиКлиномель N7-1000Е вместе с обычным рационом: V-инфузии 10 мл/час непрерывно круглосуточно до операции и в течение 30 дней после операции (рис. 2).
Заметная прибавка массы тела — за первую неделю 300 г, положительная динамика — дальнейшая постоянная прибавка массы тела, улучшение самочувствия, тургора кожи, в целом за период 8 недель ребенок прибавил 40 % веса от зарегистрированного при поступлении в стационар.
Таким образом, исходя из данных анализа длительного наблюдения за тяжелобольными детьми препарат ОлиКлиномель можно рекомендовать для применения в качестве полного или частичного парентерального питания у детей всех возрастных групп, включая детей первых двух лет жизни.
Впервые опубликовано в журнале «Детская онкология» / Pediatric oncology, № 1—2, 2010
1. Бахман А.Л. Искусственное питание / Под ред. А.Л. Костюченко: Пер. с англ. — М.; СПб., 2001. — С. 89-90.
2. Adolph M., Hailer S., Echart J. Serum phospholipid fatty acids in severely injured patients on total parenteral nutrition with medium chain/long chain triglyceride emulsions // Ann. Nutr. Metab. — 1995. — 39(4). — 251-60.
3. Baker A.L., Rosenberg I.H. Hepatic complications of total parenteral nutrition // Am. J. Med. — 1987. — 82(3). — 489-97.
4. Biolo G., Grimble G., Preiser J.C. et al. Position paper of the ESICM Working Group on Nutrition and Metabolism. Metabolic basis of nutrition in intensive care unit patients: ten critical questions // Intensive Care Med. — 2002. — 28(11). — 1512-20.
5. Driscoll D.F., Blackburn G.L. Total parenteral nutrition 1990. A review of its current status in hospitalised patients, and the need for patient specific feeding // Drugs. — 1990. — 40(3). — 346-63.
6. Forbe R.A., Schitzgal H.M. The assessment of malnutrition // J. Surg. — 1980. — 88. — P. 17-24.
7. Haider M., Haider S.Q. Assessment of protein-calorie malnutrition // Clin. Chem. — 1984. — 30. — 1286-1299.
8. Halliwell B., Chirico S. Lipid peroxidation: its mechanism, measurement and significance // Am. J. Clin. Nutr. — 1993. — 57. — 715S-724S.
9. Howard L. Enteral and Parenteral Nutrition Therapy // Harrison’s Principles of Internal Medicine. — 14th ed. — Vol. 1. — New York: McGraw-Hill, 1998. — P. 21-26.
10. Jeeleebhoy K.N. Total parenteral nutrition: potion or poison? // Am. J. Clin. Nutr. — 2001. — 74(2). — 160-3.
11. Jeejeebhoy K.N., Anderson G.H., Nakhooda A.F. et al. Metabolic studies in total parenteral nutrition with lipid in man. Comparison with glucose // J. Clin. Invest. — 1976. — 57(1). — 125-136.
12. Brandstдtter M. Parenterale Ernдhrung: Indikationen, Techniken, Organisation. — 1.Aufl. — Mьnchen: Elsevier, 2002.
13. Munck A., Marinier E., Perennec V. et al. Comparison of fatty acid status in TPN-dependent children receiving two lipid emulsions with different essential fatty acid (EFA) content // Clin. Nutr. — 1993. — 12 (Suppl. 2). — P. 17.
14. Pitkanen O., Hallman M., Anderson S. Generation of free radicals in lipid emulsion used in parenteral nutrition // Pediatr. Res. — 1991. — 29. — 56-9.
15. Sheldon G.F., Peterson S.R., Sanders R. Hepatic dysfunction during hyperalimentation // Arch. Surg. — 1978. — 113(4). — 504-8.