Журнал «Здоровье ребенка» 5 (32) 2011
Вернуться к номеру
Реологические свойства крови и эндотелиальная функция сосудов при ювенильном ревматоидном артрите
Авторы: Прохоров Е.В., Синяченко О.В., Орлова А.К., Яковленко А.Ю. Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Версия для печати
В патогенезе ювенильного ревматоидного артрита важную роль играют нарушения реологических свойств крови и эндотелиальной функции сосудов, показатели которых взаимозависимы, связаны с активностью патологического процесса, тяжестью суставного синдрома и наличием висцеральных проявлений болезни, а параметры эритроцитарно-тромбоцитарного (агрегация, деформируемость клеток) и плазменного звеньев реологических свойств крови (вязкость, вязкоэластичность, релаксация, поверхностное натяжение), эндотелина, циклического гуанозинмонофосфата и нитритов в крови обладают прогностической значимостью в отношении течения заболевания.
Ювенильный артрит, кровь, реология, эндотелий.
Введение
У взрослых больных ревматоидным артритом имеют место нарушения реологических свойств крови (РСК) и эндотелиальная дисфункция сосудов (ЭДС) в патогенезе заболевания [1, 4]. Показано, что изменения функции эндотелия наблюдаются даже при минимальной степени активности ревматоидного процесса и без манифестных признаков сосудистой патологии, коррелируя с титрами ревматоидного фактора в крови [20].
При ювенильном ревматоидном артрите (ЮРА) изменения со стороны сердечно-сосудистой системы стали также рассматриваться в контексте возможных нарушений РСК [13, 15, 17, 19] и эндотелиальной функции сосудов (ЭФС) [2, 7, 9, 10], причем даже установлены сдвиги гемореологии в капиллярах синовиальной мембраны [16]. Можно предположить, что дальнейшее выяснение изменений РСК и ЭФС при ЮРА будет способствовать определению новых звеньев патогенеза заболевания, улучшению качества ранней диагностики патологического процесса, разработке критериев, позволяющих прогнозировать течение болезни. Это стало целью и задачами данного исследования.
Материалы и методы
Под наблюдением находились 59 больных ЮРА в возрасте от 3 до 16 лет (в среднем 9,60 ± 0,46 года). Среди обследованных детей было 64 % девочек и 36 % мальчиков. Средняя продолжительность заболевания составляла 4,60 ± 0,33 года. У 25 % больных констатирована минимальная степень активности патологического процесса, у 48 % — умеренная и у 27 % — высокая. Олигоартрит установлен у каждого пятого обследованного ребенка с ЮРА. Серопозитивный вариант заболевания диагностирован у 10 % больных (у одного ребенка с олигоартритом). I рентгенологическая стадия патологического процесса констатирована в 31 % наблюдений, II — в 27 %, III — в 36 %, IV — в 6 %. У 61 % больных отмечены внесуставные признаки болезни.
Всем больным выполняли рентгенологическое (аппарат Multix-Compact. Siеmens, Германия) и ультразвуковое (аппарат EnVisor, Philips, Голландия) исследование периферических суставов, крестцово-подвздошных сочленений и шейного отдела позвоночника. Для оценки РСК определяли индексы агрегации (μ) и деформируемости (d) эритроцитов, индекс агрегации тромбоцитов (w), изучали вязкость плазмы крови (h), модуль вязкоэластичности (e), время релаксации (t) и поверхностное натяжение (s) сыворотки крови. C помощью реологического анализатора «АКР-2» (Россия) исследовали μ, d и w путем измерения светопропускания в богатой тромбоцитами плазме крови (применяли агрегометр «Биола», Россия), h определяли на ротационном вискозиметре Low Shear-30 (Швейцария) в диапазоне скоростей сдвига 1,28–128 с–1. При исследовании e, s и t сыворотки крови использовали метод анализа формы осесимметричных капель (компьютерный тензиореометр ADSA-Toronto, Германия — Канада). ЭФС оценивали по содержанию в крови эндотелина-1 (ЕТ1), циклического гуанозинмонофосфата (GMP) и нитритов (NO2). Уровни в сыворотке крови EТ1 и GMP, являющегося вторичным мессенджером оксида азота, определяли иммуноферментным методом (ридер PR2100 Sanofi diagnostic pasteur, Франция, наборы Amersham pharmacia biotech, Великобритания, и ProCon, Россия). Состояние метаболизма оксида азота изучали спектрофотометрически (длина волны 540 нм) по концентрации NO2 в сыворотке с помощью реактива Грейса. В качестве контроля обследованы 20 практически здоровых детей (8 мальчиков и 12 девочек) в возрасте от 3 до 16 лет.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (лицензионные программы Microsoft Excel и Statistica, StatSoft, США). Оценивали средние значения (M), их ошибки (m), среднеквадратические отклонения, коэффициенты корреляции, критерии регрессии, дисперсии, Стьюдента (t), Уилкоксона — Рао, хи-квадрат и достоверность статистических показателей (p).
Результаты
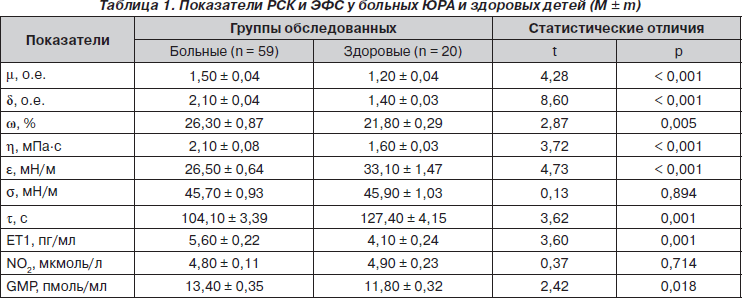
Показатели РСК и ЭФС при ЮРА и у здоровых детей представлены в табл. 1. У больных на 1/4 достоверно возрастают параметры m и w, в 1,5 раза — d, на 31 % — h, в 1,4 раза — ЕТ1, на 14 % — GMP при уменьшении на 20 % e и на 18 % t, что констатируется (M ± 3m здоровых) соответственно в 64, 88, 61, 54, 66, 48, 58 и 59 % случаев.
На интегральное состояние эритроцитарно-тромбоцитарного звена (ЭТЗ) РСК при ЮРА влияют пол больных и степень активности патологического процесса. Однофакторный дисперсионный анализ показывает воздействие длительности заболевания и степени его активности на d. В свою очередь, регрессионные сопоставления свидетельствуют о прямой зависимости d от продолжительности ЮРА, степени его активности и рентгенологической стадии. К тому же с увеличением длительности болезни возрастает w. С учетом влияния пола на ЭТЗ РСК при ЮРА мы провели дополнительный анализ. Как оказалось, параметры m у мальчиков достоверно выше на 7 %. Подчеркнем, что у больных девочек установлена более высокая степень активности заболевания с более частым развитием полиартрита, но меньшими рентгенологическими изменениями со стороны артикулярного аппарата. По данным однофакторного дисперсионного анализа, имеет место влияние на тяжесть артрита, оцененную по индексу Ричи, параметров m. По нашим данным, уровень m > 3 о.е. является прогностически неблагоприятным критерием в отношении течения ЮРА. Кроме того, полученные данные свидетельствуют об участии изменений деформируемости эритроцитов в патогенетических построениях при ЮРА.
На интегральное состояние плазменного звена (ПЗ) РСК при ЮРА оказывают воздействие степень активности патологического процесса и наличие экстраартикулярных признаков болезни. Однофакторный дисперсионный и регрессионный анализы демонстрируют прямую связь активности ЮРА с показателями h и t. В связи с этим мы считаем, что уровни h > 3 мПа·с и e < 90 c всегда указывают на высокую степень активности патологического процесса.
Если пол больных не влияет на ПЗ РСК в целом, то такая зависимость имеет место в отношении вязкоупругих свойств сыворотки крови. Так, в группе мальчиков констатируются более низкие (на 11 %) значения e при более выраженных костно-деструктивных изменениях со стороны суставов. Тяжесть ЮРА влияет на межфазную активность сыворотки крови. В свою очередь, от распространенности суставного синдрома прямо зависит h. Нужно подчеркнуть, что последняя определяет реологическое «поведение» вязкости цельной крови, а s зависит от содержания в крови белковых и липидных сурфактантов и неорганических поверхностно-инактивных веществ [14].
Обсуждение результатов
Повышенную h при ревматоидном артрите у взрослых во многом определяют молекулярный состав и конфигурация сывороточных белков. Изучение h для оценки степени активности патологического процесса превосходит значимость скорости оседания эритроцитов и содержания в сыворотке крови С-реактивного протеина [11]. Более отчетливое увеличение параметров h обнаруживается у больных ревматоидным васкулитом с дигитальным артериитом [5]. В таких случаях наблюдается наибольшее снижение текучих свойств крови, а значит, и гемореологических нарушений в сосудах различного калибра.
По данным многофакторного дисперсионного анализа, на интегральное состояние ЭФС при ЮРА оказывает влияние степень активности патологического процесса, но не пол больных, их возраст, длительность и стадия заболевания, его серопозитивность и внесуставные проявления. Множественный регрессионный анализ свидетельствует о том, что ЭДС с возрастом больных увеличивается. Несмотря на то что средний уровень нитритемии при ЮРА не изменяется, именно на этот показатель, по результатам однофакторного дисперсионного анализа, влияет степень активности заболевания. Такие данные подтверждаются и регрессионными сопоставлениями. Мы считаем, что показатели NO2 > 6 мкмоль/л указывают на высокую степень активности ЮРА. Тяжесть поражения суставов оказывает воздействие на параметры GMP. В свою очередь, выраженность артрита прямо зависит от уровня GMP в крови. Показатели GMP > 20 пмоль/мл являются неблагоприятными в отношении течения ЮРА.
Среди всех групп суставов при ЮРА только поражение пястнофаланговых сочленений оказывает достоверное воздействие на интегральное состояние ЭТЗ РСК. Вовлечение в патологический процесс этих суставов влияет на параметры m и w. Отметим, что эта группа сочленений поражается у 64 % больных ЮРА. Не обнаружено какого-либо достоверного влияния ни эпифизарного остеопороза, ни выраженности сужения суставной щели, ни наличия остеокистоза, ни краевой узурации костей, ни анкилоза. В свою очередь, однофакторный дисперсионный и регрессионный анализы свидетельствуют о четком влиянии w на развитие процессов анкилозирования в суставах. К неблагоприятным признакам в отношении анкилозирования суставов при ЮРА относятся показатели w > 30 %.
На интегральное состояние ПЗ РСК не оказывает воздействия поражение отдельных суставов. Однофакторный дисперсионный анализ демонстрирует связь h с поражением локтевых суставов, e — височно-нижнечелюстных, t — крестцово-подвздошных. Общее состояние ПЗ РСК при ЮРА не определяется наличием у больных тех или иных рентгенологических признаков заболевания. Вместе с тем анкилозирование суставов (а значит, и IV стадия ЮРА) оказывает воздействие на изменение вязкоупругих и релаксационных свойств сыворотки крови. Дисперсионный анализ указывает на связь артроанкилоза с e, а регрессионный — с t. Полученные данные позволяют рекомендовать практическому врачу в качестве критериев тяжести ЮРА следующие показатели: e < 20 мН/м и t < 90 c.
Интегральное состояние ЭФС при ЮРА также не связано с поражением тех или иных суставов. Однофакторный дисперсионный анализ показывает существенное влияние на уровень GMP в крови поражений голеностопных, лучезапяcтных и крестцово-подвздошных сочленений, а первые из них еще определяют уровень эндотелинемии. Анкилозирование суставов способствует повышению в крови параметров ЕТ1, развитие остеокистоза — уровня NO2. Содержание ЕТ1 > 7 пг/мл при ЮРА является неблагоприятным фактором в отношении формирования суставного анкилоза. Множественный регрессионный анализ указывает на прямую зависимость от ЭФС у больных ЮРА развития эпифизарного остеопороза, а рентгенологические признаки суставного синдрома определяют показатели нитритемии. Однофакторный анализ не обнаруживает достоверных связей отдельных костно-деструктивных изменений с параметрами ЕТ1, NO2 и GMP.
ЭТЗ РСК при ЮРА зависит от наличия лихорадочного синдрома. В связи с этим необходимо дать некоторые комментарии. По данным литературы [6], на d оказывает существенное влияние температура плазмы крови. Так, при повышении последней деформируемость красных кровяных телец возрастает, однако длительное воздействие лихорадки приводит к обратному эффекту, что связывают с уменьшением содержания аденозинтрифосфата и дефосфорилированным состоянием спектрина.
Помимо лихорадочного синдрома, на ЭТЗ РСК влияет поражение глаз в виде увеита. Агрегационные свойства эритроцитов зависят от наличия у больных лимфаденопатии, поражения сердца и легких. Данные регрессионного анализа в этом плане оказались недостоверными. Повышение температуры тела воздействует и на ПЗ РСК. Фактически это во многом ассоциируется со степенью активности патологического процесса. По данным однофакторного дисперсионного анализа, ревматоидные узелки и патология сердца воздействуют на t сыворотки крови, а, как свидетельствует регрессионный анализ, параметры h прямо определяются печеночной патологией.
От наличия подкожных ревматоидных узелков, спленомегалии, кардита и плевропневмонита достоверно зависит уровень GMP в крови, а на содержание ЕТ1 оказывает значительное влияние поражение кожи. Возможно, именно перечисленные экстраартикулярные признаки ЮРА требуют коррекции ЭДС. Важным представляется факт, что состояние ЭФС принимает участие в формировании внесуставных проявлений ЮРА, о чем свидетельствуют данные многофакторного дисперсионного анализа. Имеет место также четкое влияние на системные признаки болезни ЕТ1. По данным регрессионного анализа, развитие лимфаденопатии обратно соотносится с показателями NO2 и GMP, а возникновение увеита прямо определяется возрастанием в крови содержания циклического нуклеотида. Одним из критериев возможного развития поражения глаз при ЮРА является увеличение GMP > 20 пмоль/мл.
Существуют тесные прямые корреляционные связи параметров d с концентрациями в крови иммуноглобулина (Ig) M и циркулирующих иммунных комплексов (ЦИК). Агрегация эритроцитов происходит с участием крупномолекулярных белков плазмы (фибриноген, IgМ, a1-, a2-, b-глобулины, криоглобулины), образующих моcтики между клетками [8]. Увеличение концентрации макромолекул при ЮРА может приводить к агрегации эритроцитов, а препятствовать последней способен альбумин, конкурирующий с высокомолекулярными белками за сорбционные центры, но не создающий мостики между эритроцитами вследствие малой молекулярной массы [18].
Нужно заметить, что повышение h наблюдается у каждого второго взрослого больного с ревматическими болезнями, а корреляционный анализ реологических и иммунологических показателей (содержание IgG и ЦИК) обнаруживает сильную связь именно при ревматоидном артрите [3]. У таких пациентов выраженные изменения вязкоэластичных свойств крови обусловлены наличием в сыворотке промежуточных ЦИК с константами седиментации 10S-18S или их сочетания с комплексами 22S. Характерно, что при ревматоидном артрите 22S присутствуют в значительном количестве, повышая h. Как считают L.J. Jara et al. [12], гипервязкий синдром при ревматоидном артрите взрослых возникает в связи с наличием промежуточных ЦИК, содержащих ревматоидный фактор и IgМ. По нашим данным, уровень ЦИК и содержание в сыворотке крови отдельных классов Ig не коррелируют с параметрами ПЗ РСК. В свою очередь, концентрация сывороточного фибриногена разнонаправленно ассоциируется с показателями h (позитивно) и e (негативно). Необходимо отметить, что, несмотря на определенную связь ЭДС со степенью активности ЮРА, нами обнаружена лишь прямая корреляционная взаимозависимость содержания в крови GMP и уровня С-реактивного протеина. Имеет место достоверная прямая связь между h и m, обратная — между e и d. Эти данные подтвержают тесные отношения в патогенетических построениях при ЮРА ЭТЗ и ПЗ РСК.
У здоровых детей существуют достоверные корреляционные связи показателей ЭТЗ (m « d « w) и ПЗ (e « s « t) РСК, которые не соотносятся с параметрами ЭФС. По данным многофакторного дисперсионного анализа, отсутствует влияние ЭТЗ на интегральное состояние s и ЭФС, ПЗ — на ЭФС, ЭФС — на ЭТЗ и ПЗ РСК. Однофакторный дисперсионный анализ свидетельствует о воздействии на s сыворотки крови показателей ЕТ1 и t. Регрессионные сопоставления указывают на зависимость ЭФС от m, d, w, h, s и t, ПЗ РСК — от w, ЭТЗ РСК — от h и s.
При ЮРА корреляционные связи показателей ЭТЗ РСК, ПЗ РСК и ЭФC изменяются. Так, h имеет обратную взаимозависимость с e и t, e прямо соотносится с t, NO2 разнонаправленно коррелируют с параметрами ЕТ1 и GMP. ЭФС у больных ЮРА мало зависит от состояния ЭТЗ и ПЗ, как, впрочем, и незначительно определяет эти составляющие РСК. ЭФС имеет зависимость от значений m, d, w и e, а также от t. h прямо воздействует на уровень GMP, причем результаты регрессионного анализа подтверждают и данные однофакторного дисперсионного анализа. Кроме того, установлено высокодостоверное влияние релаксационных свойств крови на показатели эндотелинемии.
Вязкостные свойства плазмы у больных ЮРА прямо определяются содержанием в крови ЕТ1 и GMP, а межфазная активность сыворотки обратно соотносится с показателями нитритемии. Фактически со стойкими конечными продуктами метаболизма оксида азота связаны белковые, липидные, небелковые азотистые и неорганические поверхностно-активные (сурфактанты) и поверхностно-неактивные (инсурфактанты) вещества, от которых, как известно, зависит статическое (равновесное) s биологических жидкостей.
В заключение следует отметить, что существует три типа гипервязкого синдрома: I тип связан с увеличением количества циркулирующих клеток крови, II тип обусловлен гиперпротеинемией и/или повышением концентрации крупномолекулярных белков, III тип (синдром латентной гипервязкости или синдром микрогемореологических нарушений) характеризуется изменением свойств эритроцитов [6]. Полученные нами данные позволяют отнести ЮРА к смешанному (II–III) типу синдрома высокой вязкости крови.
Выводы
1. При ЮРА возрастают параметры ЭТЗ РСК, которые зависят от длительности заболевания, степени его активности и стадии, поражения пястнофаланговых суставов, глаз, лимфоузлов, сердца и легких, а нарушения деформируемости эритроцитов участвуют в патогенетических построениях у такой категории пациентов и, наряду с агрегационными свойствами тромбоцитов, отражают тяжесть течения болезни.
2. ЮРА свойственно развитие гипервязкого синдрома на фоне уменьшения вязкоэластично-релаксационных свойств сыворотки крови и нормальной ее межфазной активности, показатели которых коррелируют между собой, зависят от степени активности патологического процесса, тяжести и распространенности артрита, поражения локтевых, височно-нижнечелюстных и крестцово-подвздошных суставов, наличия артроанкилозов, подкожных узелков, поражения сердца, печени и внесуставных признаков заболевания.
3. ЭДС у больных ЮРА проявляется повышением в крови параметров ЕТ1 и GMP, зависящих от степени активности патологического процесса, тяжести артрита, поражения голеностопных, лучезапястных и крестцово-подвздошных сочленений, развития остеокистоза и артроанкилоза, наличия кожного синдрома, подкожных узелков, спленомегалии, кардита и плевропневмонита, а ЭДС определяет изменения лимфатических узлов и глаз.
4. Если у здоровых детей существуют корреляционные связи только между отдельными показателями ЭТЗ или ПЗ РСК, то при ЮРА констатируются достоверные соотношения параметров РСК и ЭФС, причем отмечается взаимозависимотсь h и уровня в крови GMP, конечные стойкие продукты метаболизма оксида азота определяют статическое (равновесное) s сыворотки, а интегральное состояние РСК и ЭФС определяет степень активности патологического процесса и наличие висцеритов.
5. К неблагоприятным прогностическим признакам течения ЮРА относятся изменения показателей w, d, e, t, ЕТ1 и GMP, причем последний может быть критерием вероятности развития увеита, а нарушения h, t и NO2 отражают высокую степень активности патологического процесса, что в перспективе будет иметь определенное практическое значение.
1. Галютіна О.Ю. Функція ендотелію у пацієнтів з ревматоїдним артритом, її зв’язок з перебігом захворювання / О.Ю. Галютіна, М.А. Станіславчук // Укр. ревматол. журн. — 2007. — Т. 28, № 2. — С. 48-51.
2. Жукова В.А. Клинико-инструментальная диагностика поражения сердца у больных с многолетним течением ювенильного идиопатического артрита / В.А. Жукова, Е.С. Трофимов, М.С. Леонтьева // Клиницист. — 2006. — № 2. — С. 70-73.
3. Казаков В.Н. Физико-химические свойства биологических жидкостей в ревматологии / В.Н. Казаков, О.В. Синяченко, Г.А. Игнатенко, В.М. Лобас. — Донецк: Донеччина, 2003. — 279 с.
4. Лысенко Н.В. Эндотелин-1 и циклический гуанозинмонофосфат в плазме крови больных ревматоидным артритом, ассоциированным с синдромом Рейно // Укр. ревматол. журн. — 2002. — Т. 7, № 1. — С. 57-59.
5. Насонова В.А. Значимость субъективных признаков в диагностике гипервязкого синдрома / В.А. Насонова, В.И. Васильев, Л.С. Сейланов // Ревматология. — 1999. — № 2. — С. 11-14.
6. Соловьева Т.И. Микрогемореологические нарушения: характеристика и клиническое значение / Т.И. Соловьева, Е.А. Лукина // Тер. арх. — 2006. — Т. 78, № 2. — С. 87-91.
7. Bloom B.J. Soluble intercellular adhesion molecule-1 and E-selectin as markers of disease activity and endothelial activation in juvenile idiopathic arthritis / B.J. Bloom, S.M. Nelson, D. Eisenberg, A.J. Alario // J. Rheumatol. — 2005. — Vol. 32, № 2. — P. 366-372.
8. Bronkhorst P.J.H. The mechanism of red cell aggregation investigated by means of direct cell manipulation using multiple optical trapping / P.J.H. Bronkhorst, J. Grimbergen, G.J. Brakenhoff // Br. J. Haematol. — 2007. — Vol. 92, № 2. — P. 256-258.
9. Dolezalova P. Laboratory indicators of endothelial involvement in rheumatic diseases associated with vasculitis in children / P. Dolezalova, P. Telekesova, D. Nemcova // Cas. Lek. Cesk. — 2009. — Vol. 142, № 10. — P. 615-619.
10. Frosch M. Early activation of cutaneous vessels and epithelial cells is characteristic of acute systemic onset juvenile idiopathic arthritis / M. Frosch, D. Metze, D. Foell // Exp. Dermatol. — 2005. — Vol. 14, № 4. — P. 259-265.
11. Gudmundsson M. Plasma viscosity in the monitoring of therapy in rheumatoid arthritis patients / M. Gudmundsson, A. Bjelle // Scand. J. Rheumatol. — 2009. — Vol. 24, № 4. — P. 219-224.
12. Jara L.J. Hyperviscosity syndrome as the initial manifestation of systemic lupus erythematosus / L.J. Jara, N.R. Capin, C. Avalle // J. Rheumatol. — 2009. — Vol. 16, № 2. — P. 225-230.
13. Kaplan M.J. Cardiovascular disease in rheumatoid arthritis // Curr. Opin. Rheumatol. — 2006. — Vol. 18, № 3. — P. 289-297.
14. Kazakov V.N. Dynamic surface tensiometry in medicine / V.N. Kazakov, O.V. Sinyachenko, V.B. Fainerman, R. Miller. — Amsterdam: Elsevier, 2003. — 373 p.
15. Oguz D. Left ventricular diastolic functions in juvenile rheumatoid arthritis / D. Oguz, B. Ocal, U. Ertan // Pediatr. Cardiol. — 2006. — Vol. 21, № 4. — P. 374-377.
16. Rovenska E. Structure of synovial lymphatic capillaries in rheumatoid arthritis and juvenile idiopathic arthritis / E. Rovenska, J. Neumuller // Int. J. Tissue React. — 2005. — Vol. 25, № 1. — P. 29-39.
17. Sattar N. Explaining how «high-grade» systemic inflammation accelerates vascular risk in rheumatoid arthritis / N. Sattar, D.W. McCarey, H. Capell, I.B. McInnes // Circulation. — 2009. — Vol. 108, № 24. — P. 2957-2963.
18. Secomb T.W. Models for slow blood flow in narrow tubes: еffect of aggregation and sedimentation of flow resistance // Biorheology. — 2005. — Vol. 32, № 2–3. — P. 169-170.
19. Van Doornum S. Reducing the cardiovascular disease burden in rheumatoid arthritis / S. Van Doornum, G.L. Jennings, I.P. Wicks // Med. J. Aust. — 2007. — Vol. 184, № 6. — P. 287-290.
20. Vaudo G. Endothelial dysfunction in young patients with rheumatoid arthritis and low disease activity / G. Vaudo, S. Marchesi, R. Gerli // Ann. Rheum. Dis. — 2004. — Vol. 63, № 1. — P. 31-35.