Журнал «Травма» Том 13, №1, 2012
Вернуться к номеру
Влияние периоперационного введения декскетопрофена на потребление морфина и воспалительный ответ после элективной артропластики тазобедренного сустава
Авторы: Iohom G., Walsh M., Shorten G., Department of Anaesthesia and Intensive Care Medicine, Higgins G., Clinical Sciences Building, Cork University Hospital and National University of Ireland, Cork, Republic of Ireland
Рубрики: Травматология и ортопедия
Версия для печати
Задачи исследования. В настоящем двойном слепом рандомизированном плацебо-контролируемом исследовании была оценена безопасность и обезболивающая эффективность периоперационно вводимого декскетопрофена.
Методы. Тридцать пациентов с I–II степенью операционно-анестезиологического риска по классификации Американского общества анестезиологов (American Society of Anesthesiologists (ASA)), подвергающихся элективной артропластике тазобедренного сустава, были рандомизированы в одну из двух групп. Первая группа (Д) получала декскетопрофен в дозе 25 мг 3 раза в день за 24 ч до и в течение 48 ч после операции; вторая группа (П) получала таблетки плацебо в те же самые интервалы времени. Субарахноидально под давлением вводили 0,5% бупивакаин (17,5 мг, если масса пациента более 70 кг, и 15 мг, если масса пациента менее 70 кг) и бесконсервантный морфин (0,6 мг). В послеоперационном периоде введение морфина контролировалось самими пациентами с помощью специального устройства (доза одной болюсной инъекции = 1 мг; время между двумя последовательными болюсными инъекциями — не менее 5 мин; непрерывная инфузия препарата не выполнялась).
Результаты. Две группы пациентов были сравнимы по возрасту, полу, весу, росту, классу операционно-анестезиологического риска по классификации ASA, длительности операции, уровню сенсорного блока на момент прибытия в палату послеоперационного ухода. Между группами также не было различий по кровопотере, необходимости в гемотрансфузиях, частоте дыхания и гемодинамическим показателям. В соответствии с визуальной аналоговой шкалой боли пациенты из группы Д испытывали менее выраженную боль спустя 15 ч после операции (р = 0,02). Кумулятивное потребление морфина было меньше в группе Д по сравнению с группой П спустя 6 ч (0,06 (0,2) против 0,85 (1,4) мг, р = 0,04) и 48 ч (10,1 (8) против 26,2 (20) мг, p < 0,01) после операции. Концентрация интерлейкина-6 в плазме крови в послеоперационном периоде повышалась в меньшей степени в группе Д по сравнению с группой П (р = 0,02). Тошнота и рвота были менее выражены (p < 0,01) в группе Д по сравнению с группой П спустя 18 ч после операции. Выраженность седации была меньше в группе Д (р = 0,03).
Выводы. Периоперационное введение декскетопрофена в дозе 25 мг каждые 8 ч заметно улучшает выраженность анальгезии и снижает потребление морфина (а также частоту связанных с ним побочных эффектов) после артропластики тазобедренного сустава. Кроме того, было показано, что подобная анальгезия снижает выраженность послеоперационного провоспалительного ответа.
Summary. Background. In this double-blind, randomized, placebo-controlled trial, the safety and analgesic efficacy of perioperative dexketoprofen were evaluated.
Methods. Thirty ASA I or II patients undergoing elective hip arthroplasty were randomized to one of two groups. One group (D) received dexketoprofen 25 mg tds for 24 h before and 48 h after surgery; the second group (P) received placebo tablets at equivalent times. Hyperbaric 0.5% bupivacaine (17.5 mg if greater than 70 kg and 15 mg if less than 70 kg) and preservative-free morphine (0.6 mg) were administered intrathecally. Postoperatively, PCA was provided (bolus morphine sulphate 1 mg; lockout 5 min; no continuous infusion).
Results. The two groups were similar in terms of age, gender, weight, height, ASA class, duration of operation, and level of sensory block on arrival to the recovery room. Groups were also similar in terms of blood loss, transfusion requirements, ventilatory frequency, and haemodynamic variables. According to visual analogue pain scores patients in group D experienced less pain at 15 h (P = 0.02) postoperatively. Cumulative morphine consumption was also less in group D compared with group P at 6 (0.06 (0.2) vs 0.85 (1.4) mg, P = 0.04) and 48 h postoperatively (10.1 (8) vs 26.2 (20) mg, P < 0.01). Plasma interleukin 6 concentrations increased postoperatively to a significantly lesser extent in group D than in group P (P = 0.02). Nausea and vomiting were less (P < 0.01) in group D compared with group P at 18 h postoperatively. Sedation scores were less (P = 0.03) in group D.
Conclusions. Perioperative administration of dexketoprofen 25 mg 8 hourly markedly improves analgesia and decreases opioid requirements (and associated adverse effects) following hip arthroplasty. It appears that this regimen decreases the postoperative pro-inflammatory response.
Резюме. Завдання дослідження. У даному подвійному сліпому рандомізованому плацебо-контрольованому дослідженні була оцінена безпека і знеболююча ефективність декскетопрофену, що вводився періопераційно.
Методи. Тридцять пацієнтів з I–II ступенем операційно-анестезіологічного ризику за класифікацією Американського товариства анестезіологів (American Society of Anesthesiologists (ASA)), яким проводилася елективна артропластика тазостегнового суглоба, були рандомізовані в одну з двох груп. Перша група (Д) отримувала декскетопрофен у дозі 25 мг 3 рази на день за 24 год до і протягом 48 год після операції; друга група (П) отримувала пігулки плацебо в ті самі інтервали часу. Субарахноїдально під тиском вводили 0,5% бупівакаїн (17,5 мг, якщо маса пацієнта понад 70 кг, і 15 мг, якщо маса пацієнта менша за 70 кг) і безконсервантний морфін (0,6 мг). У післяопераційному періоді введення морфіну контролювалося самими пацієнтами за допомогою спеціального пристрою (доза однієї болюсної ін’єкції = 1 мг; час між двома послідовними болюсними ін’єкціями — не менше 5 хв; безперервна інфузія препарату не виконувалася).
Результати. Дві групи пацієнтів були порівнянні за віком, статтю, вагою, зростом, класом операційно-анестезіологічного ризику за класифікацією ASA, тривалістю операції, рівнем сенсорного блоку на момент прибуття до палати післяопераційного догляду. Між групами також не було відмінностей за крововтратою, необхідністю в гемотрансфузіях, частотою дихання й гемодинамічними показниками. Відповідно до візуальної аналогової шкали болю пацієнти з групи Д відчували менш виражений біль через 15 год після операції (р = 0,02). Кумулятивне споживання морфіну було меншим у групі Д порівняно з групою П через 6 год (0,06 (0,2) проти 0,85 (1,4) мг, р = 0,04) і 48 год (10,1 (8) проти 26,2 (20) мг, p < 0,01) після операції. Концентрація інтерлейкіну-6 у плазмі крові в післяопераційному періоді підвищувалася меншою мірою у групі Д порівняно з групою П (р = 0,02). Нудота і блювота були менш виражені (p < 0,01) у групі Д порівняно з групою П через 18 год після операції. Вираженість седації була меншою в групі Д (р = 0,03).
Висновки. Періопераційне введення декскетопрофену в дозі 25 мг кожні 8 год помітно покращує вираженість анальгезії і знижує споживання морфіну (а також частоту пов’язаних з ним побічних ефектів) після артропластики тазостегнового суглоба. Крім того, було показано, що подібна анальгезія знижує вираженість післяопераційної прозапальної відповіді.
Послеоперационная анальгезия, ортопедическая хирургия, ненаркотические анальгетики, декскетопрофен, полипептиды, интерлейкин-6.
Key words: analgesia, postoperative; surgery, orthopaedic; analgesics non-opioid, dexketoprofen, polypeptides, interleukin 6.
Ключові слова: післяопераційна анальгезія, ортопедична хірургія, ненаркотичні анальгетики, декскетопрофен, поліпептиди, інтерлейкін-6.
Совместное введение нестероидных противовоспалительных средств (НПВС) и опиоидов для борьбы с послеоперационной болью после крупных ортопедических операций широко практикуется, но не всегда эффективно [1]. Потенциальная возможность усилить качество анальгезии и снизить потребность в опиоидах влечет за собой проведение исследований, направленных на идентификацию оптимальной комбинации, способа и времени введения этих средств.
Декскетопрофена трометамол — активный энантиомер рацемического кетопрофена — является новым пероральным НПВС с обезболивающими и антипиретическими свойствами. Преимущества данного препарата по сравнению с кетопрофеном сводятся к более быстрому началу действия, более выраженному эффекту и потенциальному снижению частоты побочных эффектов со стороны желудочно-кишечного тракта [2, 3]. Ранее выполненные исследования подтвердили тот факт, что декскетопрофен эффективен и хорошо переносится в клинической практике [4]. Декскетопрофен в дозе 25 мг, назначаемый 3 раза в день, обладает большей обезболивающей активностью и меньшим количеством побочных эффектов по сравнению с рацемическим кетопрофеном у пациентов с остеоартрозом коленного сустава [5]. Декскетопрофена трометамол проявляет ряд свойств, которые могут быть особенно полезны пациентам в периоперационном периоде. Его ингибиторные эффекты в отношении циклооксигеназы (ЦОГ) приводят к снижению превращения арахидоновой кислоты до PGE1, PGE2, PGF1, PGF2a и тромбоксанов А2 и В2, что отчасти объясняет его обезболивающие свойства. По состоянию на сегодняшний день его обезболивающая активность была подтверждена также у пациентов с послеоперационной зубной болью [6]. Оптический изомер декскетопрофена, R(–)-кетопрофен, не только фармакологически неактивен как ЦОГ-ингибитор, но и обладает токсическим потенциалом, особенно касательно простагландин-независимой ульцерогенности (возможно, связанной с краевым стоянием нейтрофилов) [7].
Артропластику тазобедренного сустава выполняют, как правило, в условиях регионарной анестезии, воспроизводимой субарахноидальным введением под давлением комбинации бупивакаина и морфина. Подобный подход обеспечивает превосходные условия для проведения операции и удовлетворительную анальгезию в раннем послеоперационном периоде. Однако клинические наблюдения свидетельствуют о наличии периода неадекватной анальгезии, который часто наблюдается между окончанием действия субарахноидально введенного морфина и началом действия системно введенных опиоидов. Обычно этот интервал составляет 12–24 ч послеоперационного периода.
Мы предположили, что периоперационное введение декскетопрофена в дозе 25 мг перорально 3 раза в день пациентам, которым предстояло выполнение элективной артропластики тазобедренного сустава в условиях спинномозговой анестезии, приведет к снижению потребления опиоидов в послеоперационном периоде и ослаблению периоперационного воспалительного ответа. Чтобы проверить данную гипотезу, мы провели проспективное рандомизированное двойное слепое контролируемое клиническое исследование у пациентов, которым предстояло выполнение артропластики тазобедренного сустава в условиях спинномозговой анестезии и которым периоперационно назначали декскетопрофен или плацебо.
Методы
После получения разрешения комиссии по биоэтике и письменного информированного согласия от пациентов в исследование были включены 30 пациентов в возрасте 45–70 лет с I–II степенью операционно-анестезиологического риска по классификации Американского общества анестезиологов (American Society of Anesthesiologists (ASA)), которым предстояло выполнение элективной артропластики тазобедренного сустава в условиях спинномозговой анестезии. В исследование не включали пациентов, имеющих хронические заболевания (за исключением остеоартроза); перенесших недавно (в течение последних 2 месяцев) оперативное вмешательство или инфекцию; получающих сопутствующее лечение НПВС или препаратами, которые могут взаимодействовать с НПВС; имеющих аллергию или противопоказания к приему НПВС или опиоидов.
Пациентов случайным образом разделили на две группы: одна группа (Д) получала декскетопрофен в дозе 25 мг 3 раза в день, начиная за 24 ч до операции и в течение 48 ч после операции; вторая группа (П) получала таблетки плацебо в те же самые отрезки времени. Поскольку интервал от приема однократной предоперационной дозы декскетопрофена до выполнения хирургического разреза мог варьировать от 1 до 2 ч, то концентрация декскетопрофена в плазме крови во время операции значительно разнилась бы у различных пациентов. Чтобы минимизировать эту вариабельность, исследуемый препарат вводили за 24 ч до операции.
Всех пациентов проинструктировали, как пользоваться насосом Vygon для доставки опиоидов, работа которого контролируется самими пациентами (patient-controlled analgesia, РСА), и визуальной аналоговой шкалой (ВАШ), используемой для оценки выраженности боли. Если анестезиолог считал нужным, пациенту за 1 ч до операции вводился диазепам в дозе 10 или 15 мг.
После доставки пациентов в операционную проводилось стандартное мониторирование (пульсоксиметрия, электрокардиография и неинвазивное мониторирование артериального давления; монитор Datex AS/3, Dale Corp., г. Мэдисон, штат Висконсин, США). В периферическую вену недоминантного предплечья в условиях местной анестезии (2% лидокаин) вводили катетер размером 14G, через который начинали инфузию сложного раствора натрия лактата в объеме 1000 мл (из них 500 мл вводили быстро). Затем пациентов переворачивали на бок, в зависимости от места операции. После применения стандартных методов асептики нащупывали промежуток между третьим и четвертым поясничными позвонками и инфильтрировали его 2% раствором лидокаина (применяли иглу размером 23G). Затем под давлением в субарахноидальное пространство вводили 0,5% раствор бупивакаина (17,5 мг, если масса пациента превышала 70 кг, и 15 мг, если масса пациента была меньше 70 кг) и бесконсервантный раствор морфина (0,6 мг) с помощью спинальной иглы Whitacre B-D размером 25G (Becton Dickinson and Co., г. Франклин Лейкс, штат Нью-Джерси, США). Выраженность сенсорной блокады оценивали в течение последующих 5–10 мин с помощью спрея этилхлорида. После окончания операции все пациенты имели доступ к одноразовому насосу Vygon PCA (устройство, позволяющее пациентам самим контролировать введение себе опиоидов; доза одной болюсной инъекции = 1 мг; время между двумя последовательными болюсными инъекциями —не менее 5 мин; непрерывная инфузия не выполнялась) (Laboratoires Pharmaceutique Vygon, Экуан, Франция). При необходимости для борьбы с тошнотой и рвотой пациентам каждые 8 ч назначали в/м циклизин в дозе 50 мг. После транспортирования пациентов в палату послеоперационного ухода повторно оценивали выраженность сенсорного блока. В ходе нашего исследования вели учет интраоперационной и общей потери крови (путем взвешивания тампонов), а также объема производимых трансфузий препаратов крови.
У пациентов отбирали образцы венозной крови (10 мл) для оценки концентрации в плазме крови мочевины, креатинина, показателелей функции печени и провоспалительного интерлейкина-6 (IL-6) в 5 точках времени: 24 и 18 ч до операции и 6, 24 и 48 ч после операции. Образцы крови для оценки концентрации в плазме крови IL-6 собирали в стерильные тубы с ЭДТА, центрифугировали при 1000 g, и полученный супернатант сохраняли при температуре –80 °С. Концентрацию IL-6 в плазме крови измеряли с помощью иммуноферментного анализа (enzyme linked immunosorbent assay (ELISA)) со специфическими поликлональными антителами кролика к коммерческим тест-системам с рекомбинантным IL-6 (R&D System, г. Абингдон, графство Оксфордшир, Великобритания).
За 24 и 18 ч до операции, а также спустя 2, 6, 12, 15, 18, 24 и 48 ч после операции собирали следующие данные: частота сердечных сокращений, частота дыхания, температура и артериальное давление; выраженность боли (по визуальной аналоговой шкале); кумулятивное потребление опиоида; побочные эффекты, связанные с введением опиоида: 1) тошнота, рвота (1 — нет тошноты; 2 — жалобы на наличие тошноты, которую можно перенести; 3 — необходимость во в/м введении циклизина в дозе 50 мг); 2) респираторная депрессия (частота дыхания менее 8 раз в минуту); 3) кожный зуд (1 — нет зуда; 2 — жалобы на наличие зуда, который можно перенести; 3 — тяжелый зуд, требующий в/м введения пиритона в дозе 5 мг); 4) седация (1 — бодрствование; 2 — сонливость; 3 — сон, легко разбудить; 4 — сон, тяжело разбудить); 5) задержка мочи (К — элективная послеоперационная катетеризация; Н — катетеризация не производилась; З — катетеризация вследствие задержки мочи). Помимо этого, регистрировали побочные эффекты, связанные с приемом декскетопрофена: диспепсию, изжогу, боль в животе, головную боль и головокружение.
В ранее выполненных исследованиях было показано, что у пациентов, которым выполняли спинномозговую анестезию бупивакаином и морфином при проведении операции по замене сустава и в течение 24 ч после операции вводили морфин через устройство РСА, средний расход морфина при таком способе введения составил 20 мг (стандартное отклонение (станд. откл.) 9,75 мг) [8]. Исходя из этого было подсчитано, что при мощности 80 % и уровне значимости 0,05 в исследование достаточно включить 26 пациентов (13 пар), чтобы выявить 50% снижение количества морфина, вводимого в течение 24 ч.
Статистический анализ был выполнен с помощью программы StatView 4.5 для Windows (1992–1996). Данные о весе и росте пациентов, длительности операции, общей кровопотере и необходимости в гемотрансфузиях были проанализированы с помощью t-критерия Стьюдента. Для сравнения данные о потреблении морфина, выраженности боли по ВАШ и седации, концентрации IL-6, наличии кожного зуда и послеоперационной тошноты и рвоты, состоянии биохимических и физиологических параметров оценивали с помощью дисперсионного анализа (ANOVA) для повторных измерений. Для сравнения непараметрических данных (необходимость в катетеризации) применяли точный критерий Фишера. Во всех случаях различия считали достоверными при уровне значимости p < 0,05.
Результаты
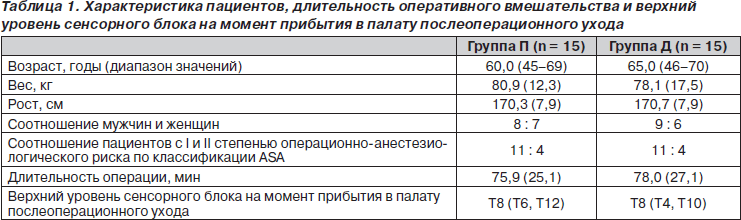
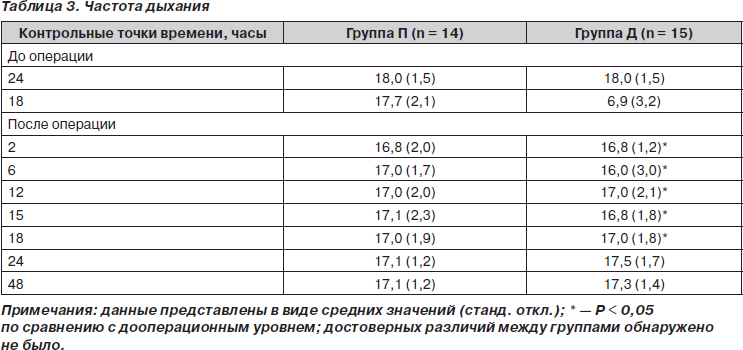
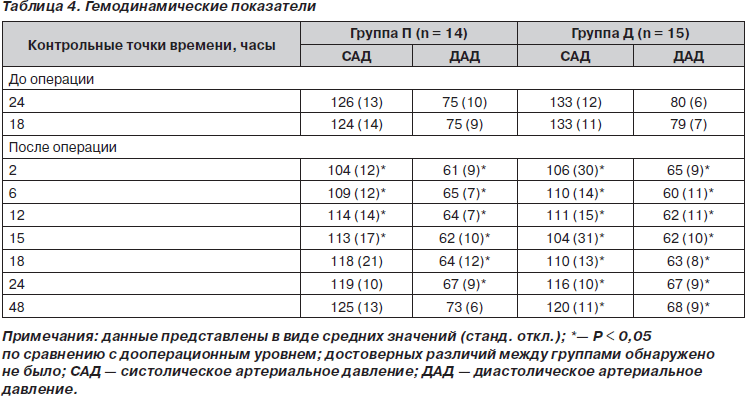
Две группы пациентов были сравнимы по возрасту, полу, весу, росту, классу операционно-анестезиологического риска по классификации ASA, длительности операции и уровню сенсорного блока после прибытия в палату послеоперационного ухода (табл. 1). Один пациент из плацебо-группы был исключен из исследования, так как интраоперационно получил диклофенак в дозе 100 мг (незапланированное введение). Группы были однородны также и по интра- или послеоперационной кровопотере, необходимости в гемотрансфузиях (табл. 2), частоте дыхания (табл. 3) и гемодинамическим показателям (табл. 4).
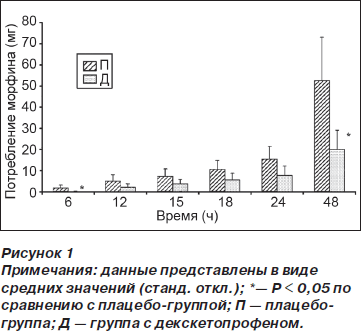
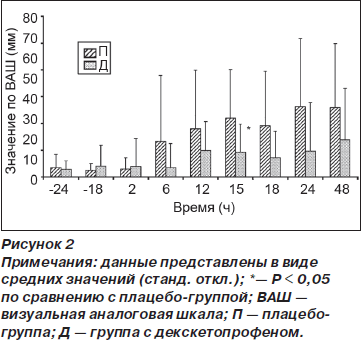
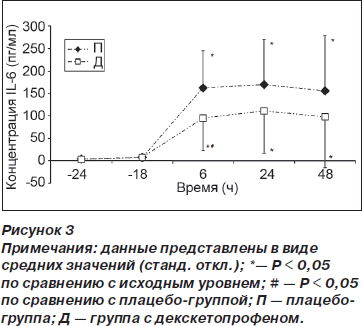
Кумулятивное потребление морфина в группе Д по сравнению с группой П было меньше спустя 6 ч (0,06 (0,2) против 0,85 (1,4) мг, р = 0,04) и 48 ч (10,1 (8) против 26,2 (20) мг, p < 0,01) после операции (рис. 1). Время до первого приема опиоида (морфина) в послеоперационном периоде было достоверно больше в группе Д (1277 (1031) мин) по сравнению с группой П (642 (317) мин) (p = 0,03). На рис. 2 отражены значения ВАШ для интенсивности боли, зарегистрированные в вышеупомянутые отметки времени (см. Методы). И хотя у пациентов из группы Д наблюдалась тенденция к ощущению менее выраженной боли во время послеоперационного периода по сравнению с группой П, различия достигали статистической значимости только спустя 15 ч после операции (р = 0,02). Концентрация IL-6 в плазме крови была меньше в группе Д по сравнению с группой П спустя 6 ч после операции (94,4 (70) против 162 (83) пг/мл, р = 0,02), однако спустя 24 и 48 ч после операции подобные различия отсутствовали (рис. 3).
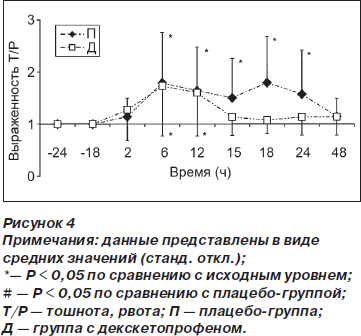
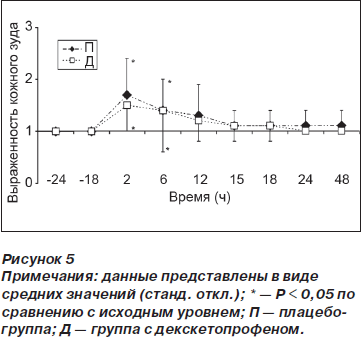
Тошнота и рвота были менее выражены (p < 0,01) в группе Д по сравнению с группой П спустя 18 ч после операции (рис. 4). У пациентов обеих групп наблюдался кожный зуд, интенсивность которого была наибольшей спустя 2 и 6 ч после операции (рис. 5).
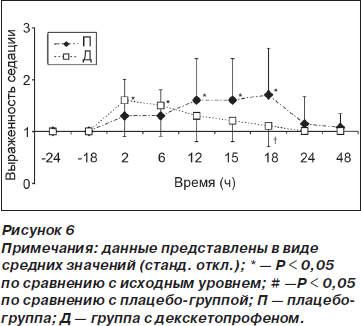
Выраженность седации увеличивалась по сравнению с исходным уровнем в группе Д ко 2-му и 6-му часу (p < 0,01) после операции и в группе П — к 12, 15 и 18-му часу (p < 0,01) после операции. К 18-му часу после операции выраженность седации была меньше в группе Д по сравнению с группой П (р = 0,03) (рис. 6). Семи пациентам в каждой из групп была выполнена элективная катетеризация в послеоперационном периоде. В ходе исследования у 4 пациентов наблюдалась задержка мочи. Это послужило причиной катетеризации 3 пациентов в группе Д и 1 пациента в группе П.
Почечные (концентрация мочевины, креатинина, калия в плазме крови) и печеночные (концентрация АЛТ, общего билирубина, щелочной фосфатазы в плазме крови) показатели были нормальными у всех пациентов во все контрольные точки времени. Ни о каких осложнениях или побочных эффектах, связанных с приемом декскетопрофена (диспепсия, изжога, боль в животе, головная боль, головокружение, диарея, запоры, парестезия, кожная сыпь), не было сообщено.
Обсуждение
Ранее было убедительно показано, что кетопрофен является эффективным обезболивающим и противовоспалительным средством при лечении таких заболеваний и состояний, как ревматоидный артрит, остеоартроз, легкая и умеренная боль разной этиологии [9]. Однако данное соединение является рацемической смесью двух стереоизомеров, из которых только правовращающий энантиомер, декскетопрофен, обладает биологической активностью. Следовательно, декскетопрофен потенциально обладает рядом преимуществ над рацемическим родительским соединением. У людей относительная биодоступность перорального декскетопрофена трометамола (12,5 и 25 мг соответственно) аналогична таковой у перорального рацемического кетопрофена (25 и 50 мг соответственно), о чем во всех случаях свидетельствовала площадь под кривыми «концентрация — время» для S(+)-кетопрофена [2]. Активность декскетопрофена была в два раза выше, чем у рацемического кетопрофена, во всех исследованных моделях. Следовательно, чистый энантиомер может быть введен в половинных дозах исходного рацемического соединения (12,5 и 25 мг вместо 25 и 50 мг соответственно), что снижает метаболическую нагрузку на печень и общее количество образуемых метаболитов [2].
Применение одного энантиомера упрощает фармакокинетический профиль вещества путем устранения энантиомерной инверсии. Вследствие этого декскетопрофен обладает потенциалом к снижению фармакокинетической вариабельности по сравнению с рацемическим кетопрофеном [9]. Трометамол был добавлен к декскетопрофену для того, чтобы повысить его растворимость более чем в 1000 раз по сравнению с формой в виде свободной кислоты. Было показано, что абсорбция декскетопрофена после перорального введения протекает намного быстрее (tmax 0,25–0,75 ч) по сравнению как с его формой в виде свободной кислоты, так и с рацемическим кетопрофеном (tmax 0,5–3 ч). Период полувыведения декскетопрофена составляет 1–4 ч, объем распределения 0,1–0,2 л/кг, связывание с белками плазмы крови составляет более 99 %. Экскреция осуществляется преимущественно с мочой, при этом конъюгация с глюкуроновой кислотой составляет 90 % введенной дозы. Не наблюдается метаболическая инверсия активного S(+)-энантиомера (эутомера) в его неактивный оптический изомер (дистомер), не наблюдается его инкорпорация в жировую ткань [7].
В прошлом в/м опиоиды «по требованию» (т.е. при необходимости) рутинно назначали для послеоперационной анальгезии, что часто приводило к субоптимальному обезболиванию и выраженным осложнениям. В настоящее время регионарная анестезия, эпидуральное и субарахноидальное введение опиоидов, а также комбинирование этих подходов стали в ряд широко применяемых методов в практике анестезиолога. По-видимому, понятие адекватной послеоперационной анальгезии связано не только с удовлетворенностью пациентов, но и с улучшением наблюдаемых у них исходов [10]. Комбинирование опиоида с не обладающим седативным действием ненаркотическим анальгетиком является простой формой мультимодальной анальгезии. Цель подобной комбинации направлена на то, чтобы добиться синергизма между обезболивающими эффектами отдельных препаратов [11–13]. Преимущества же сводятся к снижению потребления опиоида и связанных с ним побочных эффектов.
Время приема НПВС имеет большое клиническое значение, поскольку начало действия этих средств наблюдается через 30–60 мин после перорального приема. Опиоид-сберегающий эффект этих средств невидим до 4 ч после перорального приема [14]. В ходе экспериментальных исследований были получены убедительные доказательства преимущества применения превентивной анальгезии. Однако в клинических исследованиях были получены противоречивые результаты, возможно вследствие применения разных дизайнов исследования [15]. В рамках нашего исследования тенденция к снижению потребления опиоида была видна в течение всего послеоперационного периода, хотя достигала статистической значимости только к 6 и 48 ч. Время до первого приема опиоида составило 1277 (1031) мин в группе Д и 642 (317) мин в группе П (р = 0,03). Видно, что в группе Д оно находится значительно дальше окончания действия субарахноидально вводимого опиоида.
Перед началом настоящего исследования было поставлено два вопроса: 1. Будет ли периоперационное введение декскетопрофена приводить к опиоид-сберегающему эффекту в послеоперационном периоде? 2. Влияет ли периоперационное введение декскетопрофена на периоперационный провоспалительный ответ, оцениваемый по концентрации IL-6 в плазме крови?
Наиболее важным результатом настоящего исследования является значительное снижение потребности в опиоиде в послеоперационном периоде, которое сопровождалось также снижением частоты послеоперационной тошноты и рвоты, седации, задержки мочи, увеличением времени до первого приема опиоида без видимых осложнений или побочных эффектов.
Кроме того, был меньше выражен периоперационный провоспалительный ответ, о чем свидетельствовало снижение концентрации IL-6 в плазме крови спустя 6 ч после операции.
IL-6 является интегральным медиатором физиологического острофазового ответа на повреждение, но массивное и длительное повышение его уровня связано с увеличением риска заболеваемости и смертности. IL-6 представляет собой единственный цитокин, связь которого с развитием осложнений после повреждения была хорошо установлена [16]. Большая выраженность боли в плацебо-группе могла приводить к увеличению стресс-ответа и, таким образом, к повышению концентрации IL-6 в плазме крови. Более высокое потребление морфина в этой группе могло прямо привести к повышению содержания IL-6, поскольку было показано, что морфин усиливает высвобождение IL-6 из липополисахарид-стимулированных моноцитов [17].
Выбор нами интервалов времени для забора крови был основан на ранее полученных данных о том, что в послеоперационном периоде повышение концентрации IL-6 в плазме крови начинается спустя 2–4 ч. И хотя в нашем исследовании концентрация IL-6 имела тенденцию к меньшему увеличению в группе Д во все отметки времени в послеоперационном периоде, различия были статистически достоверны только спустя 6 ч. Ограниченный прирост уровня IL-6 (в обеих группах) спустя 24 и 48 ч после операции мог снизить вероятность обнаружения ингибиторного эффекта декскетопрофена.
В заключение необходимо отметить, что декскетопрофен в дозе 25 мг 3 раза в день, назначаемый периоперационно в качестве адъювантного средства в дополнение к морфину, способствует обеспечению эффективной анальгезии при борьбе с болью после артропластики тазобедренного сустава. Кроме того, подобный подход приводит к снижению выраженности послеоперационного провоспалительного ответа.
Благодарности
Данное исследование было частично профинансировано A. Menarini Pharmaceuticals Ireland Ltd.
Перевод А.В. Савустьяненко
Оригинал статьи опубликован в Br. J. Anaesth. 2002; 88: 520-6
Kehlet H., Rung G.W., Callesen T. Postoperative opioid analgesia: time for reconsideration? // J. Clin. Anesth. — 1996. — 8. — 441-5.
Mauleon D., Artigas R., Garcia M.L., Carganico G. Preclinical and clinical development of dexketoprofen // Drugs. — 1996. — 52 (Suppl. 5). — 24-45.
Cabre F., Fernandez M.F., Calvo L. et al. Analgesic, antiinflammatory and antipyretic effects of S(+)-ketoprofen in vivo // J. Clin. Pharmacol. — 1998. — 38 (Suppl. 12). — 3S-10S.
Ezcurdia M., Cortejoso F.J., Lanzon R. et al. Comparison of the efficacy and tolerability of dexketoprofen and ketoprofen in the treatment of primary dysmenorrhea // J. Clin. Pharmacol. — 1998. — 38 (Suppl. 12). — 65S-73S.
Beltran J., Martin-Mole E., Figueroa M. et al. Comparison of dexketoprofen trometamol and ketoprofen in the treatment of osteoarthrits of the knee // J. Clin. Pharmacol. — 1998. — 38 (Suppl. 12). — 74S–80S.
McGurk M., Robinson P., Rajayogeswaran V. et al. Clinical comparison of dexketoprofen trometamol, ketoprofen, and placebo in postoperative dental pain // J. Clin. Pharmacol. — 1998. — 38 (Suppl. 12). — 46S–54S.
Jamali F., Brocks D.R. Clinical pharmacokinetics of ketoprofen and its enantiomers // Clin. Pharmacokinet. — 1990. — 19. — 197-217.
Cole P.J., Craske D.A., Wheatley R.G. Efficacy and respiratory effects of low-dose spinal morphine for postoperative analgesia following knee arthroplasty // Br. J. Anaesth. — 2000. — 85. — 233-7.
Barbanoj M.J., Gich I., Artigas R. et al. Pharmacokinetics of dexketoprofen trometamol in healthy volunteers after single and repeated oral doses // J. Clin. Pharmacol. — 1998. — 38 (Suppl. 12). — 33S-40S.
Sharrock N.E., Cazan M.G., Hargett M.J.L., Willliams-Russo P., Wilson P.D. Changes in mortality after total hip and knee arthroplasty over a ten year period // Anesth. Analg. — 1995. — 80. — 242-8.
Jaffe J.H., Martin W.R. Opioid analgesics and antagonists // Goodman Gilman A., Rall T.W., Nies A.S., Taylor P., eds. The Pharmacological Basis of Therapeutics. — USA: McGraw-Hill, Inc., 1993. — 485-522.
Dahl J.B., Kehlet H. Non-steroidal anti-inflammatory drugs: rationale for use in severe postoperative pain // Br. J. Anaesth. — 1991; 66: 703–12.
Casali R., Girardi G., Mediati R.D., Livi P., Novelli G.P. Evaluation of the synergism between ketorolac and morphine in the treatment of postoperative pain // Minerva-Anestesiol. — 1995. — 61. — 501-7.
Camu F., Vanlersberghe C., Lauwers M.H. Timing of perioperative non-steroidal anti-inflammatory drug treatment // Acta Anaesthesiol. Belg. — 1996. — 47. — 125-8.
Kissin I. Pre-emptive analgesia: why its effect is not always obvious // Anesthesiology. — 1996. — 84. — 1015-9.
Biffl W.L., Moore E.E., Moore F.A., Peterson V.M. Interleukin-6 in the injured patient // Ann. Surg. — 1996. — 224. — 647-64.
Chao C.C., Hu S., Molitor T.W. et al. Morphine potentiates transforming growth factor-beta release from human peripheral blood mononuclear cell cultures // J. Pharmacol. Exp. Ther. — 1992. — 262. — 19-24.