Журнал «Травма» Том 13, №1, 2012
Вернуться к номеру
Эффективность лорноксикама в обеспечении послеоперационной анальгезии после тотальной артропластики коленного сустава
Авторы: Inan N., Ozcan N., Takmaz S.A., Ozcan A., Erdogan I., Baltaci B., Ministry of Health, Ankara Research and Training Hospital, Anaesthesiology Department, Turkey
Рубрики: Травматология и ортопедия
Версия для печати
В послеоперационном периоде после тотальной артропластики коленного сустава у пациентов наблюдается выраженный болевой синдром. Из-за побочных эффектов опиоидов у таких пациентов (в основном пожилого возраста) рекомендуют применять комбинированные подходы к борьбе с послеоперационной болью. В ходе настоящего двойного слепого рандомизированного плацебо-контролируемого исследования было оценено влияние введения лорноксикама (32 мг/48 ч) на потребление морфина и частоту развития побочных эффектов у пожилых пациентов, которым выполняли тотальную артропластику коленного сустава. Пациенты группы М (n = 23) и группы Л (n = 23) в послеоперационном периоде получали морфин с помощью устройства, позволяющего больному самостоятельно контролировать ход анальгезии (Patient Controlled Analgesia). В дополнение к этому группа Л получала лорноксикам 16 мг внутривенно за 15 мин до операции и 8 мг спустя 12 и 24 ч после операции. Потребление морфина в группе Л было достоверно ниже, чем в группе М, на интервалах 2, 3, 6, 8, 24, 36 и 48 ч послеоперационного периода (p < 0,05). К концу 48 ч среднее кумулятивное потребление морфина (среднее ± стандартное отклонение) для группы М и группы Л составило соответственно 63,70 ± 15,70 мг и 34,60 ± 16,32 мг. Площадь под кривой потребления морфина в течение 0–48 ч исследования составила 59 ± 13 в группе М и 30 ± 13 в группе Л (p < 0,001). Частота развития побочных эффектов — 60 % в группе М и 25 % в группе Л (p < 0,05). В группе М у 8 пациентов (40 %) наблюдалась тошнота и у 3 пациентов (15 %) — кожный зуд; в группе Л у 3 пациентов (15 %) — тошнота, у 1 пациента (5 %) — кожный зуд и у 1 пациента (5 %) — сухость во рту. Таким образом, было установлено, что назначение лорноксикама пациентам с тотальной артропластикой коленного сустава приводит к снижению потребления морфина и частоты развития побочных эффектов в ходе послеоперационной анальгезии.
Summary. In total knee replacement operation, patients have a severe pain in the postoperative period. Because of side effects of opioids, multiple postoperative pain treatment regimens are more suitable in these elderly patients. In this doubleblind, randomized, placebo controlled study, the effect of lornoxicam administration (32 mg/48 hour) on morphine consumption and drug-related side effects were investigated in elderly patients undergoing total knee replacement. Group M (n = 23) and group L (n = 23) received morphine with patient controlled analgesia device postoperatively. Additionally group L received lornoxicam 16 mg intravenously 15 minutes before surgery and 8 mg at postoperative 12th and 24th hours. Morphine consumption in group L were significantly lower than in group M at 2, 3, 6, 8, 24, 36 and 48th postoperative hours (p < 0.05). At the end of 48th hour mean total morphine consumptions (mean ± SD) for group M and group L were 63.70 ± 15.70 mg and 34.60 ± 16.32 mg, respectively. Area under the curve morphine 0–48 h in group M was 59 ± 13 and in group L it was 30 ± 13 (p < 0.001). Incidence of side effects in group M were 60 and 25 % in group L (p < 0.05). In group M, 8 patients (40 %) experienced nausea and 3 (15 %) patients experienced itching where as in group L, 3 patients (15 %) experienced nausea, 1 patient (5 %) itching, 1 patient (5 %) dry mouth. Lornoxicam administration in total knee replacement is associated with decreased morphine consumption for postoperative analgesia and fewer side effects.
Резюме. У післяопераційному періоді після тотальної артропластики колінного суглоба в пацієнтів спостерігається виражений больовий синдром. Через побічні ефекти опіоїдів у таких пацієнтів (в основному літнього віку) рекомендують застосовувати комбіновані підходи до боротьби з післяопераційним болем. Під час цього подвійного сліпого рандомізованого плацебо-контрольованого дослідження був оцінений вплив введення лорноксикаму (32 мг/48 год) на споживання морфіну й частоту розвитку побічних ефектів у літніх пацієнтів, яким здійснили тотальну артропластику колінного суглоба. Пацієнти групи М (n = 23) і групи Л (n = 23) у післяопераційному періоді отримували морфін за допомогою пристрою, що дозволяє хворому самостійно контролювати хід анальгезії (Patient Controlled Analgesia). На додаток до цього група Л отримувала лорноксикам 16 мг внутрішньовенно за 15 хв до операції й 8 мг через 12 і 24 год після операції. Споживання морфіну в групі Л було вірогідно нижче, ніж у групі М, на інтервалах 2, 3, 6, 8, 24, 36 і 48 год післяопераційного періоду (p < 0,05). Наприкінці 48 год середнє кумулятивне вживання морфіну (середнє ± стандартне відхилення) для групи М и групи Л становило відповідно 63,70 ± 15,70 мг і 34,60 ± 16,32 мг. Площа під кривою споживання морфіну протягом 0–48 год дослідження становила 59 ± ± 13 у групі М и 30 ± 13 у групі Л (p < 0,001). Частота розвитку побічних ефектів — 60 % у групі М и 25 % у групі Л (p < 0,05). У групі М у 8 пацієнтів (40 %) спостерігалася нудота й у 3 пацієнтів (15 %) — шкірна сверблячка; у групі Л у 3 пацієнтів (15 %) — нудота, в 1 пацієнта (5 %) — шкірна сверблячка й в 1 пацієнта (5 %) — сухість у роті. Таким чином, було встановлено, що призначення лорноксикаму пацієнтам з тотальною артропластикою колінного суглоба приводить до зниження споживання морфіну й частоти розвитку побічних ефектів під час післяопераційної анальгезії.
Лорноксикам, послеоперационная анальгезия, тотальная артропластика коленного сустава, морфин, анальгезия, управляемая пациентом.
Key words: lornoxicam, postoperative analgesia, total knee replacement, morphine, patient controlled analgesia.
тотальна артропластика колінного суглоба, морфін, анальгезія, керована пацієнтом.
Введение
Выполнение тотальной артропластики коленного сустава (ТАКС) обычно связано с развитием тяжелой послеоперационной боли. Остеотомия двух крупных костей — бедренной и большеберцовой — и рефлекторный спазм мышц вокруг колена вызывают боль, которая дополнительно усиливается при движении коленного сустава (Bonica, 1990). Неконтролируемая боль может увеличивать заболеваемость и смертность вследствие развития выраженных метаболических, эндокринных и воспалительных нарушений (Kehlet, 1989). Пациенты, которым выполняют ТАКС, обычно находятся в пожилой возрастной группе с ограниченными сердечными и легочными резервами. Следовательно, устранение послеоперационной боли имеет для них особое значение, однако очень тяжело найти оптимальный баланс между возможными выгодами и потенциальными побочными эффектами (Priebe, 2000). Опиоиды являются препаратами первого выбора для устранения тяжелой боли, но возможности их применения ограничены, поскольку пожилые пациенты более чувствительны к вызываемым ими побочным эффектам, таким как выраженная седация, респираторная и сердечно-сосудистая депрессия, тошнота/рвота и нарушение моторики желудочно-кишечного тракта (Nuutinen и соавт., 1993; Schug и соавт., 1991). Нестероидные противовоспалительные средства (НПВС) могут использоваться самостоятельно или в комбинации с опиоидами для борьбы с послеоперационной болью, что позволяет добиваться лучшего ослабления боли и меньшего количества побочных эффектов.
Имеющиеся данные свидетельствуют о том, что фармакокинетика лорноксикама не претерпевает существенных изменений при увеличении возраста или развитии почечных нарушений (Bonica, 1990). Еще одним преимуществом лорноксикама является тот факт, что препарат имеет пероральную и внутривенную формы выпуска и может быть использован при различных типах хронической, а также острой послеоперационной боли (Balfour и соавт., 1996). Его эффективность сравнима с таковой у морфина, петидина и трамадола при ослаблении послеоперационной боли после гинекологических, стоматологических операций и операций на межпозвоночных дисках, при этом он вызывает меньшее количество побочных эффектов по сравнению со всеми перечисленными препаратами (Staunstrup и соавт., 1999; Rosenow и соавт., 1998; Ilias и Jansen, 1996; Nшrholt и соавт., 1996; Rosenow и соавт., 1996). Лорноксикам хорошо переносится в послеоперационном периоде — профиль его переносимости был аналогичен диклофенаку (Kidd и Frenzel, 1996), но превышал таковой у индометацина (Bernstein и соавт., 1992). Насколько нам известно, ранее не сообщалось о применении лорноксикама для борьбы с послеоперационной болью после крупных ортопедических операций.
Цель настоящего проспективного двойного слепого рандомизированного плацебо-контролируемого исследования сводилась к тому, чтобы оценить, будет ли назначение лорноксикама снижать количество морфина, вводимого с целью послеоперационной анальгезии после ТАКС. В связи с этим в ходе исследования определяли общее потребление морфина, а также побочные эффекты морфина и лорноксикама.
Материалы и методы
После получения одобрения комиссии по биоэтике и письменного согласия 46 пациентов (возраст 55–80 лет), которым предстояло выполнение ТАКС, были включены в исследование. В исследование не включали пациентов с эндокринными нарушениями, тяжелыми заболеваниями печени и почек, нейропатиями, наклонностью к кровотечениям, язвенной болезнью, гастритом, наличием в анамнезе желудочно-кишечного кровотечения, деменцией, проблемами с кооперацией (сотрудничеством) и повышенной чувствительностью к лорноксикаму или морфину. Тех пациентов, у которых операция длилась более 120 мин, также не включали в исследование. Всех пациентов за день до операции ознакомили с тем, как пользоваться устройством (Pain Management Provider, ABBOTT, США), позволяющим пациенту самостоятельно управлять ходом анальгезии (Patient Controlled Analgesia — PCA). Всем пациентам выполняли премедикацию мидазоламом 2 мг внутривенно (Дормикум®, Roche, Швейцария). Пациентов рандомизировали в две группы. При этом сгенерированная компьютером рандомизация к тому или иному виду лечения находилась в последовательно пронумерованных, запечатанных конвертах, которые вскрывались непосредственно перед индукцией анестезии. Анестезию индуцировали тиопенталом натрия 5 мг/кг. На данном этапе вводили также фентанил 1,5 мкг/кг и векуроний 0,1 мг/кг (последний препарат облегчал интубацию трахеи). В дальнейшем анестезия поддерживалась 1–2% севофлюраном в 50% смеси закиси азота/кислорода.
Обе группы пациентов получали в/в 2 мг морфина за 30 мин до экстубации трахеи. В блоке послеоперационного ухода (БПУ) после адекватного восстановления ментальных функций всем пациентам еще раз объясняли, как правильно пользоваться устройством РСА, которое было соединено с в/в катетером и установлено на режим болюсной доставки 1 мг морфина (интервал между болюсными инъекциями не мог быть менее 15 мин). В дополнение к этому группа Л получала в/в 16 мг лорноксикама (Ксефокам®, Nycomed, Дания) за 15 мин до операции и 8 мг этого препарата спустя 12 и 24 ч после операции. В аналогичные сроки и в аналогичных количествах группа М получала физиологический раствор. Шприцы с лорноксикамом и физиологическим раствором были обернуты в черную бумагу, чтобы обеспечить двойной слепой дизайн исследования. За ноль принимали отметку времени, когда пациенты были способны описать интенсивность боли. Частоту сердечных сокращений, уровень артериального давления, частоту дыхания и потребление морфина оценивали у пациентов в состоянии покоя на интервалах 1, 2, 3, 4, 6, 8, 12, 18, 24, 36 и 48 ч послеоперационного периода исследователем, который был «слеп» к протоколу исследования. Интенсивность боли оценивали с помощью 10-сантиметровой визуальной аналоговой шкалы (ВАШ). У пациентов регистрировали появление таких побочных эффектов, как тошнота, рвота, кожный зуд, сухость во рту, повышенное потоотделение, задержка мочи, седация, респираторная депрессия, гипотензия, тахикардия, раздражение желудка, повышенная кровоточивость из ран, гематемезис и мелена. Пациентов с частотой дыхания ниже 8 раз/мин оценивали как имеющих респираторную депрессию; им производили повторные инъекции налоксона 0,04 мг в/в до тех пор, пока не достигался желаемый клинический эффект (выход из респираторной депрессии. — Прим. пер.). Выраженность седации оценивали по четырехбалльной шкале: 1 — бодрствование, 2 — реакция на вербальные стимулы, 3 — реакция на болевые стимулы, 4 — отсутствие реакции на болевые стимулы. Снижение частоты сердечных сокращений ниже 50 уд/мин расценивали как брадикардию, а снижение среднего артериального давления на 30 % по сравнению с дооперационным уровнем расценивали как гипотензию. Брадикардию и гипотензию устраняли с помощью в/в введения атропина и эфедрина соответственно. При развитии тошноты или рвоты вводили метоклопрамид 10 мг в/в. При появлении зуда назначали 5 мг бензгидрамина.
Исходя из ожидаемой разницы интенсивности боли в состоянии покоя между основной и плацебо-группой на уровне 30 %, ошибки 1-го рода 0,05 и ошибки 2-го рода 0,20, был рассчитан необходимый размер групп — в каждой из них должно было быть по 15 пациентов. Для сравнения потребления морфина в двух группах был использован U-критерий Манна — Уитни. Характеристику пациентов сравнивали с помощью t-критерия Стьюдента для независимых групп и критерия хи-квадрат. Все гемодинамические данные были проанализированы с помощью дисперсионного анализа (ANOVA) для повторных измерений и парного t-критерия Стьюдента с апостериорным критерием Бонферрони. Частоту развития тошноты, рвоты и зуда анализировали с помощью критерия хи-квадрат или, при необходимости, с помощью точного критерия Фишера. Была рассчитана площадь под кривыми (ППК) «ВАШ — время», «потребление морфина — время», «частота сердечных сокращений — время» и «артериальное давление — время», а затем полученные значения сравнили между двумя группами пациентов с помощью t-критерия Стьюдента для независимых выборок. Все статистические расчеты были выполнены с помощью программы SPSS версии 10.0 (SPSS, Чикаго, Иллинойс, США). Различия считали достоверными при уровне р < 0,05.
Результаты
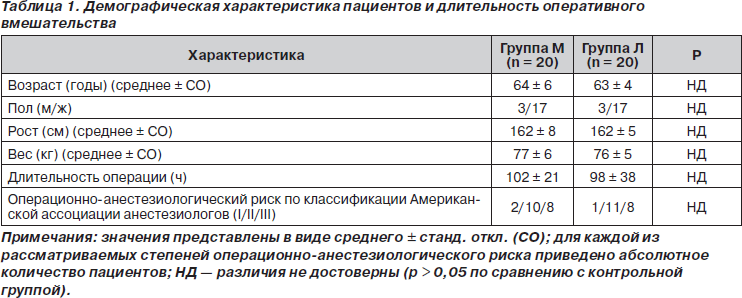
Во время исследования по три пациента в каждой группе (всего 6 пациентов) были исключены из наблюдения вследствие неспособности к кооперации (сотрудничеству) или непереносимости опиоидов. Два пациента из группы Л не могли охарактеризовать выраженность своей боли, и 2 пациента (один в группе М и один в группе Л) не пользовались устройством РСА, несмотря на то, что испытывали боль. Два пациента из группы М были исключены из исследования вследствие появления таких симптомов непереносимости опиоидов, как тревога, беспокойство и обильное потоотделение. Таким образом, в анализ в общей сложности были включены данные о 40 пациентах (34 женщины и 6 мужчин). Демографическая характеристика пациентов представлена в табл. 1. Обе группы пациентов были сравнимы по возрасту, росту, весу, полу, операционно-анестезиологическому риску (по классификации Американской ассоциации анестезиологов) и длительности оперативного вмешательства. Средние значения артериального давления, частоты сердечных сокращений и частоты дыхания пациентов во всех выделенных интервалах времени достоверно не различались (p > 0,05). В отношении выраженности седации в группах М и Л также не наблюдалось статистически достоверных различий ни на одном из интервалов времени (p > 0,05).
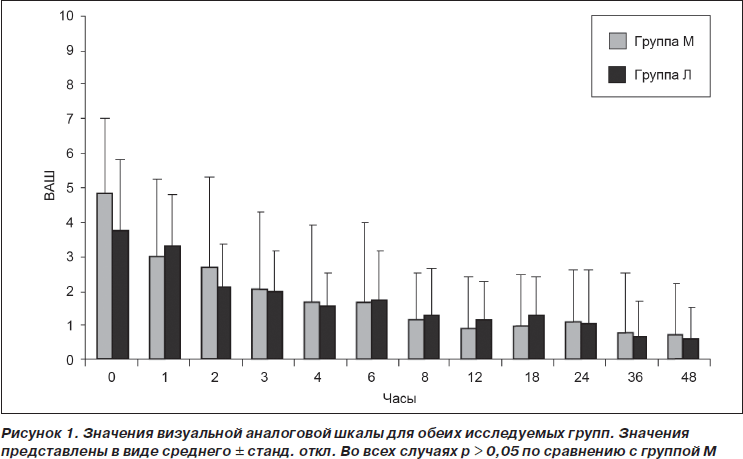
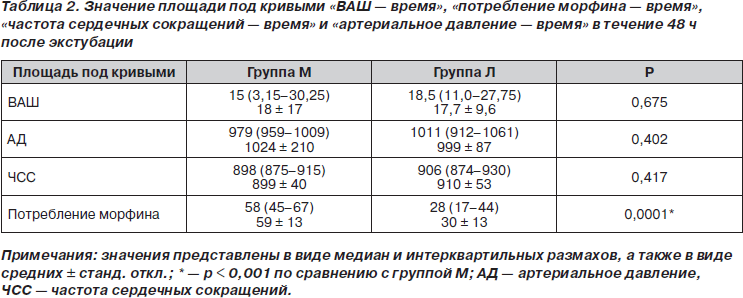
Когда пациенты, находящиеся в БПУ, полностью возвращались в сознание, их опрашивали на предмет выраженности переносимой ими боли. Первые записанные значения интенсивности боли составили 4,7 ± 2,2 и 3,7 ± 2,1 для групп М и Л соответственно (p > 0,05). Значения ВАШ в обеих группах были сравнимы в течение всего времени исследования (рис. 1) (p > 0,05). Площадь под кривой ВАШ также достоверно не различалась ни на одном из интервалов времени в течение 0–48 ч исследования (p > 0,05) (табл. 2).
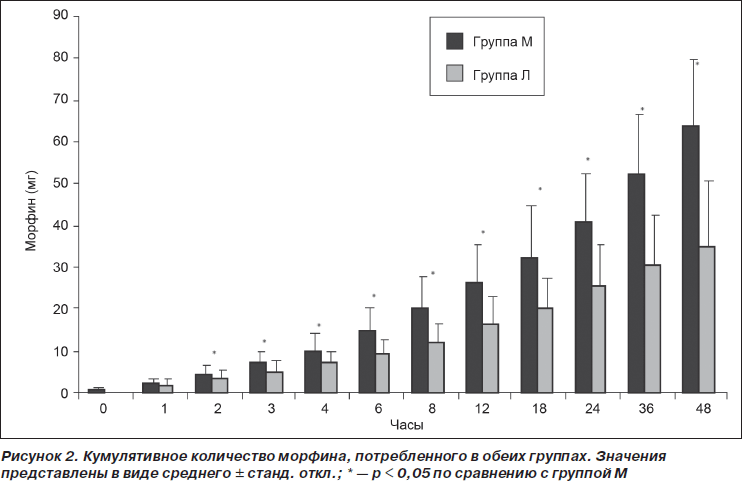
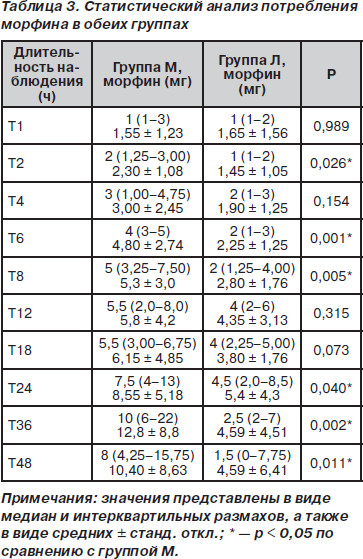
Потребление морфина в группе Л было достоверно ниже, чем в группе М, на интервалах 2, 3, 6, 8, 24, 36 и 48 ч послеоперационного периода (p < 0,05), в то время как на интервалах 1, 4, 12 и 18 ч достоверные различия обнаружены не были (табл. 3). Кумулятивное потребление морфина различалось достоверно во всех оцениваемых точках времени, за исключением первого послеоперационного часа исследования. Среднее кумулятивное потребление морфина к 48 ч исследования для групп М и Л составило 63,7 ± 15,7 мг и 34,6 ± 16,3 мг соответственно (p < 0,05) (рис. 2). Значения ППК «потребление морфина — время» за все 0–48 ч исследования представлены в табл. 2 (p < 0,001). В группе М у достоверно большего количества пациентов (12 против 5) наблюдались побочные эффекты по сравнению с группой Л (p < 0,05). В группе М количество пациентов, у которых наблюдалась тошнота (n = 9; 45 %), было достоверно более высоким по сравнению с группой Л (n = 3; 15 %) (p < 0,05). В группе М зуд наблюдался у 3 пациентов (15 %), в то время как в группе Л — у одного пациента (5 %) (p > 0,05). Один пациент (5 %) из группы Л пожаловался на сухость во рту. Всем пациентам с зудом был назначен в/в бензгидрамин.
Обсуждение
Протоколы с использованием мультимодальной анальгезии могут увеличивать достигаемую обезболивающую эффективность. Для лечения тяжелой послеоперационной боли могут применяться различные комбинации препаратов или методов, например блокада периферических нервов, эпидуральное введение местных анестетиков и/или опиоидов, внутривенное введение опиоидов и/или НПВС через устройство РСА (Vendittoli и соавт., 2006; Rosaeg и соавт., 2001). В ходе настоящего исследования внутривенное введение морфина с помощью РСА комбинировали с периодическим введением лорноксикама. Лорноксикам, вводимый до операции и спустя 12 и 24 ч после операции, достоверно снижал количество внутривенно вводимого морфина у пожилых пациентов, перенесших ТАКС. Кроме того, было обнаружено, что в группе с лорноксикамом наблюдалось достоверно меньшее количество побочных эффектов по сравнению с группой пациентов, получавших монотерапию морфином, вводимым в/в с помощью устройства РСА.
Лорноксикам является НПВС из группы оксикамов. Механизм его действия связан с торможением синтеза простагландинов и их производных, влияющих на формирование боли, путем ингибирования фермента циклооксигеназы в каскаде превращений арахидоновой кислоты. Как и другие НПВС из группы оксикамов, лорноксикам хорошо связывается (90 %) с белками плазмы крови и имеет низкий кажущийся объем распределения (0,2 л/кг). Однако он легко проходит в периваскулярные интерстициальные пространства, включая синовиальную жидкость (Balfour и соавт., 1996). Лорноксикам, как и другие оксикамы, обладает выраженными противовоспалительными и обезболивающими свойствами, но в отличие от других оксикамов он имеет более короткий период полувыведения (3–5 ч), что снижает частоту развития побочных эффектов, связанную с длительным нахождением препаратов в плазме крови (Radhofer-Welte и Rabasseda, 2000; Olkkola и соавт., 1994). Результаты сравнительных исследований свидетельствуют о том, что в раннем послеоперационном периоде эффективность лорноксикама была сравнима с таковой у парекоксиба и превышала эффективность кетопрофена (Karaman и соавт., 2006; Papadima и соавт., 2006). В настоящем исследовании в раннем послеоперационном периоде лорноксикам был достоверно более эффективен в ослаблении боли по сравнению с плацебо.
Опиоиды являются часто используемыми средствами для борьбы с послеоперационной болью, их можно вводить самыми различными путями, однако вызываемые ими побочные эффекты ограничивают их применение и обезболивающую эффективность (Schug и соавт., 1991). В частности, в нашем исследовании у двух пациентов из группы с морфином развилась непереносимость морфина и они были исключены из исследования. Подобные обстоятельства заставляют врачей искать другие лекарственные средства и методы для борьбы с послеоперационной болью. НПВС — эффективные и вместе с тем хорошо переносимыми лекарственные средства, вследствие чего они являются хорошей альтернативой опиоидным анальгетикам при кратковременном применении (Nuutinen и соавт., 1993). Во многих исследованиях было показано, что их обезболивающая эффективность сравнима с таковой у морфина, трамадола и меперидина (Staunstrup и соавт., 1999; Rosenow и соавт., 1998; Ilias и Jansen, 1996; Nоrholt и соавт., 1996; Rosenow и соавт., 1996). Насколько известно авторам, до сих пор не было выполнено клинических исследований, посвященных оценке обезболивающей эффективности лорноксикама у пациентов, перенесших ТАКС. В связи с этим прямое сравнение дозы лорноксикама, требуемой при данном типе хирургических вмешательств, не было возможным. В исследовании Rosenow и соавт. (1998) среднее количество лорноксикама, вводимого внутривенно с помощью устройства РСА пациентам с дискэктомией (без внедрения имплантов) составило 19,8 мг. Тип хирургического вмешательства оказывает влияние на дозу используемого анальгетика (Yorukoglu и соавт., 2005). ТАКС относится к операциям, которые вызывают выраженный болевой синдром. Учитывая это, в настоящем исследовании в дополнение к болюсному внутривенному введению лорноксикама применялось внутривенное введение морфина с помощью устройства РСА, что в своей совокупности обеспечивало достаточную анальгезию.
Согласно данным литературы, лорноксикам переносится лучше, чем морфин, о чем свидетельствует более низкая частота развития побочных эффектов при назначении первого из них (Rosenow и соавт., 1998; Norholt и соавт., 1996). В нашем исследовании применение лорноксикама в сочетании с морфином приводило к достоверному снижению числа побочных эффектов, связанных с применением морфина. Кроме того, мы не наблюдали побочных эффектов, связанных с приемом лорноксикама.
Пациенты гериатрической возрастной группы со снижением функции органов во многих системах могут быть склонны к развитию побочных эффектов в послеоперационном периоде. Однако необходимость адекватного ослабления боли не может быть проигнорирована. Фармакокинетические исследования лорноксикама у пожилых волонтеров (возраст 66–79 лет) не выявили каких-либо признаков аккумуляции препарата после многократного назначения лорноксикама этим пациентам (Radhofer-Welte и Rabasseda, 2000). Усиление энтерогепатической элиминации лорноксикама может компенсировать сниженную почечную элиминацию у пациентов с тяжелой почечной дисфункцией; однако у пациентов с нарушением функции печени наблюдается накопление неактивного основного метаболита лорноксикама (Balfour и соавт., 1996). В нашем исследовании общая доза введенного лорноксикама составила 32 мг. В более раннем исследовании было показано, что использование такого суммарного количества лорноксикама является безопасным (Rosenow и соавт., 1998).
В исследованиях, посвященных изучению эффективной обезболивающей дозы лорноксикама, было показано, что при борьбе с послеоперационной болью доза препарата 4 мг превышает по эффективности плацебо, но уступает дозе 8–32 мг препарата. Для эффективной борьбы с послеоперационной болью дозы лорноксикама должны быть равны или превышать 8 мг (Nоrholt и соавт., 1995). В настоящем исследовании общая доза лорноксикама 24 мг в/в, введенная в течение первых 24 ч исследования, и 8 мг, введенная во время вторых 24 ч исследования, приводила к снижению общего количества потребленного морфина к концу исследования на 46 % в группе Л по сравнению с группой М (63,7 против 34,6 мг). Это снижение было связано с дополнительной обезболивающей эффективностью лорноксикама. При моделировании острой висцеральной боли у крыс с помощью колоректального растяжения обезболивающая активность лорноксикама была менее эффективной, чем у морфина. Однако добавление лорноксикама к морфину увеличивало эффект последнего и позволяло снизить применяемые дозы морфина, что может быть важным для предотвращения развития опиатных побочных эффектов (Towart и соавт., 1998). С этой целью и мы назначали лорноксикам в дополнение к морфину — чтобы увеличить эффективность морфина и снизить частоту обусловленных им побочных эффектов.
В исследовании Rosenow и соавт. (1998) двум группам пациентов с операцией на межпозвоночных дисках поясничного отдела с целью обезболивания назначали лорноксикам и морфин, вводимые с помощью устройства РСА. Спустя 24 ч общая доза потребленного лорноксикама и морфина составила соответственно 19,8 и 22,2 мг. Частота развития побочных эффектов при введении лорноксикама и морфина составила соответственно 25 и 60 %. Лорноксикам обеспечивал анальгезию, статистически эквивалентную морфину. Начало анальгезии было немного более быстрым при назначении морфина. Потребность в лорноксикаме, доставляемом с помощью РСА, в начале исследования была больше, чем в морфине, однако во второй 12-часовой интервал потребность в морфине была выше. В ходе исследования была отмечена тенденция к тому, что начало обезболивания при применении лорноксикама было более медленным, чем при использовании морфина. Наблюдаемая разница в скорости обезболивающего эффекта отчасти может быть объяснена несколько более высокой частотой преждевременного выбывания пациентов из исследования в группе с лорноксикамом из-за отсутствия терапевтического эффекта (28,3 против 18,0 % в группе с морфином) (Rosenow и соавт., 1998).
В нашем исследовании комбинация лорноксикама и морфина переносилась лучше, чем монотерапия морфином. Дополнительное назначение лорноксикама приводило к снижению потребления морфина, что, в свою очередь, снижало частоту развития побочных эффектов. Ни один из пациентов в группе с лорноксикамом не выбыл из исследования вследствие непереносимости препаратов, в то время как в группе с монотерапией морфином таких пациентов оказалось двое.
Отсутствие статистических различий между группами в среднем потреблении морфина в первый час после операции связали с отсроченным обезболивающим эффектом лорноксикама. Аналогичные результаты были получены в исследовании S. Karaman и соавт. (2006): лорноксикам вводили в предоперационном периоде, а снижение потребления морфина наблюдали со второго послеоперационного часа. В более ранних исследованиях, посвященных оценке обезболивающей активности лорноксикама в послеоперационном периоде, длительность наблюдения составляла всего 24 ч после операции; поэтому данные, касающиеся потребления морфина во второй послеоперационный день, не могли быть оценены (Rosenow и соавт., 1996; Rosenow и соавт., 1998). В настоящем исследовании в группе М общее потребление морфина в первые 24 ч послеоперационного периода составило 40,5 мг, в последующие 24 ч — 23,2 мг (с 24 по 48 ч). Снижение потребления морфина составило 43 %. В группе Л потребление морфина составило 25,5 и 9,1 мг для первых и вторых 24 ч соответственно и снижение потребления морфина составило 64 %. В этой группе только 8 мг лорноксикама было использовано во второй послеоперационный день.
Результаты ряда предыдущих исследований показали, что в обезболивающие эффекты лорноксикама может вносить вклад и эндогенное высвобождение опиоидов. В исследовании Kullich и Klein (1992) пациентам с острой болью в нижней части спины назначали лорноксикам в течение 5 дней. Повторное введение лорноксикама приводило к повышению плазменного уровня динорфина и бета-эндорфина; этот факт был использован, чтобы объяснить повышение обезболивающей активности препарата.
В нашем исследовании лорноксикам вводился в намного более низкой дозе во второй послеоперационный день, но, несмотря на это, потребление морфина снижалось значительно (64 %). Это может быть связано с пролонгированием эффекта общей дозы лорноксикама, вводимого в первый послеоперационный день, или с кумулятивным эффектом лорноксикама, вводимого по расписанию в намеченные часы. В исследовании Norholt и соавт. (1996) средняя длительность анальгезии, достигаемой морфином в дозе 20 мг (8,2 ч), была чуть более продолжительной, чем при введении 8, 16 или 20 мг лорноксикама (5,1; 7,0 и 6,8 ч соответственно), и более чем в два раза дольше, чем при введении морфина в дозе 10 мг (2,5 ч). Причины подобного явления должны быть выяснены в будущих исследованиях.
Таким образом, введение пациентам с тотальной артропластикой коленного сустава 24 мг лорноксикама в течение первых 24 ч после операции и 8 мг лорноксикама в течение вторых 24 ч после операции приводило к снижению потребления морфина и частоты развития связанных с морфином побочных эффектов, без развития дополнительных побочных эффектов, связанных с приемом лорноксикама. В дополнение к этому лорноксикам снижал частоту появления тошноты с 40 до 15 % и зуда с 15 до 5 % во время послеоперационной анальгезии, обусловленной морфином. Для комбинированной терапии лорноксикамом и морфином был характерен более благоприятный профиль безопасности, чем для монотерапии морфином, что является привлекательной альтернативой для лечения тяжелой послеоперационной боли.
Благодарности
Выражаем благодарность профессору Y. Ates за руководство при подготовке данной статьи и Z. Alanoglu, MD, за его помощь.
Перевод А.В. САВУСТЬЯНЕНКО
Balfour J.A., Fitton A., Barradel L.B. Lornoxicam: A review of its pharmacology and therapeutic potential in the management of painful and inflammatory conditions // Drugs. — 1996. — 51(4). — 639-57.
Bernstein R.M., Calin H.J., Calin A., Ollier S. A comparison of the efficacy and tolerability of lornoxicam and indomethacin in ankylosing spondylitis // Eur. J. Rheumatol. Inflamm. — 1992. — 12. — 6-13.
Bonica J. Postoperative pain // Bonica J., eds. The management of pain. — Philadelphia, Lea&Febier, 1990. — 461-80.
Ilias W., Jansen M. Pain control after hysterectomy: an observer blind, randomised trial of lornoxicam versus tramadol // Br. J. Clin. Pract. — 1996. — 50. — 197-202.
Karaman S., Gunusen I., Uyar M., Firat V. The effect of preoperative lornoxicam and ketoprofen application on the morphine consumption of postoperative patient-controlled analgesia // J. Int. Med. Res. — 2006. — 34. — 168-175.
Kehlet H. Surgical stress; the role of pain and analgesia // Br. J. Anaesth. — 1989. — 85. — 189-95.
Kidd B., Frenzel W. A multicenter, randomized, double blind study comparing lornoxicam with diclofenac in osteoarthritis // J. Rheumatol. — 1996. — 23(9). — 1605-11.
Kullich W., Klein G. Influence of the nonsteroidal anti-inflammatory drug lornoxicam i.v. on the secretion of the endogenous opiate peptides dynorphin and b-endorphin // Aktuel. Rheumatol. — 1992. — 17. — 128-32.
Norholt S.E., Sindet-Pedersen S., Bugge C., Branebjerk P.E., Ersboll B.K., Bastian H.L. A randomized, double-blind, placebo-controlled, dose-response study of the analgesic effect of lornoxicam after surgical removal of mandibular third molars // J. Clin. Pharmacol. — 1995. — 35. — 606-614.
Norholt S.E., Sindet-Pedersen S., Larsen U., Bang U., Ingerslev J., Nielsen O., Hansen H.J., Ersboll A.K. Pain control after dental surgery: a double-blind, randomized trial of lornoxicam versus morphine // Pain. — 1996. — 67. — 335-43.
Nuutinen L.S., Laitinen J.D., Salomaki T.E. A risk benefit appraisal of injectable NSAIDs in the management of postoperative pain // Drug Safety. — 1993. — 9. — 380-3.
Olkkola K.T., Brunetto A.V., Mattila M.J. Pharmacokinetics of oxicam nonsteroidal anti-inflammatory agents // Clin. Pharmacokinet. — 1994. — 26. — 107-20.
Papadima A., Lagoudianakis E.E., Antonakis P.T., Pattas M., Kremastinou F., Katergiannakis V., Manouras A., Georgiou L. Parecoxib vs lornoxicam in the treatment of postoperative pain after laparascopic cholecystectomy: a prospective randomized placebo-controlled trial // Eur. J. Anaesthesiol. — 2006. — 29. — 1-5.
Priebe H.J. The aged cardiovascular risk patient // Br. J. Anaesth. — 2000. — 85. — 763-78.
Radhofer-Welte S., Rabasseda X. Lornoxicam, a new potent NSAID with an improved tolerability profile // Drug Today. — 2000. — 36. — 55-76.
Rosaeg O.P., Krepski B., Cicutti N., Dennehy K.C., Lui A.C., Johnson D.H. Effect of preemptive multimodal analgesia for arthroscopic knee ligament repair // Reg. Anesth. Pain. Med. — 2001. — 26(2). — 125-30.
Rosenow D.E., Krieken F., Stolke D., Kursten F.W. Intravenous administration of lornoxicam, a new NSAID, and pethidine for postoperative pain // Clin. Drug Invest. — 1996. — 11. — 11-19.
Rosenow D.E., Albrectsen M., Stolke D. A comparision of patient controlled analgesia with lornoxicam versus morphine in patients undergoing lumbar disk surgery // Anesth. Analg. — 1998. — 86. — 1045-50.
Schug S.A., Merry A.F., Acland R.H. Treatment principles for the use of opioids in pain of nonmalignant origin // Drugs. — 1991. — 42. — 228-39.
Staunstrup H., Ovesen J., Larsen U.T., Elbaek K., Larsen U., Kroner K. Efficacy and tolerability of lornoxicam versus tramadol in postoperative pain // J. Clin. Pharmacol. — 1999. — 39. — 834-41.
Towart R., Grarup J., Stimmeder D. Lornoxicam potentiates morphine antinociception during visceral nociception in the rat // Naunyn-Schmied Arch. Pharmacol. — 1998. — 358. — 172.
Vendittoli P.A., Makinen P., Drolet P., Lavigne M., Fallaha M., Guertin M.C., Varin F. A multimodal analgesia protocol for total knee arthroplasty. A randomized, controlled study // J. Bone Joint. Surg. Am. — 2006. — 88(2). — 282-9.
Yorukoglu D., Ates Y., Temiz H., Yamali H., Kecik Y. Comparison of low-dose intrathecal and epidural morphine and bupivacaine infiltration for postoperative pain control after surgery for lumbar disc disease // J. Neurosurg. Anesthesiol. — 2005. — 17. — 129-133.