Международный эндокринологический журнал 4 (44) 2012
Вернуться к номеру
Новые аспекты патогенеза и лечения диабетической ретинопатии
Авторы: Шилова О.Г. - ГБОУ ВПО «Сибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Томск, Россия
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Статья посвящена одному из ведущих осложнений сахарного диабета — диабетической ретинопатии. Авторами статьи разработаны критерии эффективности лечения диабетической ретинопатии при сахарном диабете 2 типа с позиции новых взглядов на основные звенья патогенеза.
The article is devoted to one of the main complications of diabetes mellitus — diabetic retinopathy. The authors have developed the criteria of efficacy of diabetic retinopathy treatment in diabetes mellitus type 2 from a perspective of new concepts of base links of pathogenesis.
Стаття присвячена одному з провідних ускладнень цукрового діабету — діабетичній ретинопатії. Авторами статті розроблені критерії ефективності лікування діабетичної ретинопатії при цукровому діабеті 2-го типу з позиції нових поглядів на основні ланки патогенезу.
диабетическая ретинопатия, патогенез, лечение.
diabetic retinopathy, pathogenesis, treatment.
діабетична ретинопатія, патогенез, лікування.
Введение
В современной офтальмологии один из научнопознавательных акцентов связан с изучением патогенетических процессов в гемо и гидродинамике заднего отдела глазного яблока, лежащих в основе сосудистых заболеваний сетчатки, которые занимают лидирующее место среди причин слепоты и слабовидения. В первую очередь это относится к диабетической ретинопатии (ДР), тромбозам ретинальных вен, глаукомной оптической нейропатии, макулодистрофии и другим патологическим процессам. Для данной патологии характерен широкий спектр необратимых изменений, ухудшающих результаты лечения и значительно затрудняющих проведение хирургических вмешательств [1, 2].
Проблема изучения патогенетических механизмов развития ангиопатии и ретинопатии особенно актуальна в клиническом аспекте. Это связано с качеством предиктивной оценки, определением характера и объема лечебных вмешательств, контролем эффективности лечения, а также с прогнозированием дальнейшего развития патологического процесса.
О сложности и многогранности проблемы патогенеза диабетической ретинопатии свидетельствует тот факт, что в последние годы изучение механизмов развития и формирования диабетической ангиопатии, роли гематоофтальмического барьера в этих процессах привлекает внимание не только офтальмологов, но и ученых иного профиля — морфологов, патофизиологов. Такой широкий подход обеспечивает необходимую фундаментальность проводимым исследованиям, а также открывает перспективу иных концептуальных построений [3, 4].
Сахарный диабет (СД) является одной из ведущих причин слепоты в развитых странах, причем на ДР приходится до 70 % случаев. Считается, что у подавляющего большинства пациентов потерю зрения, связанную с ДР, можно предотвратить. СД 2го типа составляет почти 90 % от общего числа больных диабетом. Часто у больных СД 2го типа ретинопатия обнаруживается в момент установления основного диагноза, а иногда вначале регистрируется поражение сетчатки, а затем и диабет. Примерно у 2/3 больных СД 2го типа признаки ретинопатии выявляются через 15–20 лет после начала заболевания, при этом у пятой части пациентов — уже в пролиферативной стадии [5].
Проблема патогенеза поражений сосудов глазного дна при СД и поиск новых подходов к терапии этого страдания остаются самыми актуальными в диабетологии. Общепризнанной является метаболическая гипотеза развития диабетических микроангиопатий [6]. В последнее десятилетие опубликованы работы, в которых приоритетное значение в развитии сосудистых осложнений СД придается осмотическому стрессу, воздействие которого в первую очередь рассматривается на уровне межклеточных и клеточных взаимодействий.
При СД патологически изменяются гемореологические и гемоагрегационные свойства крови и локальная гемодинамика. Микроциркуляторное русло глаза представляет собой функциональную подсистему, которая, с одной стороны, является частью специфической биосистемы органа зрения, а с другой — частью общей системы кровообращения, что позволяет рассматривать проблему патогенеза с позиций функционального состояния крови.
В этом контексте первоочередной задачей определена разработка системных подходов в хирургии патологии стекловидного тела и сетчатки на основе использования последних достижений операционной и эндоскопической оптики, лазерных технологий, аппаратного и медикаментозного обеспечения.
Однако, на наш взгляд, имеющиеся знания не позволяют с исчерпывающей полнотой патогенетически обосновать механизмы лечебного воздействия лазеркоагуляции сетчатки и витрэктомии, следовательно, остаются открытыми вопросы о прогнозировании исходов лечения, дальнейшем развитии патологического процесса, влияющего на качество жизни. Неясным остается вопрос о комплексном воздействии осмотического давления крови на сосудистую стенку в условиях однонаправленного тока тканевой жидкости. В связи с этим представляется актуальным изучение морфологических, биохимических и физикохимических аспектов гемо и гидродинамики глаза у больных СД, имеющих нарушения осмотического статуса крови.
Цель исследования — разработать критерии эффективности лечения диабетической ретинопатии при сахарном диабете 2го типа с позиции новых взглядов на основные звенья патогенеза.
Материалы и методы исследования
Для решения поставленных задач было проведено клиническое обследование 243 больных СД 2го типа. При расчете необходимого объема выборки принимали во внимание, что частота выявляемости ДР колеблется в широких пределах — от 40 до 100 %, в зависимости от длительности заболевания. Учитывая, что в исследование будут включены лица с различной длительностью СД, приняли за среднюю частоту выявления ДР 62,5 % (как среднее арифметическое всех частот, обнаруженных в доступных литературных источниках). Эту частоту использовали для расчета минимального объема выборки при подстановке в формулу:
/76/76.jpg)
где t — нормированное отклонение, соответствующее заданному уровню значимости (в нашем случае t = 1,96 при р = 0,05), р' — частота регистрации ДР в популяции, D — ошибка репрезентативности, предельная величина ошибки выборочных показателей.
Учитывая широкий разброс значений частот выявления ДР, зависимость ее значительного числа факторов, запланировали ошибку репрезентативности на уровне 6 %, при этом минимальный объем выборки должен был составлять не менее 250 обследованных. Сформированная выборка была сокращена до 243 пациентов ввиду того, что 7 человек выбыли из исследования по причине неявки на контрольный осмотр через 3 года. Число оставшихся пациентов позволило считать выборку репрезентативной и удовлетворяющей поставленным условиям, так как ошибка репрезентативности в ней значимо не превышала заданный уровень (6,09 %).
В качестве контроля служила группа из 32 лиц, больных СД, не имеющих признаков ДР, в возрасте от 45 до 65 лет. Все наблюдаемые были подвергнуты комплексному обследованию эндокринологом и офтальмологом.
Критериями включения в исследование служили: СД 2го типа; одинаковая стадия ДР на обоих глазах; начальные изменения прозрачности хрусталиков; полученное от пациента информированное согласие; возраст пациентов любого пола и этнической группы ко времени включения в исследование в пределах 45–75 лет.
Критериями исключения являлись: СД 1го типа, наличие признаков клинически значимого неконтролируемого заболевания любого органа или системы органов (например, активный туберкулез, онкологические заболевания), состояния в анамнезе (психические нарушения, алкоголизм, значимое снижение интеллекта), которые могут ограничивать законность информированного согласия или искажать интерпретацию результатов исследования.
Общий срок наблюдения составил от одного месяца до трех лет. Была предусмотрена возможность дифференцированного индивидуального старта исследования (пациента включали в исследование при обращении в клинику независимо от пациентов других групп). Рандомизирующими параметрами служили состояние биохимического и осмотического статуса и желание/нежелание пациента использовать предложенный метод лечения.
Из числа 243 обследованных 67 больных (134 глаза) были с непролиферативной стадией ДР, 92 больных (184 глаза) — с препролиферативной стадией и 84 больных (168 глаз) — с пролиферативной стадией ДР. 32 человека составили контрольную группу (64 глаза). Большинство пациентов было в возрасте 41–60 лет, при этом средний возраст больных ДР I составил 39,0 ± 6,4 года, ДР II — 48,6 ± 5,2 года, ДР III — 54,1 ± 6,1 года. Отмечалась достоверная разница в возрасте больных с ДР II и ДР III по сравнению с контрольной группой, что подтверждает зависимость выраженности поражений сетчатки от продолжительности заболевания. Достоверной разницы по полу и возрасту среди всех обследованных не отмечалось (р > 0,05).
На момент обследования давность заболевания у пациентов с ДР I составляла 13,2 ± 4,3 года, с ДР II — 18,4 ± 7,1 года, а у больных с ДР III — 21,3 ± 8,6 года. В контрольной группе «стаж» болезни был 16,1 ± 5,2 года.
Среди всех обследованных больных только у 9 человек с ДР III заболевание находилось в состоянии компенсации, тогда как у пациентов с непролиферативной и препролиферативной стадиями диабетической ретинопатии — у 41 и 39 человек соответственно. Уровень гликемии составлял 5,6–7,8 ммоль/л. Состояние умеренной и субкомпенсации течения СД констатировалось у 28 пациентов с ДР I, у 52 — с ДР II и у 57 человек — с пролиферативной ДР. При этом уровень глюкозы крови у разных больных колебался от 6,4 до 12,4 ммоль/л и составлял в среднем 7,5 ммоль/л. Тяжелое течение заболевания и декомпенсация отмечались у 11 и 18 больных ДР II, ДР III соответственно. У этих пациентов уровень гликемии варьировал от 6,7 до 22,4 ммоль/л и составлял в среднем 11,5 ммоль/л. У пациентов с ДР I декомпенсированного течения СД не отмечалось.
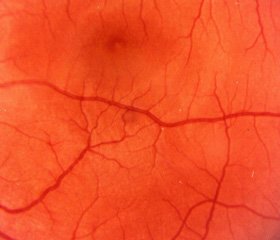
Обследование органа зрения всех пациентов осуществляли по общепринятой методике. При этом комплекс обследования включал в себя: визометрию, периметрию, биомикроскопию, офтальмоскопию — прямую и обратную, флюоресцентную ангиографию глазного дна, модифицированный метод компьютерной морфометрии для измерения калибра сосудов глазного дна, электроретинографию, определение электрического фосфена и лабильности сетчатки и зрительного нерва.
Данные офтальмоскопического исследования обрабатывали с использованием программы ImageJ (США). Фотографии глазного дна получали на фундускамере фирмы Karl ZeissJena. Полученные изображения переносили в компьютер. Затем проводили предварительную подготовку изображения для его дальнейшего анализа. Программа ImageJ позволяет получать количественные данные об областях изображения. В настоящем исследовании определяли следующие параметры: линейную толщину сосудов (калибр вен и артерий 1го и 2го порядка), среднюю оптическую плотность сосудов для дифференциации артерий и вен, изменения в структуре сосудов, количество микроаневризм и их плотность в изучаемых полях, количество геморрагий и экссудаций.
На втором этапе работы методом случайных чисел из групп обследованных больных были сформированы подгруппы, различающиеся по типу лечения, которое имело некоторые предлагаемые для обсуждения модификации, но без принципиальных отличий внутри каждой группы.
Дизайн исследования: когортное проспективное в параллельных группах (рис. 1). Среди пациентов с непролиферативной ДР было выделено 2 подгруппы: у 34 пациентов была выполнена щадящая (субпороговая) лазеркоагуляция (ЩЛК), у 33 — стандартная панретинальная лазеркоагуляция (ПРК) сетчатки.
У 48 пациентов с препролиферативной ретинопатией и макулярным отеком выполнялась щадящая (субпороговая) аргонлазеркоагуляция. Лечение сочетали с применением препарата полиосм (патент на изобретение № 2265425 от 10 декабря 2004 года), а у 44 пациентов проводилась стандартная панретинальная лазеркоагуляция сетчатки.
При пролиферативной ретинопатии вначале производилась закрытая задняя витрэктомия на аппарате Ocutome, а затем у 43 человек — щадящая субпороговая аргонлазеркоагуляция, дополненная применением препарата полиосм, а у 41 — стандартная панретинальная аргонлазеркоагуляция.
Панретинальную лазеркоагуляцию проводили на офтальмологическом аргоновом лазере Visulas2 Opton в условиях медикаментозного мидриаза по стандартной методике за три примерно равных по объему сеанса, с интервалом в 2 недели. Всего за один сеанс лечения наносили 400–600 аппликаций, расположенных друг от друга на расстоянии 500 мкм. При необходимости проводили полный объем панретинальной лазеркоагуляции, составляющий 1500–2500 коагулятов. В макулярной области сетчатой оболочки коагуляты наносили на расстоянии 500–3000 мкм от центра макулы диаметром пятна 50–100 мкм, а затем обрабатывали всю поверхность сетчатки по стандартной методике: мощность — 140–300 мВт; время экспозиции — 0,1–0,2 с; диаметр светового пучка — 500 мкм.
Щадящую (субпороговую) лазеркоагуляцию проводили с использованием зеленой составляющей спектра излучения офтальмологического аргонового лазера Visulas2 Opton в условиях медикаментозного мидриаза. Нанесение лазерных коагулятов осуществляли через панфундуслинзу или трехзеркальную линзу Goldman’а после предварительной эпибульбарной анестезии 0,4% раствором инокаина. На первом этапе осуществляли барраж макулярной зоны в виде подковы, раскрытой в сторону диска зрительного нерва. Коагуляты наносили на расстоянии не менее 2500 мкм от центральной ямки. Режим работы: мощность — 140–300 мВт; время экспозиции — 0,04–0,2 с; диаметр светового пучка — 100 мкм; количество аппликаций — 20–30.
Барраж выполняли в режиме единичных вспышек. Затем лазер переводили в автоматический режим работы и проводили коагуляцию остальных отделов сетчатки, за исключением папилломакулярного пучка. Использовали вышеприведенные параметры излучения. Всего наносили 400–450 аппликаций, расположенных друг от друга на расстоянии 1500 мкм.
В НИИ фармакологии ТНЦ СО РАМН был разработан новый препарат на основе полиэтиленоксида — полиосм (30% раствор полиэтиленоксида 400 для внутривенного введения), относящийся к группе низкомолекулярных полиэтиленоксидов, проявляющий высокую степень осмотической активности и превосходящий по этому свойству глицерин: одна молекула препарата связывает 8,2 молекулы воды. Препарат разрешен к применению МЗ РФ (протокол № 115 от 09.10.2000) в соответствии с утвержденным протоколом.
Исследование показателей осмотического гомеостаза и свертывающей системы крови проводили после забора внутриглазной жидкости во время операции (0,2 мл) и крови из вены (5–10 мл).
Морфологические исследования выполнены в лаборатории иммуноцитохимии Kresge Eye Institute of Wayne State University (Detroit Medical Center) под руководством Dr. Robert N. Frank (1997, 2004). Для исследования использовали сетчатку, взятую из энуклеированных глаз умерших пациентов (глаза поступали из банка донорских органов National Diseases Research Interchange).
В исследовании использовали пакет статистических программ Statistica 6.0 (StatSoft, США). Выборки результатов проверялись на нормальность распределения с помощью теста Колмогорова — Смирнова. Учитывая, что изучаемые данные имели различные законы распределения, в качестве презентационной характеристики использовали среднее значение и выборочное стандартное отклонение. Для расчетов применялись параметрические (tкритерий Стьюдента при нормальном распределении) и непараметрические методы: U — Манна — Уитни (для независимых выборок), W — Уилкоксона (для зависимых выборок) при распределении, отличающемся от нормального. При проверке уровня значимости различий качественных признаков использовали точный тест Фишера. Во всех случаях различия считали достоверными при достижении уровня значимости меньше 0,05. Корреляции рассчитывали при помощи теста непараметрической корреляции Спирмена, поскольку исследуемые показатели имели закон распределения, отличающийся от нормального. Полученную корреляцию считали статистически значимой при р < 0,05.
Результаты исследований и их обсуждение
Сравнительный анализ изображений глазного дна пациентов с сахарным диабетом 2го типа позволил выявить следующие закономерности. По мере утяжеления ДР калибр вен I порядка расширялся: р1–2 = = 0,19; р2–3 = 0,014; р1–3 = 0,011. Аналогичную динамику наблюдали при измерении калибра вен II порядка.
Артерии I и II порядков, напротив, суживались по мере утяжеления ДР. Однако диаметр артерий I порядка значимо не различался у пациентов в зависимости от стадии ДР: 83,9 ± 13,8 мкм; 81,2 ± 11,3 мкм; 86,7 ± 12,3 мкм в группах пациентов с I, II, III стадиями ДР соответственно (р > 0,05 при попарном сравнительном анализе во всех случаях).
При сравнительном анализе калибра артерий II порядка не определялось значимых различий между показателями пациентов со II и III стадиями ДР: 38,4 ± 9,8 и 36,0 ± 11,3 соответственно (р2–3 > 0,05), тогда как калибр артерий II порядка пациентов с ДР I оказался достоверно больше такового в обеих группах сравнения: 65,5 ± 11,1 мкм (р1–2 = 0,010; р1–3 = 0,008).
Показано увеличение среднего количества микроаневризм на одного пациента в зависимости от стадии ДР. У пациентов с I, II, III стадиями ДР обнаруживалось 5,5 ± 2,1; 12,2 ± 6,1; 16,1 ± 8,3 микроаневризмы (р1–2 = 0,026; р2–3 = 0,023; р1–3 = 0,019). У пациентов с ДР I петехиальные кровоизлияния выявлялись значимо реже (в 11,9 % случаев), чем у пациентов с ДР II и ДР III (в 43,5 и 32,1 % случаев соответственно, р1–2 < 0,001; р1–3 = 0,003).
Внешний вид выявляемых кровоизлияний различался у пациентов с разной степенью ДР. У пациентов с ДР I преимущественно выявлялись петехиальные кровоизлияния: 43,6 ± 2,9 против 15,9 ± 3,3 и 18,7 ± 2,7 кровоизлияний на 1 пациента со II и III стадиями ДР соответственно (р1–2 < 0,001; р1–3 = 0,002). Сливные кровоизлияния не были выявлены у пациентов с ДР I , тогда как у больных с ДР II и ДР III различия в частоте выявления кровоизлияний такого типа и в их количестве на 1 пациента не оказались значимыми: соответственно 56,5 и 67,9 % (р2–3 > 0,05); 6,2 ± 0,8 и 7,4 ± 0,6 (р2–3 > 0,05).
Таким образом, мы получили убедительные количественные показатели офтальмоскопической картины, характеризующие принципиальные отличия разных стадий ДР и доказывающие, что калибр сосудов и количественные характеристики ИРМА могут являться предиктором прогрессирования ДР. В связи с этим считаем целесообразным использование имеющейся классификации диабетических изменений глазного дна, включающей непролиферативную, препролиферативную и пролиферативную стадии.
У пациентов, составивших контрольную группу, амплитуда волн a и b электроретинограммы (ЭРГ) находилась на уровне нормальных значений (32,9 ± 1,9), что предполагает отсутствие достоверных различий с нормой, для показателей латентности и отношения b/a ситуация аналогична. Таким образом, у больных сахарным диабетом с нормальной структурой сетчатки (отсутствие проявлений ДР) все показатели ЭРГ находятся в пределах нормальных значений, что говорит об отсутствии нарушений генерации потенциала действия в электрохимии сетчатки.
По мере развития ДР мы отметили, что нарастает разница между показателями больных СД с поражением сетчатки и у пациентов группы сравнения. Отмечается очень интересная тенденция: на ранних стадиях развития ДР отношение b/a супернормальное, как и в контрольной группе. Даже при наличии ДР I мы видим значительную разницу в показателях амплитуды и латентности на ЭРГ. Амлитуда снижена по a и bволнам, а латентность повышена, причем значительно больше по aволне (приблизительно в 1,2 раза), что не противоречит данным А.М. Шамшиновой (2009), подтверждающим, что ранним симптомом патологических процессов в фоторецепторах сетчатки еще до снижения амплитуды bволны является увеличение латентности волн ЭРГ.
По мере утяжеления стадий ДР происходит дальнейшее снижение амплитуды, а при ДР III — в разы (приблизительно в 2,3 раза) по сравнению с показателями контрольной группы. В то же время отношение пресинаптической и постсинаптической активности сетчатки (b/a) изменилось при этом незначительно, что говорит о компенсаторных возможностях электрической активности сетчатки. Важно отметить, что все показатели максимальной ЭРГ между различными стадиями ДР не имели достоверных различий и только амплитудные показатели являются ДРзависимыми.
Данные локальной хроматической ЭРГ показали, что диабетическая ретинопатия любой стадии изменяет значение показателей в худшую сторону, отмечались достоверные межстепенные различия показателей ЭРГ.
Оценку гомеостаза проводили при помощи анализа содержания малых органических молекул и ионов в сыворотке крови и внутриглазной жидкости. В качестве контрольных значений рассматривались таковые у пациентов с СД без ДР. Наличие препролиферативной или непролиферативной стадий диабетической ретинопатии сочеталось с достоверно более высоким уровнем глюкозы в сыворотке крови. При этом отмечено значимое различие содержания глюкозы в крови в группе пациентов с ДР II против значения в группе больных с ДР I, и у пациентов с ДР II — против среднего группового показателя в группе пациентов с пролиферативной стадией (р1–2 = 0,009 и р2–3 = 0,047 соответственно).
Содержание мочевины в крови обследованных больных в зависимости от стадии ДР оказалось следующим. У пациентов контрольной группы было достоверно более низкое содержание мочевины по сравнению с таковым у пациентов с ДР I. У пациентов с ДР II и ДР III также обнаружено значимо более высокое содержание мочевины в крови, нежели у больных СД 2го типа без ДР. Не отличаясь от содержания мочевины у больных сахарным диабетом с ДР III, ее концентрация у пациентов с ДР II была достоверно ниже таковой у больных с ДР I. Такая картина согласуется с классическим представлением о механизмах развития осложнений СД, каковым и является ДР.
У больных сахарным диабетом с поражением сетчатки различной степени тяжести не обнаруживались изменения концентраций кальция и калия в сыворотке крови по сравнению с таковыми у пациентов, составивших контрольную группу. При анализе содержания натрия в сыворотке было выявлено достоверное его превышение у пациентов с непролиферативной и пролиферативной стадиями ДР (р < 0,05 в обоих случаях) по сравнению с показателями группы контроля. При этом средние групповые показатели у пациентов с ДР II и ДР III между собой значимых различий не имели.
Было изучено содержание указанных молекул и ионов во внутриглазной жидкости (ВГЖ) у обследованных пациентов в зависимости от степени ретинопатии. Показано, что уровень глюкозы и мочевины в группах больных сахарным диабетом с непролиферативной и препролиферативной стадиями превышает таковой в группе пациентов с сахарным диабетом без ретинопатии (контрольной).
Пациенты с ДР I и ДР II имели уровень глюкозы во внутриглазной жидкости, достоверно превышающий значения этого показателя у больных с ДР III, тогда как достоверной разницы с показателями группы контроля выявлено не было. Уровень мочевины в ВГЖ на фоне пролиферативной стадии не отличался от такового у пациентов с ДР I и ДР II, однако был значимо выше, чем этот показатель в группе контроля.
Полученные нами данные о содержании мочевины в ВГЖ, отражающие достоверно более высокие значения этого показателя у пациентов с ДР I, соответствуют представлению о метаболизме белков и косвенно дают понять, что даже при непролиферативной ДР белоксинтетические процессы повышаются в преддверии обязательного прогрессирования заболевания. Таким образом, повышение уровня мочевины в ВГЖ у пациентов с ДР I стадии можно рассматривать как ранний предиктор пролиферативных изменений на фоне клинической картины, далекой от ДР II и ДР III.
Уровень ионов (Ca2+, Na+, K+) у пациентов с непролиферативной ретинопатией не отличался от такового у больных СД без ретинопатии, однако содержание кальция и калия во внутриглазной жидкости больных с ДР I было достоверно ниже соответствующих значений у пациентов с ДР II. При этом не наблюдалось разницы показателей содержания кальция и калия у пациентов с ДР II и ДР III.
Уровень натрия во внутриглазной жидкости достоверно не отличался у пациентов с СД, осложненным ДР от такового у больных контрольной группы, однако наблюдалась слабая тенденция к понижению уровня Na+ во внутриглазной жидкости у больных с ДР в зависимости от ее стадии.
Обращает на себя внимание, что высокая прямая зависимость связывает уровень глюкозы в периферической крови и ВГЖ у пациентов с сахарным диабетом без развития диабетической ретинопатии (r = 0,78; р = 0,018). Анализ содержания прочих исследуемых ионов и молекул не выявил значимых корреляций, за исключением взаимосвязи содержания кальция в крови и ВГЖ, характеризовавшейся прямым направлением связи (r = 0,26; р = 0,048).
Как показал анализ биохимических маркеров пациентов с ДР II, прогрессирование ретинопатии сопровождалось уменьшением тесноты связи между содержанием глюкозы в крови и ВГЖ (r = 0,29; р = 0,031), а также изменением направления связи концентраций натрия в крови и ВГЖ (r = –0,21; р = 0,043). Слабая отрицательная зависимость (r = –0,22; р = 0,046) свидетельствовала о связи концентрации калия в крови и ВГЖ у пациентов с препролиферативной ДР. Не изменились теснота и направление корреляции содержания кальция в крови и ВГЖ (r = 0,25; р = 0,040) у пациентов с ДР II.
Следовательно, резонно было бы ожидать, что улучшение осмотического гомеостаза в тканях организма (как крови, так и других биологических жидкостей) будет сопровождаться повышением фотоэлектрической активности сетчатки, выражаемой хотя бы в повышении амплитудных характеристик ЭРГ. К сожалению, ограниченный объем выборки пациентов, у которых удалось провести анализ электролитного состава крови и ВГЖ, не позволил получить достоверной корреляции показателей ЭРГ и концентраций ионов, однако базовые данные о процессе формирования электрического импульса на фоторецепторах позволяют нам сделать такое допущение.
Анализ результатов панретинальной и щадящей (субпороговой) лазеркоагуляции при непролиферативной диабетической ретинопатии
Результатом терапевтических мероприятий стало улучшение показателей клинической картины, таких как снижение частоты выявления макулярного отека и тенденция к уменьшению площади центральной скотомы. У пациентов, пролеченных по методике щадящей лазеркоагуляции, после операции скотома не выявлялась, как и у больных, чьи показатели принимались за контрольные. Через 6 месяцев после лечения выявилась глубокая тенденция к росту площади центральной скотомы в группе пациентов с ДР I, перенесших стандартное лечение, а в группе пациентов, пролеченных по методике ЩЛК, частота выявления центральной скотомы оставалась нулевой и по истечении 6 месяцев после лечения.
Через 1 год в группах пациентов с ДР I, пролеченных с использованием различных методик лазеркоагуляции сетчатки, происходило ухудшение клинической картины: в обеих группах выявлялись единичные случаи макулярного отека, увеличение площади центральной скотомы. Средний групповой показатель последней был достоверно выше аналогичного в подгруппе пациентов, пролеченных с использованием панретинальной лазеркоагуляции. Вместе с тем выраженность признаков ухудшения клинической картины через 3 года у пациентов после ЩЛК была меньшей: площадь центральной скотомы у них была достоверно ниже исходных значений и значений в группе пациентов, перенесших ПРК (р = 0,042 и р = 0,045 соответственно).
Острота зрения сразу после проведенного лечения практически не изменилась у пациентов обеих групп, однако у всех больных, пролеченных по методике ЩЛК, незначительно повысилась. Через месяц показатели остроты зрения были стабильно высокими и не отличались от данных контрольной группы. Через 6 месяцев наметилась тенденция к снижению остроты зрения у пациентов после ПРК. Через год этот показатель ухудшился в обеих группах: острота зрения снизилась почти на 0,1.
После лазеркоагуляции у пациентов, пролеченных по стандартной методике, выявлено снижение суммарного поля зрения по сравнению с показателями пациентов без ДР. Наблюдение за пациентами с ДР І в течение месяца показало, что разные виды лазерной хирургии не дают значимо различающейся клинической картины у пациентов с ДР I через 1 месяц после проведенного лечения. Однако снижение величины суммарного поля зрения в группе пациентов, пролеченных с применением ЩЛК, шло несколько медленнее, чем в группе сравнения. Так, если по истечении месяца после лазеркоагуляции у пациентов первой группы не выявлено достоверной разницы в величине суммарного поля зрения, то у пациентов, пролеченных с применением классической технологии, разница в уменьшении этого показателя оказалась достоверной (456,1 ± 16,4 по окончании месяца наблюдения против 485,8 ± 18,6 после лазерного лечения непосредственно, р = 0,043).
Через 6 месяцев после лечения в клинических показателях обеих подгрупп пациентов с ДР I появились достоверные различия, касавшиеся величины суммарного поля зрения. В группе пациентов, перенесших ЩЛК, она отличалась от контрольных показателей, но находилась в пределах исходных значений, а в группе больных, перенесших лазеркоагуляцию по стандартной методике, этот показатель через 6 месяцев после операции был достоверно ниже исходных значений и имел больший уровень значимости различий с контрольными показателями.
Через год в обеих подгруппах отмечалось снижение числового значения суммарного поля зрения. Конечной точкой наблюдения отдаленных результатов лечения стал визит пациентов через 3 года после операции. Было выявлено, что в это время у пациентов обеих групп величина суммарного поля зрения была не только ниже контрольных значений этого показателя, но и значимо снизилась по отношению к величине суммарного поля зрения до операции.
На фоне описанных изменений мы наблюдали положительное влияние лечения на показатели ЭРГ пациентов с ДР I, при этом были выявлены различные результаты последних согласно данным ЭРГисследования у пациентов, пролеченных по различным методикам.
Исходные показатели ЭРГ у пациентов с ДР I отличались от таковых в контроле на высоком уровне значимости, но лечение не всегда приводило к восстановлению показателей ЭРГ на фоне непролиферативной ДР по сравнению с таковыми в группе без ДР. При достоверном улучшении таких показателей, как амплитуда, латентность, отношение b/а, в группах пациентов, пролеченных по различным методикам, только в первой группе удалось выявить достоверное улучшение показателей хроматической ЭРГ: повышение амплитуды в зеленом спектре, аналогичное показателям пациентов контрольной группы. Тип лечения влиял на показатели отношения волн (b/a) и цветовой амплитуды: ЩЛК приводила к более значимому повышению этих показателей ЭРГ.
Изучение показателей ЭРГ у пациентов по истечении 1 месяца после лазеркоагуляции позволило выявить более выраженный нормализующий эффект методики ЩЛК: достоверно выше, чем у пациентов, пролеченных по классической методике ПРК, оказались величины амплитудных показателей ЭРГ. Показатели амплитудных характеристик через полгода были достоверно выше таковых в исходный момент наблюдения, однако не происходило полной их нормализации, судя по достоверной разнице с показателями группы пациентов без ДР. Вместе с тем все амплитудные характеристики в подгруппе с ЩЛК были значимо выше таковых в подгруппе с ПРК.
Показатели ЭРГисследования пациентов с ДР I через год после операции сохранили структуру, выявленную через 6 месяцев после проведения лазеркоагуляции. Как и ранее, лечение с применением ЩЛК позволяло поддерживать на достоверно более высоком уровне показатели амплитудных характеристик, сохраняя отличие от контрольных значений. При этом выявленные достоверные различия амплитудных характеристик в зависимости от типа лазерного лечения сопровождались значимым отличием таковых в исходный момент наблюдения только в подгруппе с ЩЛК. Что касалось амплитудных характеристик ЭРГ через 3 года, то у пациентов группы после ПРК они были значимо ниже как исходного уровня, так и значений этих же показателей в группе пациентов, пролеченных с применением ЩЛК.
Таким образом, проанализировав полученные результаты лечения, мы пришли к заключению, что своевременное проведение лазеркоагуляции сетчатки при ДР является наиболее реальным способом длительного сохранения зрительных функций. Но поскольку после проведения вмешательства у всех пациентов отмечается некоторое снижение функций, особенно через длительный промежуток времени, основная задача состоит в том, чтобы минимизировать возможный ущерб от лазеркоагуляции. При щадящей (субпороговой) лазеркоагуляции сетчатки происходит воздействие на уровне пигментного эпителия сетчатки, тем самым в нем создаются «окна», то есть отверстия, пропускающие крупноразмерные молекулы, которые позволяют стабилизировать встречные потоки жидкостей в обменных процессах и выровнять давление внутри сосудов, нормализуя концентрационный баланс внутри клеток и в межклеточных жидкостях.
Оказывая малотравматичное тепловое воздействие на слои сетчатки, мы сохранили их функционирование на высоком уровне: более высокая острота зрения, почти не снизившаяся в течение 3 лет, более низкие темпы изменения суммарного поля зрения. Длительное время отсутствовал макулярный отек и к исходу срока наблюдения появился лишь у 2 пациентов с меньшей площадью центральной скотомы по сравнению с исходным уровнем. Медленнее происходило незначительное ухудшение электрического фосфена сетчатки. Состояние электрической активности сетчатки у пациентов, перенесших ЩЛК, было более стабильное и сопоставимое с аналогичными показателями контрольной группы.
Анализ результатов комбинированной терапии при препролиферативной диабетической ретинопатии
После проведенного лечения в подгруппах были выявлены достоверные различия в показателях остроты зрения, среднего группового показателя площади центральной скотомы и величин суммарного поля зрения. В подгруппе комбинированной терапии суммарное поле зрения и острота зрения были значимо выше, а площадь центральной скотомы — достоверно ниже, чем в подгруппе ПРК. Комбинированная терапия приводила к более выраженному отличию показателей клинической картины от исходного уровня, чем ПРК, при этом различия показателей с контрольными значениями были выявлены во всех группах пациентов с ДР II.
Выявленные особенности клинической картины в зависимости от типа лечения сохранялись и по истечении 1 месяца с момента проведения терапии. У пациентов с ДР II, прошедших комбинированное лечение, сохранялась меньшая площадь центральной скотомы, более высокие групповые значения остроты зрения и суммарного поля зрения. Прочие клинические данные не показали значимых отличий как от контроля, так и от исходных значений, возможно, в силу высокого разброса данных, обусловленных индивидуальными особенностями пациентов. Через 6 месяцев наблюдаемая ранее тенденция к снижению частоты выявления макулярного отека проявилась достоверным снижением последней у пациентов, перенесших комбинированное лечение, по сравнению с показателем в группе больных, пролеченных с применением ПРК. Также достоверно более высокими оказались острота зрения и суммарное поле зрения у пациентов из группы комбинированного лечения. Более того, у пациентов, перенесших ПРК, суммарное поле зрения через 6 месяцев после операции оказалось не только достоверно ниже контрольных, но и ниже исходных значений этого показателя. Через год после проведенного лечения сохранилась тенденция к снижению после комбинированной терапии площади центральной скотомы по сравнению с аналогичными показателями у пациентов группы ПРК, а также достоверно более низкой частоты выявления макулярного отека и значимо более высокого суммарного поля зрения в случае комбинированного лечения. Следует отметить, что через 1 год после проведенного лечения суммарное поле зрения в группе ПРК было достоверно ниже значений исходного уровня, во второй подгруппе этот показатель достиг исходных значений.
Через 3 года после проведенного лечения острота зрения у пациентов с ДР II независимо от вида лечения снизилась и достигла контрольных значений. Вместе с тем в группе комбинированного лечения сохранялась достоверно более низкая как по сравнению с исходными значениями, так и по сравнению с показателями пациентов из подгруппы ПРК, частота выявления макулярного отека, также значимо более низкой оказалась среднегрупповая площадь центральной скотомы.
Несмотря на то, что суммарное поле зрения в обеих подгруппах через 3 года после операции значимо снизилось по отношению к исходным показателям, в подгруппе с комбинированным лечением этот показатель клинической картины через 3 года после операции превышал таковой в подгруппе ПРК: 421,0 ± ± 26,4 против 336,2 ± 28,1; р = 0,035.
Анализ результатов ЭРГисследования показал, что комбинированная терапия приводит к выраженному их улучшению. Амплитудные характеристики у пациентов, прошедших лечение по комбинированной схеме, были выше, а латентность, напротив, ниже, чем у пациентов с ДР II, пролеченных с применением только ПРК. Несмотря на отсутствие полной нормализации показателей ЭРГ у пациентов с ДР II после вмешательства, только комбинированное лечение приводило к достоверному улучшению результатов ЭРГ по отношению к исходному уровню.
Показатели электроретинограмм, рассмотренные через 1 месяц после вмешательства, позволили сделать заключение, что по истечении этого срока у пациентов с ДР II обеих сформированных подгрупп показатели амплитудных характеристик значимо отличаются от контрольных. При этом, несмотря на отсутствие полной нормализации показателей ЭРГ через месяц после лечения, результаты ЭРГисследования пациентов с ДР II оказались ближе к контрольным, судя по достоверно более высоким амплитудным характеристикам и более низким значениям латентности по отношению к показателям ЭРГ у пациентов, перенесших только ПРК.
Через 6 месяцев после лечения при анализе данных ЭРГ пациентов с ДР II отмечали, что амплитудные характеристики у пациентов, перенесших комбинированную терапию, оказались значимо выше исходных и достоверно выше таковых у пациентов, перенесших только ПРК. Показатели латентности в красном и зеленом спектрах по истечении 6 месяцев с момента операции достигли исходного уровня в обеих подгруппах, независимо от типа лечения. Суммарная же латентность в группе с ЩЛК и полиосмом была ниже исходной и выше таковой в группе ПРК (р < 0,05 в обоих случаях).
Через 1 год после операции в подгруппе комбинированного лечения амплитудные значения сохранились на достоверно более высоком уровне по сравнению со значениями аналогичных показателей подгруппы ПРК как суммарно, так и в различных спектрах (красном и зеленом). При этом если в группе ПРК эти показатели достигли исходного уровня через 1 год после операции, то в подгруппе комбинированной терапии они продолжали оставаться на достоверно более высоком уровне.
Показатели латентности достигли исходного уровня в обеих подгруппах независимо от вида лечебных мероприятий через 1 год после проведенного лечения.
Через 3 года после операции у пациентов с ДР II сохранялась общая картина показателей ЭРГ, выявленная через 1 год после операции. Показатели латентности в обеих подгруппах достигли исходных значений и между собой не различались. Амплитудные же характеристики ЭРГ пациентов, перенесших комбинированное лечение с применением препарата полиосм, оставались достоверно более высокими как по отношению к исходному уровню, так и по отношению к показателям пациентов из группы ПРК.
Таким образом, улучшение осмотического гомеостаза при ДР II, обеспечивающегося сочетанием ЩЛК с предварительным применением полиосма, сопровождается более длительным позитивным изменением фотоэлектрической активности сетчатки с сохранением зрительных функций.
Анализ результатов комбинированной терапии при пролиферативной диабетической ретинопатии
После оперативного лечения в группе пациентов с ДР III, которым было проведено комбинированное лечение, наблюдалось уменьшение частоты выявления макулярного отека и площади центральной скотомы как по отношению к исходному уровню, так и к показателям группы сравнения. В остальных показателях клинической картины не обнаружено достоверных различий в зависимости от вида проведенного лечения.
По истечении одного месяца после лечения была проведена оценка показателей состояния органа зрения у пациентов с ДР III в зависимости от типа лечения. Наметилась тенденция повышения остроты зрения в группе пациентов, перенесших комбинированное лечение, по отношению к аналогичному показателю в группе ПРК. Выявлено достоверно более высокое значение этого показателя после комбинированного лечения по отношению к исходному уровню. В этой же группе сохранилась значимо более низкая частота выявления макулярного отека и более низкая величина площади центральной скотомы как по сравнению с исходными значениями, так и по сравнению с показателями пациентов, перенесших только ПРК.
Через 6 месяцев после операции у пациентов с ДР сохранялись признаки клинической картины, выявленной при их обследовании через 1 месяц после операции. Так, острота зрения у пациентов в группе комбинированного лечения оставалась достоверно выше исходного уровня, чего не наблюдалось в группе пациентов, перенесших ПРК. Межгрупповые различия в зависимости от типа лечения носили характер флуктуаций, позволяющий говорить о тенденции повышения остроты зрения у пациентов после комбинированного лечения. На наш взгляд, это могло быть обусловлено большим разбросом индивидуальных показателей внутри подгрупп, различающихся по виду лечебного воздействия. Попрежнему обнаруживались достоверные различия в частоте выявления макулярного отека и величине площади центральной скотомы, показывающие, что состояние сетчатки после комбинированного лечения можно оценить как лучшее, нежели таковое после панретинальной лазеркоагуляции.
Оперативное лечение, дополненное осмотерапией, через 1 год позволило наблюдать сохранение остроты зрения пациентов с ДР III на более высоком уровне не только по отношению к исходным показателям, но по сравнению с аналогичным показателем в группе пациентов, которым была проведена только ПРК: 0,06 ± 0,01 против 0,03 ± 0,01; р = 0,035. Сохранялись межгрупповые различия в зависимости от типа лечения в отношении частоты выявления макулярного отека и величины площади центральной скотомы: оба показателя были достоверно ниже после комбинированного лечения.
Обследование пациентов через 3 года после операции выявило сглаживание достоверных различий в части оценки остроты зрения: в обеих подгруппах она снизилась до исходных значений. Частота выявления макулярного отека, величина площади центральной скотомы, а также величина среднего группового показателя суммарного поля зрения были достоверно выше исходных только в группе пациентов, которым было проведено комбинированное лечение. Кроме того, комбинированное лечение позволило отметить более низкие цифры частоты выявления макулярного отека и величины площади центральной скотомы при сравнении с аналогичными показателями подгруппы пациентов, перенесших ПРК.
Показатели ЭРГ пациентов с ДР III после оперативного лечения сохраняли значимые отличия от контрольных значений, вместе с тем отмечалась разница при сравнении показателей ЭРГ с исходным уровнем в зависимости от типа лечения. Она касалась отношения амплитудных характеристик а и bволн, а также показателей амплитуды в различных зонах цветового спектра: красном и зеленом. Следует отметить, что выявленные различия указывали на лучшее состояние показателей ЭРГ, а следовательно, и функциональной активности сетчатки после комбинированного лечения, нежели после ПРК, при том что оба вида лечения приводили к улучшению показателей ЭРГ по отношению к исходным значениям.
Изучение данных ЭРГисследования позволило сделать вывод, что через 1 месяц после операции функциональная активность сетчатки у пациентов, перенесших комбинированное лечение, отличается от исходного уровня в сторону улучшения значений амплитудных характеристик и латентности, а также остается выше, чем в группе пациентов, перенесших ПРК, показателей амплитуды красной и зеленой частей спектра и латентности в красной части спектра. При этом значения показателей ЭРГ обеих подгрупп, перенесших оперативное лечение, достоверно хуже, чем показатели этих диагностических тестов у пациентов без ДР.
Через 6 месяцев после операции амплитудные характеристики показателей ЭРГ у пациентов с ДР III оставались достоверно более высокими по сравнению с показателями до операции, что не всегда удавалось наблюдать у пациентов, перенесших ПРК. Сравнение показателей ЭРГ в зависимости от типа лечения показало, что комбинированная терапия позволяет через 6 месяцев после операции поддерживать более высокие значения всех амплитудных характеристик, чем лечение с использованием только ПРК. В области значений латентности межгрупповых различий в зависимости от типа лечения через 6 месяцев после операции у пациентов с ДР III не было выявлено.
Через 1 год после оперативного лечения показатели большинства амплитудных характеристик ЭРГ пациентов, которым было проведено комбинированное лечение, оставались достоверно выше, чем у пациентов, перенесших только ПРК. При этом только в группе комбинированного лечения показатели всех амплитудных характеристик сохранялись на достоверно более высоком уровне по сравнению с показателями до оперативного лечения. Показатели латентности ЭРГ пациентов с ДР III через год после операции достоверно отличались от показателей пациентов без ДР, но межгрупповых различий, как и различий по отношению к исходным показателям через 1 год после операции, выявлено не было. Картина ЭРГ, аналогичная выявленной через 1 год после операции, сохранялась и через 3 года: показатели амплитудных характеристик после комбинированного лечения были достоверно выше исходных значений и также значимо выше показателей пациентов, перенесших только ПРК. Показатели латентности достоверно не отличались от исходных в обеих подгруппах прооперированных пациентов и не обнаруживали межгрупповых различий в зависимости от типа лечения.
Проанализировав полученные результаты, мы пришли к заключению, что своевременное проведение комбинированного лечения при ДР III, включающего закрытую витрэктомию в полном объеме, стабилизацию осмотического гомеостаза посредством применения диуретика нового поколения и щадящей (субпороговой) лазеркоагуляции сетчатки, сопровождается более длительным позитивным изменением фотоэлектрической активности сетчатки с сохранением зрительных функций.
Выводы
1. Изменение калибра сосудистого русла сетчатки, в частности расширение вен и сужение артерий I и II порядка, а также увеличение количества микроаневризм и петехиальных кровоизлияний, является предиктором развития различных стадий диабетической ретинопатии. Изменение ионного состава крови коррелирует с изменением осмотического гомеостаза и является одним из диагностических критериев развития диабетической ретинопатии.
2. Тепловое воздействие применяемых параметров лазерного излучения в ходе проведения щадящей (субпороговой) лазеркоагуляции сетчатки при диабетической ретинопатии является безопасным для всех структур сетчатки в любой стадии диабетической ретинопатии. Классическая панретинальная лазеркоагуляция — это травматичная процедура, повреждающая все слои сетчатки и приводящая к сужению полей зрения, снижению электрической активности сетчатки, ухудшению качества жизни пациента.
3. Щадящая (субпороговая) лазеркоагуляция сетчатки при ДР I и в составе комбинированного лечения ДР II и ДР III является высокоэффективным методом длительного сохранения зрительных функций.
1. Астахов Ю.С., Лисочкина А.Б., Шадричев Ф.Е. Современные направления медикаментозного лечения непролиферативной диабетической ретинопатии (обзор данных литературы) // Клин. офтальмология. — 2003. — Т. 4, № 3. — С. 519.
2. Балаболкин М.И., Клебанова Е.М. Роль окислительного стресса в патогенезе сосудистых осложнений сахарного диабета // Терапевт. архив. — 2000. — Т. 73, № 4. — С. 38.
3. Балаболкин М.И., Никишова М.С., Волковой А.К., Недосугова Л.В. Применение антиоксидантов из группы флавоноидов в лечении диабетической ретинопатии при сахарном диабете 2го типа // Проблемы эндокринологии. — 2002. — № 2. — С. 49.
4. Миленькая Т.М., Бессмертная Е.Г., Александрова В.К., Ищенко И.М. Диабетическая ретинопатия и антиоксиданты // Сахарный диабет. — 2003. — № 2. — С. 3034.
5. Мошетова Л.К., Аржиматова Г.Ш., Строков И.А., Яровая Г.А. Современная антиоксидантная терапия диабетической ретинопатии // Клиническая офтальмология. — 2006. — Т. 7, № 1.
6. Клиническая диабетология / Ефимов А.С., Скробонская Н.А. — Киев: Здоровье, 1998. — С. 8594.

/77/77.jpg)