Журнал «Здоровье ребенка» 7 (42) 2012
Вернуться к номеру
Результаты терапии атопического дерматита у детей с использованием препарата левоцетиризина гидрохлорид
Авторы: Аряев Н.Л., Горностаева Н.Ю., Шевченко И.М., Поплавская Л.Л., Одесский национальный медицинский университет
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
В статье дана характеристика препарата L-цет — представителя ІІІ поколения антигистаминных препаратов, содержащего левовращающий изомер цетиризина. Приведены результаты лечения детей с атопическим дерматитом с использованием препарата L-цет, свидетельствующие о его высокой эффективности и безопасности.
У статті надано характеристику препарату L-цет — представника ІІІ покоління антигістамінних препаратів, що містить лівообертаючий ізомер цетиризину. Наведені результати лікування дітей з атопічним дерматитом із використанням препарату L-цет, що свідчать про його високу ефективність та безпеку.
The article provides a description of L-cet — кepresentative third-generation antihistamines containing levorotatory isomer of cetirizine. Outcomes of treatment of children with atopic dermatitis using L-cet showing its high efficiency and safety are given.
атопический дерматит, L-цет.
атопічний дерматит, L-цет.
atopic dermatitis, L-cet.
Введение
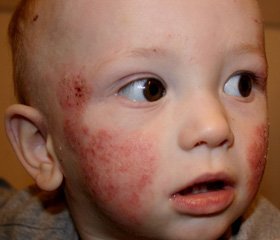
Атопический дерматит (АД) представляет собой хронический рецидивирующий дерматит, характеризующийся интенсивным зудом и возникающий преимущественно в детском возрасте [1–3, 8, 9, 12]. Патогенетической основой клинических проявлений АД является хроническое воспаление кожи, обусловленное воздействием на сенсибилизированный организм ребенка различных аллергенов [1, 3, 6, 8–10, 12]. АД у детей имеет определенные признаки, но описать его клиническую картину достаточно сложно. Это связано, во-первых, с возможностью различной локализации поражения кожи (конечности, туловище, шея, лицо, генерализованные формы). Во-вторых, морфология элементов может соответствовать острому, подострому или хроническому воспалительному процессу. В-третьих, клинические проявления в значительной степени связаны с течением и фазой заболевания, то есть зависят от того, имеют ли место отдельные эпизоды или заболевание носит постоянно рецидивирующее течение. В-четвертых, клинические проявления АД зависят от возраста больных. Задача постановки диагноза усложняется и тем, что для АД отсутствуют специфические биохимические или иммунологические маркеры [2, 4–8, 10, 14].
Атопический дерматит занимает доминирующее место в структуре кожной патологии детского возраста (от 20 до 50 % больных дерматозами детей), что определяет интерес педиатров и семейных врачей к вопросам повышения эффективности терапии данного заболевания [2, 13].
Современная терапия АД является этиопатогенетической и должна воздействовать на механизмы формирования аллергического воспаления [2–4, 6–8, 10, 12]. В соответствии с современными протоколами ведения детей с АД комплексная терапия включает: мероприятия по устранению воздействия аллергена (элиминационную диету и изменения аллергенного окружения), наружную терапию, системную терапию и устранение неспецифических триггерных факторов [1–4, 6–8, 10, 12, 14].
Системная терапия АД у детей включает препараты противовоспалительного действия, обладающие способностью ограничивать высвобождение и синтез медиаторов аллергического воспаления, а также блокировать их эффекты [2, 4]. Доказана высокая эффективность антигистаминных препаратов (АГП) (блокаторов Н1-гистаминовых рецепторов), которые уменьшают связывание гистамина с гистаминовыми рецепторами клеток-мишеней аллергической реакции, что снижает выраженность симптомов, обусловленных гистамином (отек, гиперемия, зуд) [1, 2, 4–8, 10, 12].
Из-за наличия седативного эффекта, низкой биодоступности (40 %), блокады рецепторов других медиаторов (например, М-холинорецепторов, что проявляется в виде сухости слизистых, расстройства мочеиспускания, ухудшения зрения), тахифилаксии (снижение терапевтического действия при длительном применении) использование АГП І поколения у детей ограничено [2, 4]. Седативный эффект, создаваемый АГП І поколения, оказывает положительное воздействие только на детей с нарушением сна, гипервозбудимых детей.
АГП II поколения тормозят развитие как ранней, так и поздней фазы аллергического воспаления, что, вероятно, обусловливает их превентивное действие. Максимальная интенсивность блокирования поздней стадии аллергического воспаления развивается в течение месяца с начала их регулярного применения. Необходимость назначения препаратов на длительное время, возможность развития побочных эффектов действия АГП II поколения в виде удлинения интервала QT и риска развития сердечной аритмии ограничивают их использование в педиатрической практике [1, 2, 4–8, 10, 11].
Существенный прогресс в терапии АД у детей связан с АГП III поколения, которые представляют собой активные метаболиты или левовращающие изомеры препаратов II поколения, обладающие выраженным клиническим эффектом, но лишенные побочных свойств АГП II поколения [2, 4–8, 10, 12]. Одним из препаратов III поколения АГП является L-цет (левоцетиризина гидрохлорид) — блокатор H1-гистаминовых рецепторов, в Украине зарегистрированный компанией «Кусум Хелтхкер ПВТ. ЛТД». Препарат содержит левовращающий изомер цетиризина, превосходящий цетиризин по эффективности (5 мг препарата L-цет эквивалентны 10 мг цетиризина по антигистаминной активности), продолжительности действия, по сродству (аффинности) к Н1-гистаминовым рецепторам (имеет вдвое большую аффинность к Н1-рецепторам, чем цетиризин). Левоцетиризина гидрохлорид не метаболизируется в организме, что снижает риск побочных действий и лекарственных взаимодействий [4–7, 9, 13, 14].
Целью исследования явилось изучение эффективности и безопасности препарата L-цет (левоцетиризина гидрохлорид) в комплексной терапии АД у детей.
Материалы и методы исследования
Проведено двухцентровое сравнительное контролируемое исследование в параллельных группах, отобранных методом стратифицированной рандомизации по нозоформам среди 26 детей с АД, которые находились на стационарном лечении в базовом лечебном учреждении кафедры педиатрии № 1, неонатологии и биоэтики Одесского национального медицинского университета — Одесской областной детской клинической больнице. Протокол исследования был одобрен региональным комитетом по биоэтике при ОНМедУ. Родители включенных в исследование детей получили устную информацию обо всех процедурах исследования и дали письменное информированное согласие на участие в исследовании.
Критерии включения:
— возраст от 2 до 8 лет;
— АД различной степени тяжести;
— информированное согласие на участие пациента в исследовании.
Критерии исключения:
— дети в возрасте до 2 лет и старше 8 лет;
— гиперчувствительность к препарату в анамнезе;
— прием других противоаллергических препаратов;
— отказ выполнять основные процедуры исследования и соблюдать режим приема препарата, подписать информированное согласие.
Диагноз верифицировался на основании анализа анамнестических данных, результатов клинического обследования: наличие сухости и зуда кожи, наличие распространенного отека и покраснения кожи, появление красных пятен с нечеткими границами и бляшек; в местах расчесывания на коже имеются эрозии, сопровождающиеся мокнутием, наличием гнойничков. Всем больным проводились клинические исследования крови и мочи, биохимические исследования (общий билирубин и его фракции, АСТ, АЛТ, щелочная фосфатаза, тимоловая проба, общий белок, протеинограмма), определяется уровень IgE. Для оценки тяжести кожных аллергических реакций применялась система балльной оценки степени тяжести атопического дерматита — SCORAD (SCORing of Atopic Dermatitis).
Все дети получали комплексное лечение, включавшее элиминационную диету, наружную терапию и системную терапию антигистаминными препаратами.
Среди исследуемых было 14 девочек и 12 мальчиков. По возрасту наблюдаемые нами дети распределились следующим образом: от 2 до 6 лет — 16 детей, от 5 до 8 лет — 10 детей.
По результатам стратифицированной рандомизации пациенты были разделены на 2 группы: основную (14 детей) и контрольную (12 детей).
14 пациентов основной группы в качестве АГП получали препарат левоцетиризина гидрохлорид (L-цет) для перорального приема в следующих дозировках: дети от 2 до 6 лет — 2,5 мг (2,5 мл сиропа 2 раза в день), дети от 6 до 8 лет — 10 мг (10 мл сиропа 2 раза в день). Длительность лечения препаратом L-цет составляла 8–10 дней.
12 пациентов контрольной группы получали АГП других групп (АГП I или II поколения) в возрастных дозировках.
Значимых клинических, возрастных и половых различий между группами не было. Длительность наблюдения составила 10 дней.
Эффективность лечебного действия препарата оценивали по динамике кожного синдрома, зуда, динамике параклинических показателей (общего анализа крови, уровня IgE), а также по положительной динамике шкалы SCORAD.
Основные симптомы оценивались по выраженности в баллах от 0 до 3 с применением аналоговой шкалы, в соответствии с которой 0 баллов — симптомов нет, 1 балл — симптом слабо выражен, 2 балла — симптом умеренно выражен, 3 балла — симптом резко выражен. Оценка проводилась до начала лечения, на 3, 7 и 10-й дни терапии. После окончания исследования производили субъективную оценку клинического эффекта препарата по шкале: эффективный, малоэффективный, неэффективный. Безопасность и переносимость препарата оценивались по наличию или отсутствию ожидаемых побочных действий, включая случаи индивидуальной непереносимости.
Статистический анализ полученных данных осуществлялся с использованием пакетов Statistica 7.0 и Microsoft Excel 2003 с интеграцией программы анализа данных Atte Stat 13.1, интернет-калькулятора SISA (Simple Interactive Statistical Analysis).
Результаты и их обсуждение
Анализ наблюдений показал, что у всех больных (100 %) в клиническом статусе до начала терапии ведущими симптомами были покраснение, сухость и зуд кожи. У 21 ребенка (80,76 %, 95% доверительный интервал (ДИ) 65,92–96,07) было отмечено наличие распространенного отека на фоне покраснения кожи. У 18 детей (69,23 %, 95% ДИ 51,22–86,77) на коже были многочисленные красные пятна с нечеткими границами и следами расчесывания, в местах расчесывания на коже имелись эрозии, которые сопровождались мокнутием, наличием гнойничков.
Снижение аппетита наблюдалось у 24 детей (92,3 %, 95% ДИ 81,57–102,42). У 5 пациентов (19,23 %, 95% ДИ 4,06–34,33) имелась гипертермия выше 38 °С.
У всех больных (100 %) в общем анализе крови была отмечена эозинофилия выше 10 %.
Уровень IgE превышал возрастную норму у 16 детей (61,53 %, 95% ДИ 42,82–80,23).
У детей основной группы, которые принимали препарат L-цет (левоцетиризина гидрохлорид), характер изменений на коже начал меняться к концу третьих суток от начала лечения: уменьшились зуд, сухость, покраснение кожи, дети стали более спокойными, улучшился аппетит. У 12 пациентов (46,15 %, 95% ДИ 26,84–65,15) к седьмому дню от начала приема препарата левоцетиризина гидрохлорид клинические проявления АД отсутствовали. На десятый день от начала приема препарата левоцетиризина гидрохлорид у 22 пациентов (84,61 %, 95% ДИ 71,27–98,72) констатирована клиническая ремиссия. У детей контрольной группы, которые получали другие АГП, динамика кожного синдрома была менее выражена (рис. 1).
/43/43.jpg)
У всех пациентов основной группы прием препарата левоцетиризина гидрохлорид способствовал более быстрому регрессу интоксикации с нормализацией температуры на 2–3-й день от начала лечения, восстановлением аппетита на 5–6-й день от начала лечения, улучшением самочувствия (рис. 2).
У детей основной группы, принимавших препарат L-цет (левоцетиризина гидрохлорид), отмечена более быстрая нормализация показателей общего анализа крови (на седьмой день от начала лечения) (рис. 3).
/43/43_2.jpg)
Эффективность препарата L-цет (левоцетиризина гидрохлорид) расценена как высокая у 24 пациентов (92,3 %, 95% ДИ 81,57–102,42), как умеренная — у 2 детей (7,7 %, 95% ДИ 2,42–18,42). Пациентами отмечены хорошие органолептические свойства препарата L-цет. У детей основной группы, принимавших препарат L-цет, отмечена более выраженная положительная динамика шкалы SCORAD (табл. 1).
В ходе мониторинга нежелательных явлений побочного действия препарата в виде случаев индивидуальной непереносимости зафиксировано не было. Препарат L-цет (левоцетиризина гидрохлорид) хорошо переносился детьми, отказов детей от приема препарата не было.
Выводы
1. Прием препарата L-цет (левоцетиризина гидрохлорид) способствует выраженной положительной динамике клинических проявлений атопического дерматита различной степени тяжести у детей за счет купирования кожного синдрома.
2. Формирование приверженности к терапии обеспечивается удобной формой выпуска, хорошими органолептическими свойствами, что позволяет уменьшить психотравмирующее воздействие на ребенка.
3. Препарат L-цет (левоцетиризина гидрохлорид) отличается хорошей индивидуальной переносимостью, отсутствием побочных реакций.
4. Антигистаминный препарат III поколения L-цет (левоцетиризина гидрохлорид) является эффективным и безопасным средством патогенетической терапии атопического дерматита у детей на стационарном и амбулаторном этапах лечения.
1. Аряев Н.Л., Кукушкин В.Н. Современная концепция ведения детей с атопическим дерматитом // Одеський медичний журнал. — 2008. — № 6 (110). — С. 3-35.
2. Аряев Н.Л., Кукушкин В.Н., Циунчик Ю.Г. Клиническое значение пребиотиков в терапии атопического дерматита у детей // Одеський медичний журнал. — 2008. — № 2 (106). — С. 23-26.
3. Аряев Н.Л., Клименко В.И., Феклин В.А., Кожемяка А.И. Атопический дерматит в практике педиатра: — К.: Ферзь, 2007.
4. Beltrani V.S. Clinical features of atopic dermatitis // Imm. and Allergy Clinics of North America. — 2002. — Vol. 22, № 1.
5. Балаболкин И.И., Гребенюк В.Н. АД у детей. — М., 1999. — 240 с.
6. Illing S., Spranger St. (Hrsg.) // Padiatrie. Jungjohan Verlaggesell schaft. — Stuttgart, 1993. — S. 442-449.
7. Фризин Д.В., Бастракова Т.А., Фризин В.В. Цетиризин в лечении детей с атопическим дерматитом (http://www.dermatology.ru/collections/tsetirizin-v-lechenii-detei-s-atopicheskim-dermatitom).
8. Singh-Franco D., Ghin H., Robles G. et al. Levocetirizine for the treatment of allergic rhinitis and chronic idiopathic urticaria in adults and children // Clin. Ther. — 2009. — Vol. 31. — P. 1664–1687.
9. Levocetirizine. Drug Facts and Comparisons 4.0 // Efacts [online]. — 2010. — Available from Wolters Kluwer Health, Inc. (accessed 4/19/10).
10. Buck L. Cetirizine and Levocetirizine Use in Children // Pediatr. Pharm. — 2010. — Vol. 16. — P. 225-234.
11. Lee C., Sun J., Lu K. et al. The comparison of cetirizine, levocetirizine and placebo for the treatment of childhood perennial allergic rhinitis // Pediatr. Allergy Immunol. — 2009. — Vol. 20. — P. 493-499.
12. Potter P. Pediatric Levocetirizine Study Group. Efficacy and safety of levocetirizine on symptoms and health-related quality of life of children with perennial allergic rhinitis: a double-blind, placebo-controlled randomized clinical trial // Ann. Allergy, Asthma and Immunolog. — 2005. — Vol. 95. — P. 175-180.
13. Warner J. A double-blinded, randomized, placebo-controlled trial of cetirizine in preventing the onset of asthma in children with atopic dermatitis: 18 months treatment and 18 months posttreatment follow-up // J. Allergy Clin. Immunol. — 2001. — Vol. 108. — P. 929-937.
14. Fadia M., Arifhodzic N., Al-Awadh R., Heines D. Intrecellular cytokine production in children with atopic dermatitis: effect of levocetirizine treatment // Pediatrijadanas. — 2009. — Vol. 5. — P. 161-171.

/44/44.jpg)