Журнал «Медицина неотложных состояний» 1 (64) 2015
Вернуться к номеру
Використання пролонгованої епідуральної інфузії бупівакаїну для зменшення проявів інтраабдомінальної гіпертензії, покращення кровотоку в магістральних судинах черевної порожнини та адекватного знеболювання в ранньому післяопераційному періоді в дітей з онкопатологією
Авторы: Дмитрієв Д.В. — Вінницький національний медичний університет ім. М.І. Пирогова
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Дослідження проведено у 32 дітей, прооперованих із приводу пухлин черевної порожнини. Залежно від методики знеболювання пацієнти були поділені на 2 групи: у 1-й групі використовували епідуральну анальгезію (ЕА) та безперервну внутрішньовенну інфузію фентанілу; у 2-й групі призначали лише внутрішньовенну безперервну інфузію фентанілу. Застосування багатокомпонентної анальгезії (ЕА та безперервна внутрішньовенна інфузія опіоїдних анальгетиків) значно зменшує негативні наслідки недостатнього знеболювання в дітей та сприяє ефективній анальгезії після травматичних операцій, зменшує прояви синдрому інтраабдомінальної гіпертензії та покращує кровотік у судинах черевної порожнини.
Исследование проводилось у 32 детей, прооперированных по поводу опухолей брюшной полости. В зависимости от методики обезболивания пациенты были разделены на 2 группы: в 1-й группе использовали эпидуральную анальгезию (ЭА) и непрерывную внутривенную инфузию фентанила; во 2-й группе назначали только внутривенную непрерывную инфузию фентанила. Применение многокомпонентной анальгезии (ЭА и непрерывная внутривенная инфузия опиоидных анальгетиков) значительно уменьшает негативные последствия недостаточного обезболивания у детей и способствует эффективной анальгезии после травматичных операций, уменьшает проявления синдрома интраабдоминальной гипертензии и улучшает кровоток в сосудах брюшной полости.
The study was conducted in 32 children, who were operated for tumors of the abdominal cavity. Depending on the method of anesthesia, patients were divided into 2 groups: in the first group epidural anesthesia (EA) with continuous intravenous infusion of fentanyl were used; in the second group we used only continuous intravenous infusion of fentanyl. Multidimensional analgesia (EA and continuous intravenous infusion of opioid analgesics) significantly reduces the negative effects of inadequate analgesia in children and promotes effective analgesia after traumatic operations, minimizes the signs of intraabdominal hypertension syndrome and improves blood flow in the vessels of the abdomen.
анальгезія, інтраабдомінальна гіпертензія, індекс резистентності.
анальгезия, интраабдоминальная гипертензия, индекс резистентности.
analgesia, intraabdominal hypertension, resistance index.
Статья опубликована на с. 73-77
Вступ
Серед основних причин неадекватної анальгезії в післяопераційному періоді в дітей виділяють відсутність загальновизнаних і простих методів оцінки тяжкості больового синдрому в педіатрії; використання наркотичних анальгетиків рідко і в дозі, меншій від необхідної, для уникнення побічної дії; неможливість або обмеження використання ефективних сучасних методів післяопераційної анальгезії та переконання частини лікарів, що такі діти є менш чутливими до болю [1–3]. У структурі післяопераційного знеболювання в дітей, як і в інших вікових групах, основне місце займають наркотичні анальгетики, шлях введення традиційний — внутрішньом’язовий [4].
На думку багатьох авторитетних дослідників, неадекватна та неефективна анальгезія в ранній післяопераційний період наявна у 30–50 % хворих, при цьому найближчий післянаркозний період розглядається як слабка ланка анестезіологічного забезпечення [1, 2]. Неадекватна анальгезія в ранній післяопераційний період погіршує перебіг і прогноз одужання в дітей та збільшує смертність за рахунок підвищення ризику розвитку сепсису, післяопераційних ускладнень — розвитку синдрому інтраабдомінальної гіпертензії та порушення кровообігу в магістральних судинах черевної порожнини [4–10].
Незважаючи на великий перелік опіоїдних та неопіоїдних анальгетиків, епідуральна аналгезія (ЕА) є найбільш оптимальним та ефективним методом післяопераційного знеболювання.
Метод подовженої епідуральної анестезії та анальгезії частіше почав застосовуватися при проведенні оперативних втручань і для подальшого знеболювання хворих. Подовжена епідуральна анестезія дозволяє значно зменшити кількість препаратів, що вводяться як під час наркозу, так і в ранній післяопераційний період, що дуже важливо, враховуючи супутню патологію у хворих старшого віку і поєднання хірургічного втручання із застосуванням поліхіміотерапії [1–4].
Подовжена епідуральна анестезія дозволяє відмовитися від введення опіоїдних анальгетиків, а також значно прискорити процес відновлення перистальтики кишечника і початок раннього ентерального харчування, знизити частоту виникнення ускладнень, пов’язаних з оперативним втручанням [4, 6].
Метою цього дослідження було порівняння ефективності та безпеки застосування епідуральної анестезії з анальгезією опіоїдними анальгетиками на основі вивчення інтраабдомінального тиску та змін кровотоку в судинах черевної порожнини при оперативних втручаннях із приводу пухлин черевної порожнини в дітей.
Об’єкт та методи дослідження
Дослідження проведені у 32 дітей (12,6 ± 3,0 року), прооперованих із приводу пухлин заочеревинного простору (24 дитини, 75 %), пухлин яєчника (8 дітей, 25 %). Усім хворим проводили комплексне інтенсивне лікування: інфузійну та трансфузійну терапію, респіраторну підтримку апаратом Hamillton C2 — режим ASV за параметрами (FiO2, 30 %, PEEP 2 см вод.ст., PIP 15–20 см вод.ст.), антибактеріальне лікування, посиндромну терапію.
Оцінку ефективності знеболювання в ранньому післяопераційному періоді проводили за допомогою візуально-аналогової шкали (ВАШ, Observation Scale for Infants and Small Children), вивчали такі показники: внутрішньочеревний тиск (ВЧТ) методом Крона [6–8], абдомінальний перфузійний тиск (АПТ), рівень кортизолу в крові, клініку післяопераційного знеболювання. Додатково проводили допплерометрію мезентеріального кровотоку у верхній мезентеріальній артерії, нирковій та селезінковій артерії. Дослідження проводили без попередньої підготовки хворого за допомогою апарата LOGIQ BOOK-XP із використанням конвексного датчика 3,5–5,0 МГц, мікроконвексного датчика 4–8 МГц у режимі реального часу із дозованою компресією датчиком черевної стінки. На основі оцінки допплерівського спектра визначали кількісні параметри кровотоку в артеріальних судинах: пікову систолічну швидкість кровотоку (Vps — peak systolic velocity) — максимальну швидкість кровотоку в досліджуваній судині, кінцеву діастолічну швидкість кровотоку (Ved — end diastolic velocity) — максимальну швидкість кровотоку в досліджуваній судині в кінці діастоли, індекс периферичного опору (Pourcelot, RI — resistive index) — відношення різниці пікової систолічної і кінцевої діастолічної швидкості кровотоку до пікової систолічної швидкості: IR = (Vps – Ved)/Vps.
Дослідження проводили на таких етапах знеболювання: 1-й етап — 12-та година після оперативного втручання; 2-й етап — 24-та година; 3-й етап — 36-та година; 4-й етап — 48-ма година та 5-й етап — 72-га година піcля оперативного втручання.
Статистичну обробку отриманих даних проводили із застосуванням методів варіаційної статистики за допомогою програми Stаtistica 5.5 (належить ЦНІТ ВНМУ ім. М.І. Пирогова, ліцензійний № AXXR910A374605FA). Оцінювали та визначали середні значення, стандартні відхилення та похибки середнього. Вірогідність різниці значень між кількісними величинами в разі відповідності розподілів нормальному значенню визначали за допомогою критеріїв Стьюдента та Фішера. Вірогідними вважалися відмінності при р < 0,05.
Результати дослідження
Перша група — 18 пацієнтів, яким проводили знеболювання методом постійної епідуральної анальгезії бупівакаїном 0,5% (Лонгокаїн, «Юрія-Фарм») у дозі 0,3–0,4 мг/кг (середня доза — 0,32 ± 0,24 мг/кг) та безперервною інфузією фентанілу в дозі 10 мкг/кг/год (середня доза — 10,2 ± 0,4 мг/кг), 14 дітям 2-ї групи знеболювання проводили безперервною інфузією фентанілу в дозі 10 мкг/кг/год (середня доза — 10,4 ± 0,3 мг/кг) [2–4].
Комбіновану спінально-епідуральну анестезію проводили за стандартною методикою: на рівні сегмента LI-LII пунктували епідуральний простір спеціальною двопросвітною голкою, загостреною за типом олівця (Braun B., 18/27 G), потім в її просвіт вводили більш тонку та довгу спінальну голку і пунктували субарахноїдальний простір. Після отримання ліквору вводили бупівакаїн 0,5% у дозі 0,15–0,2 (0,18 ± 0,04) мг/кг. Епідуральний простір після видалення спінальної голки катетеризували в краніальному напрямку і вводили розраховану дозу [1, 7, 8].
Середня сума балів, що характеризувала інтенсивність больового синдрому в ранньому післяопераційному періоді на всіх етапах дослідження, за ВАШ у хворих 1-ї групи була вірогідно меншою (р < 0,05) за відповідні значення у 2-й групі (рис. 1).
/74/74.jpg)
Показаннями до введення додаткових болюсів наркотичних анальгетиків були больова поведінка, десинхронізація із штучною вентиляцією легень та тахікардія. У першій групі не було необхідності в додатковому введенні морфіну, у другій групі вводили додаткові болюси морфіну (0,5 мг/кг) 2 дітям (14,2 %).
Відомо, що рівень кортизолу є одним із показників стресової реакції, у тому числі й больової. Динаміка рівня кортизолу в крові в післяопераційному періоді показана на рис. 2.
/75/75.jpg)
Динаміка рівня кортизолу в крові в 1-й групі свідчить про ліквідацію в більшості дітей протягом 12–72 годин після операції тяжкого стресу, виникнення якого пов’язано з основним захворюванням або операцією, і про достатню анальгезію після операції.
Дослідження артеріального кровообігу у верхній брижовій артерії та нирковій артерії виявило високий індекс резистентності у 2-й групі — 0,98 ± 0,02 та 0,92 ± 0,05, відповідно у 1-й групі — 0,74 ± 0,04 та 0,69 ± 0,04 (норма — 0,6–0,8) (р < 0,05), що патогенетично відображає блокаду мікроциркуляторного русла і, як наслідок, неефективне знеболювання [7–9].
Така сама тенденція спостерігалася при дослідженні внутрішньочеревного тиску. Наприклад, у 2-й групі внутрішньочеревний тиск був значно вищим порівняно з 1-ю групою (14,98 ± 4,02; у 1-й групі — 5,42 ± 2,2) після початку пролонгованої інфузії бупівакаїну (р < 0,05).
Варто відмітити, що в пацієнтів другої групи значно вищий абдомінальний перфузійний тиск, ніж у пацієнтів першої групи, — 64,8 ± 4,2 (у 1-й групі — 57,4 ± 6,4) (р < 0,05), що свідчить про нормалізацію внутрішьночеревного тиску і, можливо, адекватність знеболювання (табл. 1).
Наводимо клінічний випадок, що викликає інтерес своїм клінічним перебігом, анатомічними особливостями і разом із тім свідчить про ефективність використання епідуральної анальгезії методом пролонгованої інфузії бупівакаїну.
Клінічний випадок
Дитина В., МКСХ № 1443, 2,5 року, була госпіталізована 29.02.2012 р. в онкогематологічне відділення ВДОКЛ зі скаргами на збільшення в об’ємі живота. Зі слів батьків, збільшення живота помітили близько 2 тижнів тому. Звернулися по медичну допомогу в поліклініку за місцем проживання, де було виконано УЗД органів черевної порожнини, на якому виявлено пухлинне утворення. До моменту захворювання дитина розвивалася відповідно до віку, травму батьки заперечують. Спадковий онкологічний анамнез не обтяжений, щеплення — згідно з віком.
Загальний стан хворого при госпіталізації тяжкий за рахунок основного захворювання. Свідомість збережена. Шкіра та слизові оболонки блідо-рожевого кольору, чисті. Периферійні лімфатичні вузли не збільшені. ЧСС — 97 за 1 хв, ЧД — 22 за 1 хв. Живіт збільшений в об’ємі, шароподібної форми, бере участь в акті дихання, симетричний. Пальпаторно живіт м’який, безболісний. При пальпації визначається утворення розмірами 10 х 11 см щільноеластичної консистенції. Пухлиноподібне утворення безболісне, має гладку однорідну поверхню. Симптоми подразнення очеревини негативні в усіх відділах. Аускультативно перистальтика звичайна, патологічні шуми не вислуховуються. Печінка та селезінка не пальпуються. Внутрішньочеревний тиск дорівнює 21 см вод.ст.
З огляду на тяжкість стану дитина переведена у відділення реанімації з діагнозом «утворення черевної порожнини» для дообстеження та передопераційної підготовки. Загальний аналіз крові при госпіталізації: Hb — 118 г/л, Ер. — 3,9 • 1012/л, Л — 6,2 • 109/л, п — 1, с — 69, е — 1, м — 3, л — 27, ШОЕ — 8 мм/год. При УЗД органів черевної порожнини визначено об’ємне утворення розмірами 120 х 140 мм. Після відповідної передопераційної підготовки проведена лівобічна поперечна лапаротомія довжиною до 7 см.
Загальна анестезія: тотальна внутрішньовенна анестезія (пропофол + фентаніл), штучна вентиляція легень у режимі PSV згідно з віковими параметрами. Тривалість операції — 3,0 години. Індукція: пропофол 3 мг/кг, фентаніл 3 мкг/кг в/в, міоплегія — сукцинілхолін 2 мг/кг, інтубація — трубка № 4,5, без особливостей. Підтримка анестезії — постійна інфузія пропофолу за схемою: перші десять хвилин зі швидкістю 10 мг/кг/год, наступні десять хвилин — 8 мг/кг/год, надалі — 6 мг/кг/год. Анальгезія — постійна інфузія фентанілу 10 мкг/кг/год та інфузія в епідуральний простір бупівакаїну 0,125% (Лонгокаїн, «Юрія-Фарм»). Наступна міоплегія підтримувалась ардуаном 0,06 мг/кг у перші 40 хвилин, потім зниження дози до 0,02 мг/кг. Під час оперативного втручання швидкість інфузії фентанілу збільшили до 3 мкг/кг/год.
Інфузійна терапія під час оперативного втручання проводилась полііонними розчинами. Інтраопераційний моніторинг життєво важливих функцій. До початку і під час операції артеріальний тиск (АТ) був у межах вікових норм: систолічний АТ — 90–100 мм рт.ст., діастолічний АТ — 55–60 мм рт.ст. ЧСС — 110–115 уд/хв. SPO2 97–99 %.
На операції при розкритті черевної порожнини в рану прилягає пухлинне утворення великих розмірів (рис. 3). Під час ревізії тонкої кишки на відстані 1–1,5 м від зв’язки Трейца виявлено, що пухлинне утворення поширюється на обидва боки брижі кишки та інтимно з нею зв’язане. Виконана резекція скомпрометованої ділянки кишки з клиноподібним висіченням зміненої ділянки її брижі та кістозними утвореннями. Накладений тонко-тонкокишковий анастомоз «кінець в кінець» дворядним швом. Виявлено спільну брижу тонкої та товстої кишки. Санація черевної порожнини. Післяопераційна рана пошарово ушита наглухо.
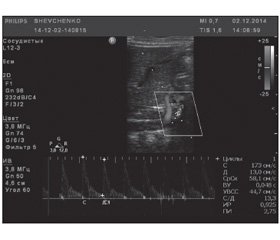
Інтраопераційно виконана катетеризація епідурального простору. Післяопераційне знеболювання продовжувалось постійною інфузією місцевого анальгетика бупівакаїну 0,125% (Лонгокаїн, «Юрія-Фарм») в епідуральний простір. Упродовж усього періоду післяопераційного знеболювання не було необхідності в додатковому введенні опіоїдних анальгетиків. Глюкоза та кортизол у сироватці крові не відрізнялися від доопераційного рівня. На момент старту інфузії бупівакаїну 0,125% після видалення пухлиноподібного утворення відмічалось підвищення ВЧТ до 12 см вод.ст. та IR до 0,925 (рис. 4). Після початку інфузії в епідуральний простір на 10–15-ту хвилину було відмічено нормалізацію показників ВЧТ до 4 см вод.ст. та IR до 0,694 (рис. 5).
01.03.2012 р. пацієнт переведений у соматичне відділення. Післяопераційний період мав задовільний перебіг, гази в пацієнта відійшли через 36 годин після операції, ходити почав через 48 годин після операції. Післяопераційна рана зажила первинним натягом. 05.03.2012 р. дитина виписана в задовільному стані.
Таким чином, ефективність використання ЕА та пролонгованої інфузії фентанілу ґрунтується на можливості впливу на різні механізми виникнення болю — як на центральний (наркотичні анальгетики), так і на периферичний механізм (ЕА) [9]. Проведення ЕА дозволяє значно знизити прояви синдрому абдомінальної гіпертензії та покращити кровотік у магістральних судинах черевної порожнини. Різні механізми дії даних препаратів дозволяють призначати їх у комбінації і в малих дозуваннях з метою досягнення значного анальгетичного ефекту та покращення перебігу раннього післяопераційного періоду.
Висновки
1. Комплексне вивчення реакцій больової поведінки, фізіологічних показників і лабораторних стресових тестів показало, що використання схеми ЕА бупівакаїном методом постійної інфузії препаратів для післяопераційного знеболювання сприяє ефективній анальгезії після травматичних операцій.
2. Використання схеми ЕА бупівакаїном методом постійної пролонгованої інфузії препаратів для післяопераційного знеболювання сприяє зменшенню проявів синдрому інтраабдомінальної гіпертензії та покращує кровотік у магістральних судинах черевної порожнини в дітей, прооперованих із приводу пухлин черевної порожнини.
3. Проведення ЕА значно зменшує негативні наслідки недостатнього знеболювання в дітей, прооперованих із приводу пухлин черевної порожнини, можливе її застосування для ведення післяопераційного періоду.
1. Айзенберг В.Л., Ульрих Г.Э., Цыпин Л.Е., Заболотский Д.В. Региональная анестезия в педиатрии. — СПб.: Синтез Бук, 2012. — 304 с.
2. Ветешев П.С., Ветешева М.С. Принципы анальгезии в раннем послеоперационном периоде // Хирургия. — 2002. — 12. — 49-52.
3. Суханов Ю.В. Оценка эффективности парацетамола как компонента комбинированной аналгезии у детей в послеоперационном периоде / Ю.В. Суханов, Ю.С. Александрович, И.В. Волыхин // Анестезиология и реаниматология. — 2009. — № 1. — С. 58-63.
4. Zoric S., Stamenkovic D., Stevanovic S. et al. Combined spinal epidural and general anesthesia in abdominal surgery // Med. Arh. — 2003. — 57 (4). — 21-28.
5. Kopacz D.J., Allen H.W., Thompson G.E. A comparison of epidural levobupivacaine 0.75% with racemic bupivacaine for lower abdominal surgery // Anesth. Analg. — 2000. — 90. — 642-648.
6. Brennum J., Petersen K.L., Horn A. et al. Quantitative sensory examination of epidural anaesthesia and analgesia in man: combination of morphine and bupivacaine // Pain. — 1994. — 56. — 327-337.
7. Malbrain M.L., Chiumello D., Pelosi P. et al. Incidence and prognosis of intraabdominal hypertension in a mixed population of critically ill patients: a multiple-center epidemiological study // Crit. Care Med. — 2005. — 33. — 315-322.
8. Malbrain M.L., Chiumello D., Pelosi P. et al. Prevalence of intra-abdominal hypertension in critically ill patients: a multicentre epidemiological study // Intensive Care Med. — 2004. — 30. — 822-829.
9. Malbrain M., Jones F. Intra-abdominal pressure measurement techniques / Abdominal Compartment Syndrome / Ed. by Ivatury R., Cheatham M., Malbrain M., Sugrue M. — Landes Bioscience, Georgetown, 2006. — Р. 19-68.
10. Hopf H., Weitz J. Postoperative pain management // Arch. Surg. — 1994. — 129(2). — 128-132.

/75/75_2.jpg)
/76/76.jpg)