Журнал «Медицина неотложных состояний» 1 (64) 2015
Вернуться к номеру
Периоперационная инфузионная терапия
Авторы: Шлапак И.П., Галушко А.А. - Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
В статье представлен взгляд на современное состояние проблемы проведения периоперационной инфузионной терапии. Большое внимание уделено выбору средств для инфузионной поддержки в периоперационном периоде, составлению программ предоперационной подготовки, интенсивной терапии массивной интраоперационной кровопотери и послеоперационного ведения пациентов.
У статті представлено погляд на сучасний стан проблеми проведення периопераційної інфузійної терапії. Велику увагу приділено вибору засобів для інфузійної підтримки в периопераційному періоді, складанню програм передопераційної підготовки, інтенсивної терапії масивної інтраопераційної крововтрати та післяопераційного ведення пацієнтів.
This article presents a view on the current state of the problem of carrying out perioperative fluid therapy. Much attention is paid to the choice of agents for infusion support in the perioperative period, creation of preoperative preparation programs, intensive care for massive intraoperative blood loss and postoperative management of patients.
периоперационный период, инфузионная терапия, кровопотеря, кристаллоиды, коллоиды, гидроксиэтилированные крахмалы, Гекодез, Гекотон, желатины, Волютенз.
периопераційний період, інфузійна терапія, крововтрата, кристалоїди, колоїди, гідроксиетильованi крохмалі, Гекодез, Гекотон, желатини, Волютенз.
perioperative period, fluid therapy, blood loss, crystalloids, colloids, hydroxyethyl starches, Gekodez, Geсoton, gelatins, Volutenz.
Статья опубликована на с. 91-96
Хирургические больные требуют переливания
инфузионных растворов на всем
протяжении периоперационного периода:
до операции (при экстренных вмешательствах),
во время операции и после нее.
Gilbert Park
У больных, которые поступают на лечение в хирургический стационар, довольно часто наблюдаются нарушения водно-электролитного баланса (ВЭБ). Причиной этих нарушений является как сама хирургическая патология (например, перитонит, кишечная непроходимость, пилородуоденальный стеноз), так и имеющаяся у пациента сопутствующая патология (декомпенсированный сахарный диабет, сердечная недостаточность и т.д.). От правильной оценки и коррекции нарушений во многом зависит успех осуществляемого оперативного лечения.
Предоперационная инфузионная терапия
Объемы и задачи предоперационной инфузионной подготовки зависят от многих факторов и часто значительно отличаются при подготовке к плановой и ургентной операции.
Плановые оперативные вмешательства. При подготовке пациентов к плановому оперативному лечению необходимо в первую очередь компенсировать имеющиеся нарушения гемоконцентрационных показателей. Так, в большинстве клинических ситуаций рекомендуется, чтобы перед плановой операцией уровень гемоглобина находился в пределах от 90–100 г/л и выше, уровень гематокрита не был ниже 34–36 %, а уровень альбумина составлял не менее 35 г/л (Бойко В.В., 2011). Поддержание таких показателей создает оптимальные условия для заживления послеоперационных ран, а также предохраняет от развития опасной анемии в результате возможного развития интраоперационной кровопотери.
При подготовке к плановой операции возможны три варианта алгоритма проведения инфузионной терапии:
1) больные не нуждаются в инфузионной терапии. Это касается пациентов, не имеющих существенных нарушений здоровья, которым предстоят небольшие по длительности и травматичности оперативные вмешательства. Как правило, у таких пациентов нет дегидратации и нарушений ВЭБ, а после операции они быстро начинают принимать жидкость и воду, таким образом, нарушения ВЭБ у них не развиваются, а значит, и проведения инфузионной терапии в периоперационном периоде у них не требуется;
2) у больных имеются хронические нарушения водно-электролитного обмена, которые требуют соответствующей коррекции. Чаще всего это нарушения, связанные с дефицитом одного или нескольких ионов. Например, при пилородуоденальном стенозе формируется гипокалиемический гипохлоремический алкалоз, который требует четкого определения дефицита калия и хлора и его соответственной коррекции;
3) у больных перед плановой операцией развиваются острые нарушения ВЭБ либо в процессе обследования впервые выявляют новое сопутствующее заболевание, при котором возможны опасные нарушения ВЭБ. Примером таких нарушений может быть впервые выявленный сахарный диабет. Как известно, в Украине количество официально зарегистрированных больных сахарным диабетом значительно ниже, чем в развитых странах, в том числе в соседних странах Восточной Европы. Причина здесь, к сожалению, не в национальных особенностях украинцев или особенностях украинской кухни, а в явном недовыявлении больных с диабетом. Вот и получается, что в огромном числе случаев сахарный диабет выявляют случайно при скрининговом обследовании перед оперативным лечением. В такой ситуации рекомендуют отложить плановое оперативное лечение на 1–2 недели для дообследования и обеспечения полной компенсации выявленного заболевания.
Экстренные оперативные вмешательства. Чаще всего такие вмешательства производят по поводу неотложных операций на органах брюшной полости. Инфузионная терапия в этих ситуациях должна быть направлена на поддержание адекватной гемодинамики, преднагрузки и сердечного выброса.
Следует помнить, что у больных с «острым животом» предоперационная подготовка значительно снижает риск развития осложнений и летальность. А недостатки инфузионной терапии могут и не иметь существенного влияния на течение операции, но обязательно проявятся в полной мере после нее.
Последствиями плохой предоперационной подготовки являются повреждения почек, легких и печени, которых вполне можно было бы избежать (Парк Г., Роу П., 2005).
Общепризнанными при предоперационной подготовке больных с неотложными заболеваниями брюшной полости являются следующие действия:
— катетеризация двух вен (одной, желательно центральной);
— катетеризация мочевого пузыря;
— постановка назогастрального зонда;
— инфузионная терапия кристаллоидными и коллоидными растворами в объеме не менее 1,5 л.
Однако возникает вопрос: всем ли больным с явлениями «острого живота» мы будем проводить инфузионную терапию в объеме 1,5 литра? Например, в стационар с подозрением на острый аппендицит поступает молодой пациент 19 лет без сопутствующей патологии и с давностью заболевания 2–3 часа. Безусловно, такому пациенту нет необходимости проводить инфузионную терапию в объеме 1,5 литра. А кому же тогда показано проведение подобной терапии? Ответ на этот вопрос мы представляем в табл. 1.
Программа инфузионной предоперационной подготовки больного к экстренному оперативному лечению может включать:
— раствор Рингера — 400 мл;
— полиэлектролитный раствор на основе 0,9% раствора NaCl — 500 мл;
— Реосорбилакт — 200–400 мл;
— Гекотон (Гекодез) или Волютенз — 400–500 мл;
— растворы для профилактики хирургической инфекции (инфузионные антибиотики) — 200 мл.
Всего: 1500 мл.
Представленная программа инфузионной терапии, безусловно, не является догмой. Однако она иллюстрирует основные принципы построения инфузионной терапии в предоперационном периоде. В частности, следует отметить, что начинать инфузионную подготовку пациента к операции следует с введения кристаллоидов.
Ни при каких обстоятельствах нельзя начинать инфузионную терапию с введения коллоидов!
Никогда! Вначале необходимо провести регидратацию («гидра» — вода). Если у больного есть дефицит воды — в первую очередь ему надо дать воду, т.е. растворы кристаллоидов. Если начать инфузию с коллоидов, то у пациента с большой долей вероятности разовьются побочные эффекты. То есть в послеоперационном периоде следует ожидать появления симптомов острой почечной недостаточности и разнообразных нарушений свертывания крови (Шлапак И.П. и соавт., 2013).
Следующий момент. Для более эффективного привлечения жидкости из интерстициального пространства целесообразно ввести в программу инфузионной терапии Реосорбилакт. В этом случае реализуется концепция малообъемной инфузионной терапии, о которой речь пойдет несколько ниже.
А как же коллоиды? Для современной инфузионной терапии характерен следующий подход: если программа инфузионной поддержки рассчитана на введение более 1 л растворов, в ее составе должен быть коллоидный компонент. Идеальное соотношение кристаллоидов и коллоидов составляет 3 : 1. Таким образом, на каждые 1–1,5 л кристаллоидов необходимо переливать 400 или 500 мл коллоидов, в зависимости от клинической ситуации. Исходя из этих соображений, мы и предлагаем включать в программу инфузионной терапии растворы гидроксиэтилкрахмалов (ГЭК) (Гекотон или Гекодез) и/или раствор желатина (Волютенз). Более подробная информация об этих растворах будет представлена ниже.
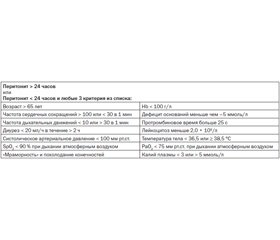
Целевые ориентиры инфузионной терапии. Проводя подготовку больного к экстренному оперативному вмешательству, полезно иметь конкретные ориентиры, когда мы можем сказать: «Да, мы правильно провели инфузионную терапию, и больной готов к операции». Такие ориентиры перед неотложными операциями на органах брюшной полости представлены в табл. 2.
Как только закончена инфузионная терапия, следует немедленно начать оперативное вмешательство.
Интраоперационная инфузионная терапия
Основными задачами интраоперационной инфузионной терапии являются:
— устранение дефицита жидкости, развившегося до операции;
— восполнение физиологических потребностей в жидкости;
— возмещение возникающих в ходе операции патологических потерь жидкости.
Даже если больному предстоит плановая операция, у него к моменту ее начала возникает некоторый дефицит жидкости. Связано это с традиционным правилом ничего не принимать внутрь за 4–6 часов до операции. Кроме того, для подготовки кишечника часто назначают слабительные препараты или клизмы. Эти мероприятия приводят к потерям жидкости и электролитов, которые целесообразно возмещать сбалансированными кристаллоидными растворами, например раствором Хартмана в дозе 1,5 мл/кг/ч.
Следует также учитывать, что хирургическая травма приводит к потерям жидкости в ткани и к секвестрации. Этот дефицит проявляется уменьшением объема жидкости в интерстициальном и внутрисосудистом пространстве. Ориентировочный объем жидкости, который необходимо ввести для компенсации потерь во время операции, представлен в табл. 3.
Указанные потребности можно удовлетворить, придерживаясь следующего режима инфузионной терапии. В течение первого часа вводят один литр сбалансированного электролитного раствора. После этого инфузию проводят со скоростью 300 мл/ч, увеличивая до 600 мл/ч при тяжелой хирургической травме. Целью является поддержание диуреза > 0,5 мл/кг/ч.
Особые сложности возникают при массивных кровотечениях во время оперативного вмешательства. Этой проблеме мы посвятили следующие страницы.
Инфузионно-трансфузионная терапия массивной операционной кровопотери
Массивная операционная кровопотеря (МОК), сопровождающая обширные хирургические вмешательства, представляет собой специфическое критическое состояние, в патогенезе которого доминируют тяжелая персистирующая гиповолемия, анемия и угрожающая коагулопатия в сочетании с мощным шокогенным симпатоадреналовым стрессом и выбросом медиаторов воспаления, а также охлаждением организма (Горобец Е.С. и соавт., 2010).
С одной стороны, такая кровопотеря происходит во время хирургического вмешательства, которое проходит под наркозом, при постоянном контроле квалифицированного анестезиолога и постоянном аппаратном мониторировании основных жизненных функций. Очевидно, что массивная операционная кровопотеря должна переноситься больным лучше, чем утрата даже меньшего объема крови вне операционной. Однако, с другой стороны, так бывает только при правильном построении всего комплекса анестезиологического обеспечения, в котором правильная и рациональная инфузионно-трансфузионная терапия (ИТТ) играет ключевую роль (Воробьев А.И. и соавт., 2001).
Кровопотеря — неизбежный спутник хирургической операции. При должной квалификации хирурга она чаще всего связана с обширностью и сложностью вмешательства. Часто приходится принимать в расчет не только необходимость удаления пораженных органов в пределах здоровых тканей, но и патологический ангиогенез, способный привести к выраженной васкуляризации зоны операции. Оба этих фактора могут сильно влиять на объем кровопотери (Горобец Е.С., Зотов А.В., Феоктистов П.И., 2011).
С другой стороны, применение современных хирургических инструментов с гемостатическими свойствами (например, ультразвуковые, лазерные скальпели и т.д.), кровоостанавливающих губок и повязок способно значительно снизить объем кровопотери. Тем не менее ряд операций (особенно обширных и нестандартных) сопровождается массивной кровопотерей, требующей проведения активной ИТТ.
Традиционно под массивной кровопотерей понимают потерю одного ОЦК в течение 24 часов, учитывая, что объем циркулирующей крови (ОЦК) составляет около 7 % от идеальной массы тела у взрослых и 8–9 % у детей. Альтернативные дефиниции включают также: потерю 50 % ОЦК в течение трех часов либо потерю 150 мл в минуту в течение 20 минут (Stainsby D. et al., 2000).
По мнению Е.С. Горобца (2011), для анализа ситуации и правильного построения ИТТ наиболее удобен второй из названных критериев (потеря 50 % ОЦК в течение трех часов), поскольку он позволяет пользоваться принятым алгоритмом лечебных мероприятий.
Следует заметить, что на исход массивной кровопотери влияет толерантность к ней у конкретного пациента. Толерантность к потере крови включает в себя целый комплекс обстоятельств и условий, таких как возраст, пол, исходные резервы витальных функций пациента, исходная кислородная функция крови и состояние свертывающей системы, температура тела больного, вид анестезии и исходная премедикация, на фоне которой проходит операция. Безусловно, имеет значение тяжесть и продолжительность хирургического вмешательства. Быстрая потеря одного и того же объема крови вследствие ранения крупного сосуда во время операции (при условии правильных действий хирурга и анестезиолога) обычно переносится легче, чем длительное кровотечение, в процессе выполнения продолжительного травматичного вмешательства (Горобец Е.С., Зотов А.В., 2011).
В основе эффективной ИТТ массивной кровопотери в операционной лежат:
— поддержание достаточной преднагрузки сердца путем интенсивной внутривенной инфузии;
— поэтапное манипулирование составом инфузии с ориентировкой на объем как уже потерянной, так и ожидаемой потери крови с учетом показателей гемокоагулограммы;
— своевременное использование кардиовазотоников (эфедрин, мезатон, норадреналин, допамин) для поддержания пост- и преднагрузки в случаях возможного или развивающегося кризиса гемодинамики и гиповолемического шока;
— профилактика и лечение расстройств системы гемостаза (Горобец Е.С., Зотов А.В., 2011).
Обсуждая проблему лечения МОК, нельзя забывать, что кровотечение происходит у больного человека, т.е. страдающего теми или иными расстройствами, которые возникают на фоне как основного заболевания, так и сопутствующих патологий, создающих преморбидный фон развивающегося кровотечения. Кроме того, больного оперируют в условиях анестезии (нередко комбинированной, многокомпонентной), что также отражается на его состоянии, предшествующем кровопотере, главным образом на гемодинамике и компенсаторных реакциях.
Оценка кровопотери. В большинстве случаев возможна лишь приблизительная оценка объема кровопотери. Более-менее она точна, если большая часть излившейся крови попадает в отсос. Помогает взвешивание салфеток, пропитанных кровью. Попытки рассчитывать кровопотерю по уровню гематокрита, всевозможным таблицам и приборам как соблазнительны, так и неточны. И самое главное, доверие к подобным методам оценки приводит к гипо- и гипердиагностике масштабов кровопотери и к серьезным ошибкам в тактике оказания помощи.
В интенсивной терапии МОК большую роль играет этапность ИТТ — переход от инфузии кристаллоидов и синтетических коллоидов к своевременному и обоснованному переливанию компонентов крови (свежезамороженная плазма (СЗП), эритроцитарная масса и донорские тромбоциты) (табл. 4).
Принцип этапности ИТТ при продолжающемся кровотечении позволяет анестезиологу управлять непрерывным внутривенным вливанием, поддерживая необходимый ОЦК и не создавая избыточную гемодилюцию с потерей минимально приемлемого коагуляционного потенциала и кислородотранспортной функции крови (Горобец Е.С., Зотов А.В., 2011).
Отдельно следует остановиться на неотложной ИТТ острой МОК с быстрой потерей большого количества крови. В этих ситуациях перед врачом, который проводит инфузионно-трансфузионную терапию, стоит основная задача — максимально быстро и эффективно заполнить сосудистое русло. Естественно, возникает вопрос: какой из препаратов в наибольшей степени отвечает этим требованиям — мощно, быстро и безопасно восполнить ОЦК и удержать параметры гемодинамики?
Для лечения тяжелого шока еще в 1944 году было предложено использование гипертонических растворов NaCl. I. Velasco в 1980 году обнародовал экспериментальные данные об оживлении собак, у которых был смоделирован тяжелый геморрагический шок. Исследования показали, что даже при наличии кровопотери, равной 50 % ОЦК, инфузии 4 мл/кг 7,5% натрия хлорида достаточно для восстановления сердечного выброса и регионарного кровотока (Галушко О.А., 2011). В это же время были опубликованы материалы исследования 12 больных с гиповолемическим шоком, которым на фоне общепринятого лечения внутривенно вводили от 100 до 400 мл 7,5% раствора натрия хлорида болюсами по 50 мл. В ответ на введение отмечалось повышение артериального давления, восстановление сознания и выделение мочи, т.е. наблюдались признаки обратимости шока (Бутров А.В., Галенко С.В., 2008).
Эти работы послужили толчком к дальнейшим исследованиям и возникновению понятия малообъемных оживлений (small-volume resuscitation) как одного из методов экстренной терапии различных стадий шока и терминальных состояний. Эта терапия, основанная на быстрой инфузии малого объема (4 мл/кг) 7,2–7,5% натрия хлорида, связана с быстрой мобилизацией эндогенной жидкости в сосудистое русло из интерстиция и внутриклеточного пространства по осмотическому градиенту. 250 мл такого раствора имеет такой же волемический эффект, как и 1 л 5% раствора альбумина.
Но гемодинамический эффект гипертонических растворов очень непродолжителен, что связано с быстрым выравниванием осмотического градиента между внеклеточным и внутриклеточным секторами (Черний В.И. и соавт., 2012). Для сохранения достигнутого увеличения внутрисосудистого объема было предложено применять гипертонический раствор натрия хлорида вместе с коллоидами. Полученный двухкомпонентный раствор, с одной стороны, способствует увеличению осмолярности плазмы и мобилизации внутриклеточной воды (гипертонический компонент), а с другой — обеспечивает увеличение онкотического давления плазмы и сохранение внутрисосудистого объема (коллоидный компонент).
На сегодняшний день считается, что наиболее устойчивый волемический эффект проявляется при применении смеси гипертонического раствора NaCl с декстраном или ГЭК в соотношении 1 : 1 в дозе 4–5 мл/кг (Беляев А.В., Бондарь М.В., Дубов А.М. и др., 2004).
В связи с этим интересным и перспективным направлением нам представляется использование комбинированных многокомпонентных растворов, в состав которых входит гипертонический раствор натрия хлорида и раствор ГЭК. Одним из таких растворов является новый отечественный препарат Гекотон.
Гекотон. Основными действующими веществами препарата являются гидроксиэтилкрахмал III поколения 130/0,4, ксилитол и натрия лактат. Гекотон обладает гемодинамическим, реологическим, противошоковым, дезинтоксикационным действием.
Благодаря своему составу Гекотон относится к группе многокомпонентных коллоидно-гиперосмолярных растворов. После введения препарата в вену повышается осмотическое давление крови, усиливается эвакуация жидкости из тканей в сосудистое русло, восстанавливается нарушенная гемодинамика, улучшаются микроциркуляция и реологические свойства крови, усиливается сердечная деятельность, повышается процесс обмена веществ, улучшается дезинтоксикационная функция печени.
Максимальная суточная доза (в исключительных случаях допускается превышение) — 20 мл/кг/сут (1400–1600 мл/сут). Обычно вливают 5–10 мл/кг/сут (400–800 мл/сут).
Отдельных слов заслуживают растворы желатина — растворы, которые имеют модифицированную молекулярную структуру. Их получают из денатурированного белка. Этот белок выделяют из коллагеновой ткани крупного рогатого скота методом термической деградации, гидролиза и сукцинирования. Препараты желатина являются изотоническими, изоонкотическими (4–8%) растворами желатина и низкомолекулярными (20 000–40 000 Да) плазмозаменителями. Они имеют уровень рН 7,1–7,7, создают коллоидно-осмотическое давление 33,3 мм рт.ст., или 453 мм вод.ст., осмолярность — 274 мосмоль/л, объемный эффект этих препаратов составляет 40–100 %.
Волютенз. Среди современных препаратов группы желатинов следует выделить отечественный препарат Волютенз. Особенностью его использования является то, что с токсикологической точки зрения ограничений дозы он не имеет. Максимальная суточная доза определяется степенью гемодилюции. Следует соблюдать осторожность, чтобы избежать снижения гематокрита ниже критических значений. Значения, которые считаются критическими для пациента, варьируют индивидуально, в зависимости от капиллярной экстракции кислорода, возраста пациента, циркуляторного резерва и клинического состояния. У пациентов с нормальной потребностью в кислороде и сохранным компенсаторным механизмом может быть приемлемой гемодилюция до уровня гемоглобина 8 г/100 мл или гематокрита 25 %; у пациентов отделений интенсивной терапии гемоглобин не должен быть ниже 10 г/100 мл, а гематокрит — ниже 30 %. В случае необходимости проводят дополнительное переливание крови или эритроцитарной массы. Следует также заметить, что до окончательного хирургического гемостаза целесообразно так планировать ИТТ, чтобы при восполнении дефицита ОЦК развивалась гемодилюция, допустимая для данного пациента. Смысл разведения крови состоит в стремлении минимизировать потери форменных элементов на том этапе операции, когда потеря определенного объема крови неизбежна. Если гемодилюция не влечет за собой клинически значимую кровоточивость, то можно рассчитывать и на меньшие потери компонентов крови (при потере равного объема) из-за низкого гематокрита. Если позволяет ситуация, следует стремиться восстановить показатели красной крови лишь после остановки кровотечения.
Потребность в жидкости в послеоперационном периоде
Составляя программу инфузионной терапии у больных в послеоперационном периоде, необходимо учесть несколько факторов. Во-первых, следует вычислить физиологическую потребность, которая составляет около 25–30 мл/кг/сут — около 2–2,5 л/сут. К этой цифре прибавляют потери, которые не ощущаются (через кожу и легкие): 20 мл/ч — 500 мл/сут. Если у больного есть лихорадка, то необходимо добавить 10 мл/ч (250 мл/сут) на каждый градус выше 37 °С.
Необходимо также учитывать специфические потери и потребности в жидкости. Так, при парезе кишечника к программе инфузий добавляют 20 мл/ч (500 мл/сут), но только в первые 24 часа после операции. При потерях в третье пространство после лапаротомии и торакотомии или при массивном повреждении тканей также только в первые 24 ч после операции необходимо добавить 40 мл/ч (1000 мл/сут). Восстанавливают и другие потери (через зонды, из дренажей и т.д.).
1. Беляев А.В., Бондарь М.В., Дубов А.М. и др. Руководство по интенсивной терапии / [Под ред. А.И. Трещинского]. — К.: Вища школа, 2004. — 582 с.
2. Бойко В.В., Козлова Т.В., Хижняк А.А., Мушенко В.Е. Инфузионная терапия и парентеральное питание в хирургии. — Харьков: СИМ, 2011. — 148 с.
3. Бутров А.В., Галенко С.В. Комбинированные гипертонические растворы в интенсивной терапии критических состояний // Укр. журнал екстремальної медицини імені Г.О. Можаєва. — 2008. — Т. 9, № 4. — С. 18–21.
4. Воробьев А.И., Городецкий В.М., Шулутко Е.М., Васильев С.А. Острая массивная кровопотеря. — М.: ГЭОТАР-МЕД, 2001. — 176 с.
5. Галушко О.А. Історія інфузійної терапії: від Вільяма Гарвея до наших днів // Внутрішня медицина. — 2011. — № 2. — С. 56–60.
6. Горобец Е.С., Зотов А.В., Феоктистов П.И. Инфузионно-трансфузионная терапия массивной кровопотери во время хирургического вмешательства // Анестезиология и интенсивная терапия: 21 взгляд на проблемы XXI века / Под ред. А.М. Овечкина. — М.: Бином, 2011. — 408 с.
7. Горобец Е.С., Феоктистов П.И., Боровкова Н.Б. Волювен — коллоидный плазмозаменитель в лечении массивной операционной кровопотери при онкологических операциях // Укр. журн. екстремальної медицини імені Г.О. Можаєва. — 2010. — Т. 11, № 1. — С. 74–81.
8. Черний В.И., Колесников А.Н., Олейников К.Н., Егоров А.А., Билошапка В.И. Рациональная инфузионная терапия. — Донецк: Издатель Заславский А.Ю., 2012. — 184 с.
9. Шлапак І.П., Нетяженко В.З., Галушко О.А. Інфузійна терапія в практиці лікаря внутрішньої медицини: Навчальний посібник. — К.: Логос, 2013. — 308 с.
10. Stainsby D., MacLennan S., Hamilton P.J. Management of massive blood loss: a template guideline // Br. J. Anaesth. — 2000 Sep. — 85(3). — 487–91.

/92/92.jpg)
/93/93.jpg)
/95/95.jpg)