Журнал «Медицина неотложных состояний» 2 (65) 2015
Вернуться к номеру
Сучасні методи об’єктивізації болю та ноцицепції
Авторы: Кобеляцький Ю.Ю., Шайда О.О. — Кафедра анестезіології та інтенсивної терапії, ДЗ Дніпропетровська медична академія МОЗ України»
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Оцінка адекватності загальної анестезії, незважаючи на тривале її застосування, на сьогодні залишається не до кінця вирішеним питанням. Новітні технології на основі аналізу електроенцефалограми дозволяють оцінити гіпнотичну дію анестетиків. Утім, стан загальної анестезії має забезпечувати не лише відсутність свідомості, але й адекватне пригнічення субкортикальних реакцій, викликаних ноцицептивною стимуляцією. Дані щодо можливості розвитку в післяопераційному періоді викликаної опіатами гіпералгезії при використанні високих доз цих препаратів спонукають до удосконалення підходів до їх дозування. У цьому огляді розглянуто декілька розроблених протягом останнього десятиліття технологій, які дозволяють отримати уявлення про баланс аналгезії/ноцицепції на основі оцінки стану автономної нервової системи.
Оценка адекватности общей анестезии, несмотря на длительность ее существования, на сегодняшний день остается не до конца решенным вопросом. Новые технологии на основании анализа электроэнцефалограммы позволяют оценить гипнотическое действие анестетиков. Между тем состояние общей анестезии должно обеспечивать не только отсутствие сознания, но и адекватное подавление субкортикальных реакций, вызванных ноцицептивной стимуляцией. Данные относительно возможности развития в послеоперационном периоде вызванной опиатами гипералгезии при использовании высоких доз этих препаратов побуждают к усовершенствованию подходов к их дозированию. В данном обзоре рассмотрено несколько разработанных в течение последнего десятилетия технологий, которые позволяют получить представление о балансе аналгезии/ноцицепции на основании оценки состояния автономной нервной системы.
Though anaesthesia has been used for a long time the monitoring of its adequacy is still challenging. New techniques based on electroencephalography analysis allow assess hypnotic effect of anaesthetic agents. However besides the loss of consciousness, adequate inhibition of subcortical brain activity should be achieved during surgical procedures. The data about possible development of opiate-induced hyperalgesia in postoperative period due to their high doses used for anaesthesia require to improve approaches to their dosages. This review considers several techniques been developed for the last decade that allow get an insight about analgesia-nociception balance according to the assessment of autonomic nervous system.
моніторинг балансу аналгезії/ноцицепції, загальна анестезія, автономна нервова система.
мониторинг баланса аналгезии/ноцицепции, общая анестезия, автономная нервная система.
monitoring of analgesia/nociception balance, general anaesthesia, autonomic nervous system.
Статья опубликована на с. 19-23
Субкортикальна активність головного мозку під час загальної анестезії
Під час загальної анестезії гіпнотики пригнічують свідоме сприйняття болю, тому для характеристики фізіологічних реакцій нервової системи, що викликаються хірургічною стимуляцією, найбільше підходить термін «ноцицепція». Ноцицептивна стимуляція призводить до пластичних змін у нервовій системі та обумовлює нервово-ендокринну стресову реакцію. Еферентною ланкою цієї стресової реакції є симпатична нервова система та ендокринні органи. Активація симпатичної нервової системи викликає підвищення тонусу еферентних симпатичних нервів та вивільнення катехоламінів із мозкової речовини надниркових залоз. Гормональні реакції зумовлені підвищенням симпатичного тонусу та рефлексами, опосередкованими через гіпоталамус, і проявляються підвищенням секреції адренокортикотропного гормона, бета-ендорфіну, гормона росту, пролактину, вазопресину, кортизолу, альдостерону, глюкагону та зниженням секреції інсуліну й тиреоїдних гормонів [1].
Якщо протягом тривалого часу існування спеціальності завданнями загальної анестезії вважалось пригнічення свідомого сприйняття болю та створення адекватних умов для роботи хірурга, то пізніше значну увагу почали приділяти контролю стресової відповіді на операційну травму. У 1981 р. M.F. Roizen та співавт. запропонували термін MAC-BAR — мінімальна альвеолярна концентрація анестетика, що блокує відповідь автономної нервової системи на хірургічний розтин [2]. У своїй роботі вони зазначили: «…адекватний рівень анестезії має забезпечувати дещо більше, ніж просто відсутність рухів пацієнта. Якщо несприятливі наслідки… зумовлені нейроендокринною відповіддю на стимуляцію, то, мабуть, гіпотеза «чим менше анестетика, тим краще» є хибною». Оскільки концентрації інгаляційних анестетиків, що відповідають MAC-BAR, призводять до значних порушень гемодинаміки і є небезпечними, у клінічній практиці зазвичай використовують збалансовану анестезію: комбінацію інгаляційних анестетиків з опіатами. Останні, на відміну від інгаляційних та внутрішньовенних анестетиків, здатні ефективно контролювати вивільнення катехоламінів [3, 4].
Значна індивідуальна варіабельність потреби в анальгетиках, використання мультимодального підходу до періопераційного знеболення та поява нових хірургічних технік ставлять питання про розрахунок доз опіатів. Беручи до уваги несприятливий вплив адренергічної відповіді, стандартна практика передбачає введення більших доз опіатів, ніж це необхідно для блокування активації симпатичної нервової системи. Проте негативні наслідки передозування цих препаратів, такі як затримка пробудження, післяопераційна респіраторна депресія, та можливість розвитку гіпералгезії спонукають до удосконалення підходів до дозування цих препаратів.
Викликана опіатами гіпералгезія
Викликана опіатами гіпералгезія — це стан ноцицептивної сенситизації, коли пацієнти, які отримують опіоїди для лікування болю, мають підвищену чутливість до больових стимулів. Цей феномен вперше описав Albutt в 1870 р. у пацієнтів, що приймали морфін [5]. Дослідження, проведені в останні два десятиліття, свідчать про можливість виникнення гіпералгезії не лише при тривалому, а й при короткочасному застосуванні опіатів під час хірургічних утручань [6–8]. Нещодавній метааналіз [9] продемонстрував здатність високих інтраопераційних доз опіатів підвищувати інтенсивність післяопераційного болю, що вимагає збільшення кількості використаного для післяопераційного знеболення морфіну. V. Joly та співавт. [10], дослідивши пороги болю для механічної стимуляції, безпосередньо показали вплив високих інтраопераційних доз реміфентанілу на збільшення зони гіпералгезії навколо післяопераційної рани.
Детальні молекулярні механізми розвитку викликаної опіатами гіпералгезії поки що не до кінця з’ясовані. Вважається, що вона обумовлена нейропластичними змінами в периферичній та центральній нервовій системі та є нормальною адаптивною відповіддю на екзогенне введення опіатів. Цікаво, що при ураженні периферичних нервів спостерігаються подібні нейропластичні зміни, як і при розвитку викликаної опіатами гіпералгезії [11], що дає підстави вважати цей стан фактором ризику розвитку хронічного післяопераційного болю [12].
Отже, пошук методів, що дозволяли б під час хірургічних утручань об’єктивно оцінити баланс ноцицепції/аналгезії, є важливим завданням сучасної анестезіології.
Моніторинг адекватності анестезії
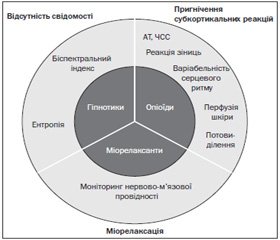
У стані загальної анестезії можна виділити три компоненти: відсутність свідомості, пригнічення субкортикальних реакцій та міорелаксацію (рис. 1).
/20/20.jpg)
Моніторинг нервово-м’язової провідності вже давно використовується в анестезіологічній практиці. Нові технології роблять можливим рутинний моніторинг нейрофізіологічного стану центральної нервової системи на основі аналізу електроенцефалограми, що дозволяє безпосередньо оцінити гіпнотичну дію препаратів для загальної анестезії. Проте на сьогодні немає єдиного стандарту оцінки субкортикальних реакцій. У клінічній практиці для оцінки потреби в опіоїдах зазвичай використовують такі показники, як артеріальний тиск та частота серцевих скорочень, однак вони не є достатньо чутливими та специфічними для оцінки рівня аналгезії. Тому протягом останнього десятиліття розроблено декілька технологій, що дозволяють оцінити баланс ноцицепції/аналгезії. Ці технології базуються на оцінці реакції симпатичної нервової системи на ноцицептивну стимуляцію.
Оцінка шкірної провідності
Стимуляція симпатичної нервової системи активує секрецію потових залоз, їх наповнення потом призводить до підвищення електропровідності шкіри [13]. Під керівництвом H. Storm було розроблено пристрій, що дозволяє вимірювати коливання шкірної провідності за допомогою трьох електродів, що кріпляться на поверхні долоні або стопи пацієнта. Швидка зміна (протягом 2 секунд) шкірної провідності при симпатичній стимуляції дозволяє моніторувати стан автономної нервової системи в реальному часі.
Під час загальної анестезії кількість коливань шкірної провідності протягом секунди (NFSC) корелювала з концентрацією катехоламінів [14] та з оцінкою за клінічною шкалою стресу [15]. Підвищення NFSC з чутливістю 86 % та специфічністю 86 % вказувало на неадекватність анестезії згідно з клінічною шкалою стресу [16]. Підвищення NFSC спостерігалось при тетанічній нейростимуляції під час загальної анестезії та пригнічувалось інфузією реміфентанілу [15]. Ці дані свідчать про те, що показники шкірної провідності об’єктивно відображають ноцицептивну стимуляцію. Проте при достатньо глибокому рівні анестезії NFSC не змінювалась при введенні опіоїдів та лише частково корелювала з рівнем катехоламінів, оскільки протягом значної частини вимірювань дорівнювала нулю [17]. Автори дійшли висновку, що підвищення NFSC вказує на дуже високий рівень стресу та є детектором лише екстремального болю, тому має обмежену користь для моніторингу інтраопераційної ноцицепції.
У післяопераційному періоді NFSC > 0,1 з чутливістю 50 % та специфічністю 64 % вказувала на інтенсивність болю > 3 балів за десятибальною цифровою вербальною шкалою (NRS) [18]. Така невисока відповідність інтенсивності болю, визначеної пацієнтами, показникам шкірної провідності може пояснюватись впливом емоційного стану на активність симпатичної нервової системи.
Слід відзначити, що недостатньо вивченим є вплив температури шкіри на здатність NFSC об’єктивно відображати баланс ноцицепції/аналгезії [19].
Визначення реакції зіниць
Відповідь автономної системи на ноцицептивні стимули може бути оцінена за реакцією зіниць. Рефлекс розширення зіниць (PDR) у відповідь на пошкоджуючі стимули було описано Budge ще в 1852 р. На сьогодні розроблено пристрої, які дозволяють вимірювати діаметр зіниці та амплітуду фотореакції. Причому саме зміна діаметра зіниці у відповідь на стандартизований ноцицептивний стимул (наприклад, тетанічна стимуляція), а не сам діаметр дає уявлення про баланс аналгезії/ноцицепції. Під час загальної анестезії, спричиненої дією гіпнотиків, діаметр зіниць зменшується, але PDR у відповідь на ноцицептивні стимули зберігається. Цей рефлекс пригнічується дією опіоїдів [30] та регіонарною анестезією [31]. У післяопераційному періоді величина PDR у відповідь на стандартизований ноцицептивний стимул корелювала з інтенсивністю болю [32]. Також зміна діаметра зіниць корелювала з інтенсивністю болю під час пологів [33]. Недоліками методу є дискретність оцінювання та складність процедури вимірювання.
Вимірювання амплітуди пульсової хвилі
Активація симпатичної нервової системи викликає периферичну вазоконстрикцію. Це призводить до зниження амплітуди пульсової хвилі, що може бути оцінено за допомогою фотоплетизмографії. У 2007 р. M. Huiku представив розроблений індекс хірургічного стресу, який пізніше було перейменовано на хірургічний плетизмографічний індекс (SPI) [20]. Він базується на вимірюванні амплітуди пульсової хвилі та RR-інтервалів. Ці два параметри нормалізуються та обробляються за допомогою унікального алгоритму, що дозволяє отримати індекс, значення якого можуть коливатися від 0 до 100.
Під час оперативних утручань SPI добре корелював із показниками варіабельності серцевого ритму [21]. Показано, що рівень SPI підвищується під час ноцицептивної стимуляції [22] та знижується при введенні опіоїдів [17, 23, 24]. X. Chen та співавт. [25] показали значне зниження кількості використаного реміфентанілу при його дозуванні на основі SPI порівняно з традиційним підходом до визначення потреби в опіатах на основі клінічної картини. При цьому паралельно знижувалась частота небажаних епізодів (рухів пацієнта, гіпертензії). Швидкість пробудження та інтенсивність післяопераційного болю були однаковими в обох групах. Інше дослідження подібного дизайну підтвердило зниження доз реміфентанілу, а також показало більш швидке пробудження при знеболюванні на основі SPI [26].
Стосовно оцінки післяопераційного болю, то SPI дещо поступався NFSC за можливістю відрізняти слабкий біль (< 3 балів за NRS) від більш інтенсивного при порівнянні цих методів [18]. Утім інше дослідження показало вищу чутливість та специфічність даного методу (67 та 69 % відповідно) [27].
Ряд факторів впливають на рівень SPI і можуть позначатися на адекватності вимірювань. До таких факторів належать волемічний статус пацієнта, локальна вазоконстрикція (гіпотермія, шок) або вазодилатація (регіонарна анестезія), зміна положення тіла (перехід у літотомічне положення), внутрішньовенне введення болюсу рідини, гіпертонічна хвороба, лікування діуретиками [22, 28, 29].
Аналіз варіабельності серцевого ритму
Варіабельність серцевого ритму є результатом симпатичної та парасимпатичної модуляції серцевого ритму. При збільшенні симпатичного впливу парасимпатичний вплив зменшується, і навпаки. Таку автономну рівновагу прийнято називати симпатовагальним балансом. Парасимпатична модуляція серцевого ритму може бути оцінена за допомогою аналізу дихального компонента варіабельності серцевого ритму. Подразнення механорецепторів легень під час вдиху (як спонтанного, так і штучного) призводить до зменшення інтервалів між комплексами QRS за рахунок зниження парасимпатичного впливу. Видих, навпаки, зменшує частоту серцевих скорочень.
В університетській лабораторії нейрофізіології м. Ліль (Франція) під керівництвом M. Jeanne було розроблено оригінальний індекс — Analgesia Nociception Index (ANI). Він розраховується за допомогою складного алгоритму з сигналу електрокардіограми та може мати значення від 0 до 100 [34]. Показано, що ANI знижується під дією ноцицептивних стимулів та є більш чутливим, ніж показники гемодинаміки [35, 36]. Під час загальної анестезії зниження індексу дозволяло прогнозувати гемодинамічну реактивність та рухи пацієнта [37, 38]. Цікаво, що під час загальної анестезії можливість ANI та SPI відображати ноцицептивну стимуляцію була приблизно однаковою [38, 39]. Значення ANI під час пробудження після загальної анестезії корелювало з інтенсивністю болю одразу після прибуття в післяопераційну палату. Рівень індексу нижче ніж 50 із чутливістю 86 % та специфічністю 86 % дозволяв відрізнити інтенсивний біль (> 3 балів) від слабкого (< 3 балів за VRS) [40].
Основною перевагою даного методу оцінки ноцицепції є простота його використання. Приваблює також відсутність впливу таких факторів, як гіповолемія, гіпотермія тощо. Серед обмежень даного методу слід згадати апное та несинусовий ритм.
Висновки
Оцінка субкортикальної активності головного мозку під час загальної анестезії є важливим компонентом забезпечення адекватного знеболювання. Протягом останнього десятиліття було розроблено декілька пристроїв, що дозволяють отримати уявлення про баланс аналгезії/ноцицепції. Ці методи ґрунтуються на визначенні стану автономної нервової системи. Оцінка шкірної провідності показала недостатню чутливість для моніторингу ноцицепції під час загальної анестезії. Вимірювання реакції зіниць, хоча й добре відображає рівень стимуляції, є дещо складною методикою для рутинного використання. Результати досліджень ANI та SPI є багатообіцяючими. Обидві технології достатньо прості у використанні. Однак залежність амплітуди пульсової хвилі від багатьох факторів, що з великою ймовірністю можуть впливати під час хірургічних утручань, потребує обережності в інтерпретації даних SPI. При оцінці інтенсивності післяопераційного болю всі описані методики показали недостатню специфічність, оскільки в пацієнтів зі збереженою свідомістю на баланс автономної нервової системи значно впливає емоційний стан.
1. Desborough J.P. The stress response to trauma and surgery // Br. J. Anaesth. — 2000. — 85. — 109-117. doi: 10.1093/bja/85.1.109
2. Roizen M.F., Horrigan R.W., Frazer B.M. Anesthetic doses blocking adrenergic (stress) and cardiovascular responses to incision — MAC-BAR // Anesthesiology. — 1981. — 54. — Р. 390-398. doi:0000542-198105000-00008
3. Monk T.G., Ding Y., White P.F. Total Intravenous Anesthesia: Effects of Opioid Versus Hypnotic Supplementation on Autonomic Responses and Recovery // Anesth. Analg. — 1992. — 75. — Р. 798-804.
4. Monk T.G., Mueller M., White P.F. Treatment of stress response during balanced anesthesia. Comparative effects of isoflurane, alfentanil, and trimethaphan // Anesthesiology. — 1992. — Jan 76 (1). — Р. 39-45. doi:0000542-199201000-00006
5. Lee M., Silverman S., Hansen H., Patel V., Manchikanti L. A Comprehensive Review of Opioid-Induced Hyperalgesia // Pain Physician. — 2011. — 14. — Р. 145-161.
6. Laulin J.P., Maurette P., Corcuff J.B., Rivat C., Chauvin M., Simonnet G. The role of ketamine in preventing fentanyl-induced hyperalgesia and subsequent acute morphone tolerance // Anesth. Analg. — 2002. — 94. — Р. 1263-1269. doi: 10.1097/00000539-200205000-00040
7. Cooper D.W., Lindsay S.L., Ryall D.M. et al. Does intrathecal fentanyl produce acute cross-tolerance to i.v. morphine? // Br. J. Anaesth. — 1997. — 78. — Р. 311-3. doi: 10.1093/bja/78.3.311
8. Guignard B., Bossard A.E., Coste C. et al. Acute opioid tolerance: intraoperative remifentanil increases postoperative pain and morphine requirement // Anesthesiology. — 2000. — 93. — Р. 409-17.
9. Fletcher D., Martinez V. Opioid-induced hyperalgesia in patients after surgery: a systematic review and a meta-analysis // Br. J. Anaesth. — 2014. — Jun.112 (6). — Р. 991-1004.
10. Joly V., Richebe P., Guignard B., Fletcher D., Maurette P., Sessler D.I., Chauvin M. Remifentanil-induced Postoperative Hyperalgesia and Its Prevention with Small-dose Ketamine // Anesthesiology. — 2005.— 103. — Р. 147-155.
11. Mao J., Mayer D.J. Spinal cord neuroplasticity following repeated opioid exposure and its relation to pathological pain // Ann. NY Acad. Sci. — 2001. — 933. — Р. 175-84.
12. Kim S.H., Stoicea N., Soghomonyan S., Bergese S.D. Intraoperative use of remifentanil and opioid induced hyperalgesia / acute opioid tolerance: systematic review // Front. Pharmacology. — 2014. — 5. — 108. doi: 10.3389/fphar.2014.00108
13. Storm H. Changes in skin conductance as a tool to monitor nociceptive stimulation and pain // Current Opinion in Anaesthesiology. — 2008. — 21. — Р. 796-804.
14. Storm H., Myre K., Rostrup M., Stokland O., Lien M.D., Raeder J.C. Skin conductance correlates with perioperative stress // Acta Anaesthesiol. Scand. — 2002. — 46. — Р. 887-895.
15. Gjerstad A.C., Storm H., Hagen R., Huiku M., Qvigstad E., Raeder J.C. Comparison of skin conductance with entropy during intubation, tetanic stimulation and emergence from general anaesthesia // Acta Anaesthesiol. Scand. — 2007. — 51. — Р. 8-15.
16. Storm H., Shafiei M., Myre K., Raeder J.C. Palmar skin conductance compared to a developed stress score and to noxious and awakening stimuli on patients in anaesthesia // Acta Anaesthesiol. Scand. — 2005. — 49. — Р. 798-803.
17. Ledowski T., Pascoe E., Ang B. еt al. Monitoring of intra-operative nociception: skin conductance and surgical stress index versus stress hormone plasma levels // Anaesthesia. — 2010. — 65. — 1001-1006. doi:10.1111/j.1365-2044.2010.06480.x
18. Ledowski T., Ang B., Schmarbeck T. et al. Monitoring of sympathetic tone to assess postoperative pain: skin conductance vs surgical stress index // Anaesthesia. — 2009. — 64. — Р. 727-731. doi:10.1111/j.1365-2044.2008.05834.x
19. Valkenburg A.J., Niehof S.P., van Dijk M., Verhaar E.J.M., Tibboel D. Skin conductance peaks could result from changes in vital parameters unrelated to pain // Pediatric Research. — 2012. — 1. — Р. 375-379. doi:10.1038/pr.2011.72
20. Huiku M., Uutela K., van Gils M. et al. Assessment of surgical stress during general anaesthesia // Br. J. Anaesth. — 2007. — 98. — Р. 447-455. doi:10.1093/bja/aem004
21. Colombo R., Raimondi F., Corona A., Rivetti I., Pagani F., Porta V.D., Guzzetti S. Comparison of the Surgical Pleth Index with autonomic nervous system modulation on cardiac activity during general anaesthesia: A randomised cross-over study // Eur. J. Anaesthesiol. — 2014. — 31 (2). — Р. 76-84. doi: 10.1097/01.EJA.0000436116.06728.b3
22. Bonhomme V., Uutela K., Hans G. et al. Comparison of the surgical Pleth Index with haemodynamic variables to assess nociception-anti-nociception balance during general anaesthesia // Br. J. Anaesth. — 2011. — 106. — Р. 101-111. doi:10.1093/bja/aeq29
23. Gruenewald M., Meybohm P., Ilies C. et al. Influence of different remifentanil concentrations on the performance of the surgical stress index to detect a standardized painful stimulus during sevoflurane anaesthesia // Br. J. Anaesth. — 2009. — 103. — Р. 586-593. doi:10.1093/bja/aep20
24. Mustola S., Parkkari T., Uutela K. et al. Performance of Surgical Stress Index during Sevoflurane-Fentanyl and Isoflurane-Fentanyl Anesthesia // Anesthesiol. Res. Pract. — 2010. — Vol. 2010. Article ID 810721, 5 pages. doi:10.1155/2010/810721
25. Chen X., Thee C., Gruenewald M. et al. Comparison of surgical stress index-guided analgesia with standard clinical practice during routine general anesthesia: a pilot study // Anesthesiology. — 2010. — 112. — Р. 1175-1183.
26. Bergmann I., Gohner A., Crozier T.A. et al. Surgical pleth index-guided remifentanil administration reduces remifentanil and propofol consumption and shortens recovery times in outpatient anaesthesia // Br. J. Anaesth. — 2013. — 110. — Р. 622-628. doi:10.1093/bja/aes426
27. Thee C., Ilies C., Gruenewald M., Kleinschmidt A., Steinfath M., Bein B. Reliability of the surgical рleth index for assessment of postoperative pain: a pilot study // Eur. J. Anaesthesiol. — 2015. — 32 (1). — Р. 44-48. doi: 10.1097/EJA.0000000000000095
28. Ilies C., Ludwigs J., Gruenewald M., Thee C., Hanf J., Hanss R., Steinfath M., Bein B. The effect of posture and anaesthetic technique on the surgical pleth index // Anaesthesia. — 2012. — 67 (5). — Р. 508-513. doi: 10.1111/j.1365-2044.2011.07051.x
29. Hans P., Verscheure S., Uutela K., Hans G., Bonhomme V. Effect of a fluid challenge on the Surgical Pleth Index during stable propofol-remifentanil anaesthesia // Acta Anaesthesiol. Scand. — 2012. — 56 (6). — 787-96. doi: 10.1111/j.1399-6576.2011.02639.x
30. Barvais L., Engelman E., Eba J.M. et al. Effect site concentrations of remifentanil and pupil response to noxious stimulation // Br. J. Anaesth. — 2003. — 91. — Р. 347-352. doi: 10.1093/bja/aeg178
31. Isnardon S., Vinclair M., Genty C. et al. Pupillometry to detect pain response during general anaesthesia following unilateral popliteal sciatic nerve block: a prospective, observational study // Eur. J. Anaesthesiol. — 2013. — 30. — Р. 429-434. doi:10.1097/EJA.0b013e32835f0030
32. Aissou M., Snauwaert A., Dupuis C. et al. Objective assessment of the immediate postoperative analgesia using pupillary reflex measurement: a prospective and observational study // Anesthesiology. — 2012. — 116. — Р. 1006-1012.
33. Guglielminotti J., Mentre F., Gaillard J. et al. Assessment of pain during labor with pupillometry: a prospective observational study // Anest. Analg. — 2013. — 116. — Р. 1057-1062. doi: 10.1213/ANE.0b013e31828a7218
34. Чумаченко Е.Д. Analgesia Nociception Index: от объективной оценки ноцицепции к оптимизации обезболивания // Клінічна анестезіологія та інтенсивна терапія. — 2014. — № 2 (4). — С. 90-102.
35. Jeanne M., Clément C., De Jonckheere J., Logier R., Tavernier B. Variations of the analgesia nociception index during general anaesthesia for laparoscopic abdominal surgery // J. Clin. Monit. Comput. — 2012. — 26 (4). — Р. 289-94. doi: 10.1007/s10877-012-9354-0
36. Jeanne M., Delecroix M., De Jonckheere J., Keribedj A., Logier R., Tavernier B. Variations of the analgesia nociception index during propofol anesthesia for total knee replacement // Clin. J. Pain. — 2014. — 30 (12). — Р. 1084-8. doi: 10.1097/AJP.0000000000000083
37. Boselli E., Bouvet L., Bégou G., Torkmani S., Allaouchiche B. Prediction of haemodynamic reactivity during total intravenous anaesthesia for suspension laryngoscopy using Analgesia/Nociception Index (ANI): a prospective observational study // Minerva Anestesiol. — 2014. Epub ahead of print.
38. Gruenewald M., Herz J., Schoenherr T., Thee C., Steinfath M., Bein B. Measurement of the Nociceptive Balance by Analgesia Nociception Index (ANI) and Surgical Pleth Index (SPI) during Sevoflurane-Remifentanil Anaesthesia // Minerva Anestesiol. — 2014. Epub ahead of print.
39. Gruenewald M., Ilies C., Herz J., Schoenherr T., Fudickar A., Hocker J., Bein B. Influence of nociceptive stimulation on analgesia nociception index (ANI) during propofol-remifentanil anaesthesia // Br. J. Anaesth. — 2013. — 110 (6). — Р. 1024-1030. doi:10.1093/bja/aet019