Журнал «Медицина неотложных состояний» 2 (65) 2015
Вернуться к номеру
Динаміка нейропсихологічних функцій та показників системної запальної відповіді в пацієнтів у відновному періоді ішемічного інсульту за умов лікування препаратом Гліатилін
Авторы: Паєнок А.В., Задорожна Б.В., Кухленко О.Я., Кухленко Р.В. — Львівський національний медичний університет ім. Данила Галицького; Кафедра невропатології та нейрохірургії ФПДО, м. Львів
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Мета дослідження — встановити ефективність препарату Гліатилін щодо динаміки неврологічного дефіциту, когнітивних порушень та рівня депресії, а також лабораторних показників запальної відповіді при використанні його у відновному періоді ішемічного інсульту поєднано з компонентами базисної терапії. Обстежено 40 пацієнтів у відновному періоді первинного церебрального ішемічного інсульту. Встановлено, що курсове лікування препаратом Гліатилін покращує стан когнітивних функцій у пацієнтів, які перенесли ішемічний інсульт, а також у хворих із післяінсультними депресивними розладами, порівняно зі стандартною терапією ефективно знижує рівень депресії за шкалою Гамільтона. Відновлювальний вплив препарату здійснюється не лише через стимулювання холінергічних систем центральної нервової системи, але й завдяки помірній протизапальній дії та здатності нормалізувати обмін оксиду азоту.
Цель исследования — установить эффективность препарата Глиатилин относительно динамики неврологического дефицита, когнитивных нарушений и уровня депрессии, а также лабораторных показателей воспалительного ответа при использовании его в восстановительном периоде ишемического инсульта в сочетании с компонентами базисной терапии. Обследовано 40 пациентов в восстановительном периоде первичного церебрального ишемического инсульта. Установлено, что курсовое лечение препаратом Глиатилин улучшает состояние когнитивных функций у пациентов, перенесших ишемический инсульт, а также у больных с постинсультными депрессивными расстройствами, в сравнении со стандартной терапией эффективно снижает уровень депрессии по шкале Гамильтона. Восстановительное влияние препарата осуществляется не только через стимулирование холинергических систем центральной нервной системы, но и благодаря умеренному противовоспалительному действию и способности нормализовать обмен оксида азота.
The purpose of the study — to establish the efficacy of Gliatilin in terms of the dynamics of neurological deficit, cognitive impairment and depression level, as well as laboratory parameters of inflammatory response when this drug was used in the recovery period of ischemic stroke in combination with the components of basic therapy. 40 patients were examined in the recovery period of primary cerebral ischemic stroke. It is found that protracted treatment with Gliatilin improves cognitive function in patients with ischemic stroke, as well as in patients with post-stroke depressive disorders, compared with standard therapy it is effective in reducing the level of depression by the Hamilton scale. Restorative effect of the drug is realized not only through the stimulation of the cholinergic system of the central nervous system, but also because of the moderate anti-inflammatory effects and ability to normalize the exchange of nitric oxide.
ішемічний інсульт, когнітивні розлади, депресія, запалення.
ишемический инсульт, когнитивные расстройства, депрессия, воспаление.
ischemic stroke, cognitive impairment, depression, inflammation.
Статья опубликована на с. 82-87
Вступ
Мозковий інсульт щорічно вражає велику кількість дорослого населення як в економічно розвинених країнах, так і в державах із перехідною економікою. За останні десятиріччя в Україні спостерігають значне зростання поширеності цереброваскулярних захворювань, особливо у пацієнтів працездатного віку [7]. Найбільш вивченими з усіх наслідків інсульту є рухові розлади, які у вигляді парезів зустрічаються в 80–90 % осіб, які перенесли інфаркт мозку, та часто поєднуються з мовними розладами, порушеннями чутливості та координації. Враховуючи, що геміпарез — найбільш поширена причина інвалідизації у неврологічних хворих, основними завданнями розроблених схем реабілітації є ефективне відновлення рухових функцій, повернення інсультного хворого до звичайного життя з максимальним відновленням фізичної активності, когнітивних функцій, стану психоемоційної сфери [21].
Інсульт нерідко призводить до порушень з боку психічних функцій, викликаючи розвиток депресії, когнітивних розладів тощо [1, 7, 12, 21]. Порушення вищої психічної діяльності також істотно впливає на хід відновного лікування і може стати серйозною перешкодою в реабілітації післяінсультних хворих [1, 12, 14, 21]. Тому стан когнітивних функцій та емоційно-вольової сфери нерідко є прогностичним критерієм відновлення хворих. Зокрема, пам’ять та увага відповідають за функціонування контролюючих систем моторної діяльності людини, до яких належать процеси планування, ініціювання, інгібування, а також самоконтроль і корекція помилок. Вони мають особливе значення для цілеспрямованої поведінки пацієнта та реагування на нові ситуації [13, 20].
У запобіганні розвитку деменції та депресії важливу роль відіграє первинна та вторинна профілактика гострих порушень мозкового кровообігу, оптимальне надання допомоги в гострий період інсульту, а також застосування нейропротекторної та нейромодулюючої терапії для підвищення процесів нейрональної пластичності у відновний період захворювання [1, 22].
Відомо, що запалення також відіграє важливу роль у патогенезі гострого та відновного періодів ішемічного інсульту, а серологічні гуморальні фактори запалення мають особливе значення у прогнозі відновлення не лише рухових функцій, але й стану вищих психічних функцій [6, 13, 22, 23]. За даними скринінгового імунологічного дослідження крові пацієнтів із резистентними до лікування формами депресій виявлено персистування ознак хронічного запалення у цих пацієнтів [12, 13]. У наших попередніх роботах був встановлений зв’язок між підвищенням гуморальних факторів запалення, прозапальних цитокінів та розвитком депресивних розладів у ранньому відновному періоді ішемічного інсульту [12]. Все частіше фармакологічні середники з нейроімуномодулюючою дією розглядають як доповнення до стандартної терапії антидепресантами у хворих із депресією, що пов’язана з органічними захворюваннями центральної нервової системи (ЦНС) [1, 22].
Відзначено, що перспективним є використання агоністів системи обміну ацетилхоліну, які як експериментально, так і в ряді клінічних досліджень довели ефективність у лікуванні неврологічного дефіциту, когнітивних розладів [8, 10]. Препарат Гліатилін — це медіаторний препарат із переважним впливом на ЦНС. До складу препарату входить 40,5 % метаболічно захищеного холіну. Метаболічний захист забезпечує вивільнення холіну в головному мозку. При надходженні до організму холіну альфосцерат розщеплюється під впливом ферментів на холін і гліцерофосфат. Холін бере участь у біосинтезі ацетилхоліну — одного з основних нейромедіаторів, гліцерофосфат є попередником фосфоліпідів (фосфатидилхоліну) мембрани нейрона. Таким чином, препарат Гліатилін посилює церебральну холінергічну провідність і позитивно впливає на пластичність нейрональних мембран [4, 5, 8, 10]. Накопичено певний досвід застосування холіну альфосцерату в пацієнтів, які перенесли гостре порушення мозкового кровообігу.
Мета нашого дослідження — встановити ефективність препарату Гліатилін щодо динаміки неврологічного дефіциту, когнітивних порушень та рівня депресії, а також лабораторних показників запальної відповіді при використанні його у відновному періоді ішемічного інсульту поєднано з компонентами базисної терапії.
Матеріали та методи
Обстежено 40 пацієнтів у відновному періоді первинного церебрального ішемічного інсульту (2–3 міс. після початку захворювання) віком від 55 до 70 років, які перебували на стаціонарному лікуванні в Комунальній міській лікарні швидкої медичної допомоги м. Львова. Пацієнти залежно від схеми лікування були розділені на дві групи: групу порівняння (n = 20) — пацієнти, які протягом стаціонарного лікування отримували стандартну терапію (аспірин, базисну терапію, поляризуючу суміш, лікування спастичності), та основну групу (n = 20) — пацієнти, які додатково до стандартної терапії отримували лікування препаратом Гліатилін у дозі 1000 мг/д внутрішньовенно протягом 14 днів [4], а потім по 1 капсулі 2 рази на день протягом 1 міс. [5]. Контрольну групу становили 20 практично здорових волонтерів.
Оцінку рівня системної запальної реакції проводили з визначенням концентрації С-реактивного білка, інтерлейкіну-6 (ІЛ-6) та показників обміну оксиду азоту в сироватці крові. Рівень сироваткового ІЛ-6 та С-реактивного білка (СРБ) визначали імуноферментним методом [2, 3]. Стан продукції оксиду азоту оцінювали за накопиченням його стабільних метаболітів (нітрит-аніону) в сироватці крові, а також за активністю індуцибельної ізоформи синтази оксиду азоту (iNOS). Концентрацію нітрит-аніону визначали спектрофотометричним методом на основі кольорової реакції з реактивом Гріса, активність iNOS — спектрофотометрично за методом Сумбаєва [11].
Рівень інвалідності та здатності хворого до самообслуговування оцінювали за допомогою індексу Бартел [9]. Оцінку когнітивного дефіциту у пацієнтів проводили за шкалою короткого дослідження психічного статусу MMSE (Mini Mental State Examination) [15] та батареєю лобної дисфункції FAB (Frontal Assessment Battery) [16], тестом малювання годинника [18]. Оцінку рівня депресивних розладів проводили з використанням шкали Гамільтона [17]. Тестування пацієнтів за обраними шкалами, лабораторні обстеження проводили до початку лікування, на 14-ту добу та через 3 міс. після початку курсу відновного лікування.
Результати та обговорення
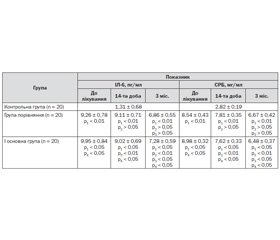
У пацієнтів обох обстежених груп у відновному періоді ішемічного інсульту спостерігали підвищені концентрації стабільних метаболітів оксиду азоту в сироватці крові порівняно зі значеннями групи контролю (p < 0,05). Слід зазначити, що концентрація нітрит-аніону в групі порівняння та основній групі до початку лікування статистично не відрізнялася (p > 0,05) (табл. 1).
На 14-ту добу лікування в обох обстежених групах спостерігалося зниження концентрації нітрит-аніону, проте статистично значущим порівняно зі значенням до лікування цей показник був лише в основній групі (p < 0,05). При порівнянні показників основної групи та групи порівняння статистично значущої різниці знайдено не було (p > 0,05). На 3-й місяць після початку відновного лікування в групі порівняння реєструвалось деяке зниження середнього значення концентрації нітрит-аніону, проте воно не було вірогідним (p > 0,05). Активність індуцибельної ізоформи синтази оксиду азоту до початку лікування не відрізнялася між досліджуваними групами (p > 0,05). На 14-ту добу спостереження середнє значення активності iNOS в основній групі було дещо нижчим, ніж у групі порівняння, проте вірогідної різниці знайдено не було (p > 0,05). На 3-й міс. у пацієнтів, які отримали додаткове курсове лікування препаратом Гліатилін, активність iNOS була суттєво нижчою, ніж у групі порівняння (p < 0,05), і становила 7,42 ± 0,30 мкмоль НАДФН2/хв • г білка, що не відрізнялося від показників контрольної групи (p > 0,05). Аналіз отриманих даних дозволяє стверджувати про здатність курсового лікування препаратом Гліатилін нормалізувати обмін оксиду азоту в пацієнтів у відновному періоді ішемічного інсульту.
Визначення гуморальних факторів запалення в динаміці виявило підвищену концентрацію прозапального інтерлейкіну-6 на початку лікування в обох групах пацієнтів, яке в групі порівняння знизилось на 14-ту добу без статистично вірогідної різниці між групами (p > 0,05), а також через 3 міс. після початку спостереження, що перевищувало показники норми в практично здорових осіб (p < 0,05). У пацієнтів основної групи рівень середніх значень концентрації ІЛ-6 у сироватці крові вірогідно не відрізнявся до початку лікування та на 14-ту добу (p > 0,05), а на 3-й місяць після початку курсового лікування препаратом Гліатилін встановлено вірогідно нижчі середні значення концентрації даного цитокіну. Аналогічна динаміка спостерігалась і щодо зміни вмісту С-реактивного білка в сироватці крові — максимальні концентрації спостерігались до початку лікування зі зниженням на 14-ту добу (p < 0,05), проте залишались вищими від значень контрольної групи. До кінця спостереження концентрація СРБ у крові пацієнтів знизилась до рівня нормальних показників і вірогідно не відрізнялась між обстеженими групами (табл. 2).
Отримані результати динаміки індексу Бартел відзначали позитивний вплив курсового лікування препаратом Гліатилін на здатність до самообслуговування, що відображено на рис. 1.
Так, до початку лікування середній бал за індексом Бартел в обох групах статистично не відрізнявся і для основної групи становив 64,05 ± 1,36, а для групи порівняння — 62,96 ± 1,22 бала (p > 0,05). Через 2 тижні від початку спостереження відзначалась тенденція до зростання індексу Бартел в обох групах (p > 0,05), а через 3 міс. у групі пацієнтів, які отримували стандартну терапію, він становив 77,23 ± 1,16 бала (у групі порівняння — 71,84 ± 1,23 бала) (p < 0,05).
Тестування пацієнтів за шкалою MMSE виявило зниження середнього бала за даною шкалою в обох обстежених групах порівняно з нормальними значеннями та відсутність між ними статистично значущої різниці: в групі порівняння середній бал становив 23,16 ± 0,62, а в основній групі — 23,77 ± 0,59 (p > 0,05) (рис. 2).
Тестування пацієнтів на 14-ту добу після початку лікування виявило тенденцію до зростання середнього бала за шкалою MMSE, який у пацієнтів основної групи був вищим, ніж у групі порівняння, проте статистично вірогідної різниці знайдено не було (p > 0,05). На 3-й місяць спостереження середній бал за шкалою MMSE в основній групі становив 28,25 ± 0,41 і був вірогідно вищим за показники групи порівняння (p < 0,01) та показники на 14-ту добу спостереження (p < 0,01). В основній групі максимальний приріст на 3-й місяць спостереження порівняно з показниками до лікування спостерігався при виконанні таких субтестів: концентрація уваги — 51 %; короткотривала пам’ять — 38 %; повторення фрази «ніяких і, якщо або але» — 28 %.
Згідно з результатами тестування за батареєю тестів лобної дисфункції, до початку лікування у пацієнтів через 3 місяці після перенесеного первинного ішемічного інсульту спостерігається виражений когнітивний дефіцит. У частини хворих (3 особи) недостатність когнітивних функцій межувала з деменцією лобного типу. До початку лікування вірогідної різниці в бальній оцінці за шкалою FAB знайдено не було; в основній групі через 2 тижні додаткового призначення препарату Гліатилін спостерігалась тенденція до покращення результатів тестування, проте вона була статистично не значущою (p > 0,05). Вірогідне покращення когнітивних функцій спостерігали в основній групі через 3 місяці після початку курсового лікування препаратом Гліатилін (рис. 3). Середній бал в основній групі становив 17,26 ± 0,71, що відповідає легкому когнітивному дефіциту, тоді як у групі пацієнтів, яким застосовували стандартну терапію, — 14,93 ± 0,64 (p < 0,01). Позитивну динаміку відновлення когнітивних функцій у пацієнтів основної групи відмічено при виконанні тесту на плинність мовлення, реакцій простого та ускладненого виборів, динамічного праксису, які відображають покращення процесів, що підтримують короткочасну пам’ять та концентрацію уваги.
Аналіз результатів оцінки тесту малювання годинника до початку лікування показав, що результати тестування за обраною шкалою вірогідно не відрізнялися в основній групі та групі порівняння (p > 0,05). У пацієнтів, які отримували курсове лікування препаратом Гліатилін, сумарний бал при повторному тестуванні на 3-й місяць зріс на 19,5 %, тоді як у пацієнтів, які отримували стандартну терапію, — лише на 8,2 % (p < 0,05) (рис. 4).
У групі пацієнтів, які отримували лікування за стандартною схемою, найбільш частою помилкою виконання тесту була неточність розташування годинної та хвилинної стрілок (52,2 %). На 14-ту добу лікування препаратом Гліатилін повторне тестування когнітивних функцій за тестом малювання годинника показало, що в основній клінічній групі ця помилка ефективно усувалася та зустрічалася лише у 7,6 % пацієнтів, а на 3-й місяць — лише у 3,2 %.
Так, аналіз динаміки відновлення когнітивних функцій в обстежених терапевтичних групах пацієнтів засвідчив, що призначення додаткового курсового лікування препаратом Гліатилін позитивно впливало на клінічний перебіг відновного періоду ішемічного інсульту та знижувало когнітивний дефіцит у пацієнтів.
За отриманими результатами оцінки рівня депресивних розладів за шкалою Гамільтона у пацієнтів обох клінічних груп на 2–3-й місяць від початку ішемічного інсульту встановлено наявність виражених депресивних розладів у 32 % пацієнтів. Вірогідної різниці між обстеженими групами до початку лікування не виявлено (p > 0,05). Повторне тестування пацієнтів на 14-ту добу перебування в стаціонарі встановило нижчий рівень оцінки ступеня депресії за шкалою Гамільтона в основній групі при порівнянні з групою порівняння, проте статистично значущої різниці між обстежуваними групами не встановлено (p > 0,05) (рис. 5).
Вірогідний регрес депресивних розладів за шкалою Гамільтона у пацієнтів основної групи спостерігали на 3-й місяць (при порівнянні з групою порівняння (p < 0,01)), хоча у більшості пацієнтів (81 %), згідно з суб’єктивною самооцінкою, зниження симптомів депресії відзначали через місяць від початку лікування препаратом Гліатилін.
Аналіз категоріальних питань за шкалою Гамільтона дозволив оцінити динаміку якісних характеристик депресивних розладів в обстежених групах хворих. Встановлено, що поява симптомів апатії та ангедонії (на 14-ту добу спостереження) корелює з розвитком середньотяжких та тяжких депресивних розладів за шкалою Гамільтона на 3-й місяць після початку ішемічного інсульту [12]. Частка пацієнтів з ангедонією до початку спостереження за хворими була низькою в обох групах (1 пацієнт), тому вона не бралася до уваги як прогностична. Згідно з проведеним аналізом, регрес вираженості симптомів апатії був більш значимий у групі пацієнтів, які отримували курсове лікування препаратом Гліатилін. Зокрема, на 14-ту добу частка пацієнтів із проявами апатії знизилась на 12,5 %, а на 3-й місяць — на 17,2 %, тоді як у пацієнтів групи порівняння на 14-ту добу частка пацієнтів з апатією знизилась на 7,2 %, а на 3-й місяць — на 8,4 %. Такий вплив препарату Гліатилін підтверджує його здатність активувати не лише когнітивні процеси, а й через стимулювання когнітивної діяльності — покращувати відновлення емоційно-вольової сфери.
Висновки
— Курсове лікування препаратом Гліатилін (у дозі 1000 мг/добу протягом 14 днів із подальшим переходом на капсульну форму в дозі 800 мг/добу протягом 3 міс.) покращує стан когнітивних функцій у пацієнтів, які перенесли ішемічний інсульт.
— Призначення курсу препарату Гліатилін хворим із післяінсультними депресивними розладами порівняно зі стандартною терапією ефективно знижує рівень депресії за шкалою Гамільтона.
— Відновлювальний вплив препарату здійснюється не лише через стимулювання холінергічних систем ЦНС, але й завдяки помірній протизапальній дії та здатності нормалізувати обмін оксиду азоту.
— Комплексний позитивний вплив препарату Гліатилін на рухову активність та здатність до самообслуговування, когнітивні функції, зниження вираженості депресивних розладів відкриває унікальні можливості у пацієнтів із судинною патологією головного мозку у відновлювальному лікуванні.
1. Гусев Е.И. Особенности депрессивного синдрома у больных, перенесших ишемический инсульт / Е.И. Гусев, А.Б. Гехт, А.Н. Боголепова и др. // Инсульт. — 2001. — № 3. — С. 28-31.
2. Инструкция по применению набора для определения интерлейкина-6 методом иммуноферментного анализа. Вектор-бест. A-8768.
3. Инструкция по применению набора для количественного определения С-реактивного белка методом иммуноферментного анализа. Вектор-бест. А-9002.
4. Інструкція для медичного застосування препарату Гліатилін розчин для ін’єкцій / Затверджена 03.03.10 наказом МОЗ України № 267. РП UA/2196/01/01.
5. Інструкція для медичного застосування препарату Гліатилін капсули / Затверджена 22.06.10 наказом МОЗ України № 500. РП UA/2196/02/01.
6. Камчатнов П.Р. Содержание нейроспецифических белков и аутоантител к ним в сыворотке крови больных с острым ишемическим инсультом / П.Р. Камчатнов, Г.Ю. Рулева, С.Ф. Дукин и др. // Журнал неврологии и психиатрии. — 2009. — № 5. — С. 69-72.
7. Мищенко Т.С. Эпидемиология цереброваскулярных заболеваний в Украине / Т.С. Мищенко // Практична ангіоневрологія. — 2009. — № 1/1. — С. 5.
8. Мищенко Т.С. Глиатилин в лечении постинсультных больных / Т.С. Мищенко, В.Н. Мищенко, И.А. Лапшина // Здоров’я України. — 2012. — № 3. — С. 36-37.
9. Наказ МОЗ України від 03.08.2012 № 602. Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при ішемічному інсульті.
10. Одинак М.М. Многоцентровое (пилотное) исследование эффективности глиатилина при остром ишемическом инсульте / М.М. Одинак, И.А. Вознюк, М.А. Пирадов, С.А. Румянцева, А.Н. Кузнецов, С.Н. Янишевский, С.Ю. Голохвастов, Н.В. Цыган // Клиническая неврология. — 2010. — Т. 4, № 1. — С. 20-27.
11. Сумбаев В.В. Влияние ДДТ на активность синтазы оксида азота в печени, легких и головном мозге крыс / В.В. Сумбаев, И.М. Ясинская // Современные проблемы токсикологии. — 2000. — № 3. — С. 3-7.
12. Шевага В.М. Особливості діагностики ранніх післяінсультних депресивних розладів / В.М. Шевага, А.В. Паєнок, Р.В. Кухленко // Клінічна та експериментальна патологія. — 2013. — № 1. — С. 119-121.
13. Шевага В.М. Стан гострофазових показників запалення та параметрів системи оксиду азоту в пацієнтів із первинним ішемічним інсультом / А.В. Паєнок, Р.В. Кухленко, О.Я. Кухленко // Практична медицина. — 2012. — № 4. — С. 96-99.
14. Caeiro L. Depression in acute stroke / L. Caeiro, J.M. Ferro, C.O. Santos et al. // J. Psychiatry Neurosci. — 2006. — Vol. 3. — P. 377-383.
15. Dubois B. The FAB: A frontal assessment battery at bedside / B. Dubois, A. Slachevsky, I. Litvan // Neurology. — 2000. — Vol. 55 — P. 1621-1626.
16. Folstein M.F. «Mini-mental state»: a practical method for grading the cognitive state of patients for the clinician / M.F. Folstein, S.E. Folstein, P.R. McHugh // J. Psychiatr. Res. — 1975. — Vol. 12. — P. 189-198.
17. Hamilton H. A rating scale for depression // J. Neurol. Neurosurg. Psychiatry. — 1969. — Vol. 23. — P. 56-62.
18. Lezak M.D. Neuropsychology assessment / M.D. Lezak // N.Y. University Press. — 1983. — P. 768.
19. Loftisa J.M. Neuroimmune mechanisms of cytokine-induced depression: Current theories and novel treatment strategies / J.M. Loftisa, M. Huckansa, B.J. Morascoa // Neurobiol. Dis. — 2010. — Vol. 37. — P. 519-533.
20. Majello B. Constitutive and IL-6-induced nuclear factors that interact with the human C-reactive protein promoter / B. Majello, R. Arcone, C. Toniatti, G. Ciliberto // EMBO J. — 1990. — Vol. 9. — P. 457-465.
21. Robinson R.G. Neuropsychiatric consequences of stroke / R.G. Robinson // Ann. Rev. Med. — 1997. — Vol. 8. — P. 217-229.
22. Wang Q. The inflammatory response in stroke / Q. Wang, X.N. Tang, M.A. Yenari // J. Neuroimmunol. — 2007. — Vol. 184. — P. 53-68.
23. Whiteley W. Blood markers for the prognosis of ischemic stroke: a systematic review / W. Whiteley, W.L. Chong, A. Sengupta, P. Sandercock // Stroke. — 2009. — Vol. 40. — P. 380-389.

/84/84.jpg)
/85/85.jpg)
/86/86.jpg)