Журнал «Медицина неотложных состояний» 2 (65) 2015
Вернуться к номеру
Клініко-імунологічні аспекти фармакологічної кардіоверсії в пацієнтів із когнітивною дисфункцією на фоні фібриляції передсердь
Авторы: Стаднік С.М. - Військово-медичний клінічний центр Західного регіону, м. Львів
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Метою даного дослідження було вивчення клініко-імунологічного статусу хворих з когнітивною дисфункцією на фоні фібриляції передсердь і ефективності аміодарону в лікуванні цих хворих. Пацієнти були розподілені на дві групи: І групу становили 46 пацієнтів, яким проводилась фармакологічна кардіоверсія аміодароном, ІІ групу — 32 пацієнти, яким відновлення синусового ритму не проводилося у зв’язку з наявністю протипоказань. Вивчали рівень астенії, показники тесту MMSE, таблиць Шульте, тесту малювання годинника, батареї тестів для оцінки лобної дисфункції, вербальних асоціацій (літеральних та категоріальних), проби на запам’ятовування 12 слів із безпосереднім відтворенням. Рівні прозапальних цитокінів (IL-6, TNF-α) і С-реактивного білка визначали методом імуноферментного аналізу. Після проведеного лікування в пацієнтів І групи показники нейрокогнітивних функцій були кращіми, ніж у пацієнтів ІІ групи. Зниження рівня прозапальних цитокінів у пацієнтів І групи було статистично значущим. Фармакологічна кардіоверсія аміодароном істотно впливає на корекцію нейропсихологічної сфери, покращуючи стан пацієнтів з фібриляцією передсердь і підвищуючи якість їх життя. Відновлення синусового ритму в пацієнтів із фібриляцією передсердь супроводжується зниженням активності системного запалення.
Целью настоящего исследования было изучение клинико-иммунологического статуса больных с когнитивной дисфункцией на фоне фибрилляции предсердий и эффективности амиодарона в лечении этих больных. Пациенты были разделены на две группы: І группу составили 46 пациентов, которым проводилась фармакологическая кардиоверсия амиодароном, ІІ группу — 32 пациента, которым восстановление синусового ритма не проводилось в связи с наличием противопоказаний. Изучали уровень астении, показатели теста MMSE, таблиц Шульте, теста рисования часов, батареи тестов для оценки лобной дисфункции, вербальных ассоциаций (литеральных и категориальных), пробы на запоминание 12 слов с непосредственным воспроизведением. Уровни провоспалительных цитокинов (IL-6, TNF-α) и С-реактивного белка определяли методом иммуноферментного анализа. После проведенного лечения у пациентов І группы показатели нейрокогнитивных функций были лучше, чем у пациентов ІІ группы. Снижение уровня провоспалительных цитокинов у пациентов І группы было статистически значимо. Фармакологическая кардиоверсия амиодароном существенно влияет на коррекцию нейропсихологической сферы, улучшая состояние пациентов с фибрилляцией предсердий и повышая качество их жизни. Восстановление синусового ритма у пациентов с фибрилляцией предсердий сопровождается снижением активности системного воспаления.
The objective of this study was to investigate the clinical and immunological status of patients with cognitive dysfunction on the background of atrial fibrillation and efficacy of amiodarone when treating such patients. The patients were divided into two groups: I group consisted of 46 patients who underwent pharmacological cardioversion with amiodarone, ІІ group — of 32 patients in whom sinus rhythm was not restored due to contraindications. We have studied the level of asthenia, MMSE test performance, Schulte tables, clock drawing test, Frontal Assessment Battery, verbal associations (regular and categorical), test of 12 words that are shown for immediate recall. The levels of proinflammatory cytokines (IL-6, TNF-α) and C-reactive protein were determined by enzyme-linked immunosorbent assay. After treatment in patients from І group neurocognitive performance was better than in patients of ІІ group. Reduced levels of proinflammatory cytokines in patients of І group were statistically significant. Pharmacological cardioversion with amiodarone significantly affect the correction of neuropsychological functions, improving the condition of patients with atrial fibrillation and quality of their life. Restoration of sinus rhythm in patients with atrial fibrillation is accompanied by decreased activity of systemic inflammation.
фібриляція передсердь, когнітивна дисфункція, прозапальні цитокіни, фармакологічна кардіоверсія.
фибрилляция предсердий, когнитивная дисфункция, провоспалительные цитокины, фармакологическая кардиоверсия.
atrial fibrillation, cognitive dysfunction, proinflammatory cytokines, pharmacological cardioversion.
Статья опубликована на с. 92-97
Демографічні тенденції останніх років, пов’язані зі збільшенням тривалості життя, надають особливу актуальність проблемі когнітивних розладів (КР). Поширеність КР у різних популяціях не однакова. Крім того, при статистичному аналізі наводяться дані про чисельність пацієнтів як з помірними, так і з легкими КР. Раніше було встановлено, що серцево-судинні захворювання, зокрема порушення ритму, асоційовані з КР та деменцією. Проте патогенез формування когнітивної дисфункції у хворих із порушеннями серцевого ритму залишається не цілком зрозумілим. Украй важливою є проблема ранньої діагностики когнітивної дисфункції при цих станах [5, 12].
Суттєву роль у розвитку когнітивного дефіциту відіграють порушення серцевого ритму. Особлива увага в літературі приділяється ролі фібриляції передсердь (ФП). ФП діагностують у 1 % дорослого населення [11]. Понад 6 мільйонів європейців страждають від цієї аритмії. Поширеність ФП, за попередніми оцінками, зросте у 2 рази упродовж наступних 50 років. За своєю медико-соціальною значимістю ФП суттєво випереджає інші види кардіальних аритмій, що пов’язано не лише з її поширеністю, але й з тяжкістю обумовлених нею органних ускладнень, асоційованих зі значними моральними та матеріальними витратами. Розвиток хронічної серцевої недостатності, збільшення ризику раптової серцевої смерті, емболічні церебральні ускладнення, погіршення перебігу постінсультного періоду, стійка інвалідизація, низька виживаність — усе перераховане є наслідком втрати синусового ритму [7]. ФП дає п’ятиразове збільшення ризику інсульту, і один з кожних п’яти інсультів пов’язаний з цією аритмією. Ішемічні інсульти при ФП часто мають смертельний наслідок, а пацієнти, які вижили, мають вищий відсоток інвалідизації та частіше страждають від рецидивів, ніж пацієнти з іншими причинами інсульту. Разом з тим сама специфіка хвороби (клінічні прояви, наслідки, характер лікування) визначає її істотний вплив на актуальну життєву ситуацію, інтелект та систему особистісних стосунків хворого [1]. ФП вважається чинником, пов’язаним як із КР, що розвиваються в результаті перенесеного інсульту, так і з тими, що не пов’язані з гострими порушеннями мозкового кровообігу [3, 13, 14].
У даний час не викликає сумнівів наявність зв’язку між ФП та активністю системного запалення [9]. Показано, наприклад, що рівень С-реактивного білка (СРБ) у хворих з персистуючою ФП вищій, ніж у хворих з пароксизмальною формою аритмії, і в обох групах він був вищім, ніж у пацієнтів із синусовим ритмом (СР) [8]. Однак питання про причини розвитку системного запалення у хворих із ФП залишається відкритим. Не ясно, чи системне запалення є наслідком ФП, чи наслідком захворювання, що призвело до розвитку аритмії.
Прозапальні цитокіни є маркерами не тільки ФП, але й ризику розвитку хронічної ішемії мозку. Істотне значення в патогенезі когнітивних розладів мають імунологічні механізми. Провідна роль у розвитку когнітивного дефіциту належить локальному запаленню, мікроциркуляторним порушенням, пошкодженню гематоенцефалічного бар’єра й автоімунній агресії. Остання супроводжується втратою імунної толерантності, активацією клітинного й гуморального імунітету, що призводить до утворення та збільшення кількості як органоспецифічних антитіл (антитіла до основного білка мієліну й фактора росту нервів), так і органонеспецифічних [4]. Велику роль у формуванні когнітивної дисфункції відіграть прозапальні цитокіни (TNF, IL-6), їх вплив призводить до загибелі нейронів і глії, а також до набряку мозкової тканини, посилюючи при цьому клінічну картину. Запуск і розгортання відстроченої загибелі нейронів індукуються активованою мікроглією, що починає секретувати прозапальні цитокіни. Останні впливають на ендотелій судин і запускають міграцію лейкоцитів із судинного русла в ішемізовану тканину мозку [4].
Розуміння механізмів розвитку КР та деменції у хворих із ФП є вкрай важливим, оскільки без знання таких механізмів, мабуть, не можна ефективно запобігати їх розвитку. Серед найбільш вірогідних патофізіологічних механізмів взаємозв’язку ФП і деменції виділяють «німі» тромбоемболічні церебральні ішемії, а також церебральну гіпоперфузію в результаті коливання серцевого викиду. Можна припустити й деякі інші механізми [10, 17]. Зокрема, на розвиток КР у хворих з ФП впливають такі чинники, як варіабельність скорочення шлуночків та знижений хвилинний об’єм серця, що обумовлюють гіпоперфузію головного мозку. Ще один механізм може бути пов’язаний із підвищеним рівнем запалення, що визначається у хворих з ФП, а також ушкодженням перивентрикулярної білої речовини головного мозку. Відмічено, що КР знижують прихильність до антикоагулянтної терапії, що, у свою чергу, за механізмом порочного кола збільшує вірогідність тромбоемболічних ускладнень та подальшого когнітивного зниження [16].
Відновлення синусового ритму при ФП можна досягти за допомогою ліків або електричних розрядів. Фармакологічна кардіоверсія більш популярна, ніж електрична, оскільки її простіше виконати. Першою лінією в лікуванні хворих із ФП залишається антиаритмічна терапія (ААТ). Частота рецидивування ФП на тлі підтримуючої ААТ становить до 60–70 % за рік. Відомо, що ймовірність відновлення СР та його утримання залежать від тривалості аритмії, віку пацієнтів, розміру лівого передсердя.
В Україні вибір антиаритміків для кардіоверсії обмежується в основному аміодароном (внутрішньовенно й всередину). Аміодарон за основними електрофізіологічними властивостями належить до антиаритмічних препаратів ІІІ класу, загальною властивістю яких є здатність інактивувати калієві канали в мембрані кардіоміоцитів і таким чином подовжувати трансмембранний потенціал дії. Діапазон електрофізіологічних ефектів аміодарону набагато ширший, ніж у «чистих», або селективних, ААП ІІІ класу. При внутрішньовенному введенні аміодарон відновлює синусовий ритм приблизно в 60–70 % хворих із ФП.
У науковій літературі практично не зустрічаються роботи, присвячені дослідженню динаміки когнітивних розладів та активності системного запалення у пацієнтів з ФП у результаті проведення фармакологічної кардіоверсії. Це послужило підставою для проведення нашого дослідження.
Метою дослідження було вивчення клініко-імунологічного статусу хворих з когнітивною дисфункцією на тлі ФП і ефективності аміодарону в лікуванні цих хворих.
Матеріал і методи дослідження
У дослідження були включені 78 хворих з ФП, які перебували у кардіологічній клініці Військово-медичного клінічного центру Західного регіону, м. Львів. Серед них було 56 (71,8 %) чоловіків і 22 (28,2 %) жінки, середній вік яких становив 64,3 ± 3,7 року. Клінічне дослідження проводили відповідно до принципів Гельсінської декларації (останнього перегляду) і вимог якісної клінічної практики. У всіх пацієнтів перед включенням у дослідження була отримана інформована згода. У дослідження не включали пацієнтів із наявністю тяжкої соматичної патології, мнестико-інтелектуальних порушень за МMSE менше за 24 бали, психічних розладів, наявністю наркотичної або алкогольної залежності, протипоказаннями до прийому аміодарону та алергічними реакціями на препарат. Протокол дослідження включав період «вимивання» — за 14 днів до включення відмінялись ноотропні, судинні препарати. На момент дослідження пацієнти отримували терапію, що включала за показаннями антигіпертензивні й антитромботичні препарати.
Пацієнти були розподілені на дві групи: І група включала з 46 пацієнтів, яким проводилася фармакологічна кардіоверсія аміодароном (доза 300 мг на 200,0 мл 0,9% фізіологічного розчину внутрішньовенно до відновлення синусового ритму), у подальшому пацієнти отримували підтримуючу терапію аміодароном (по 200 мг 3 рази на добу); у ІІ групу увійшли 32 хворі, яким відновлення синусового ритму не проводилось у зв’язку із наявністю протипоказань. Ці пацієнти отримували лише базисну терапію, направлену на досягнення нормосистолії.
Усім хворим проводили клініко-неврологічне та імунологічне обстеження, електрокардіографію. Вираженість астенічного синдрому вимірювали за шкалою оцінки рівня астенізації. Оцінку стану когнітивних функцій проводили з використанням Mini-Mental State Examination (MMSE), тесту малювання годинника (ТМГ), батареї тестів для оцінки лобної дисфункції (БТЛД), проби Шульте, вербальних асоціацій (літеральних і категоріальних), проби на запам’ятовування 12 слів з безпосереднім відтворенням [2].
Рівень прозапальних цитокінів (IL-6, TNF-α) та концентрацію СРБ визначали методом імуноферментного аналізу з використанням стандартних тест-систем. Досліджували сироватку крові, що в кількості 5,0 мл брали вранці натще з кубітальної вени.
До кардіоверсії й через 30 днів після відновлення синусового ритму всім пацієнтам проводили повторне дослідження когнітивних функцій та визначення в плазмі крові рівня IL-6, TNF-α, СРБ.
Отримані результати обробляли статистично з використанням пакетів прикладних програм Statistica 5.5 for Windows, Microsoft Office Excel 2010. Статистичну значимість відмінностей між середніми значеннями показників у групах оцінювали за допомогою t-критерію Стьюдента.
Результати та їх обговорення
Клінічна картина ФП складалася з суб’єктивних та об’єктивних симптомів. Суб’єктивні симптоми характеризувалися астенічним синдромом — загальна слабкість, підвищена втомлюваність, зниження працездатності, емоційна лабільність, тривожність, порушення концентрації уваги. Часто виявлявся цефалгічний синдром, причому головні болі мали характер напруження (стискаючі, за типом «тісного головного убору») або ішемічно-гипоксичний характер (відчуття «важкої» голови і неможливість зосередитися).
Об’єктивні симптоми характеризувалися верхньостовбуровою симптоматикою (анізокорія, порушення акту конвергенції, симптоми пірамідної недостатності) і вестибулоатаксичним синдромом у вигляді запаморочення, нестійкості при ходьбі, порушення при виконанні проб на координацію. Зазначені прояви поєднувалися з розладами когнітивних функцій: порушенням пам’яті, уваги, уповільненням мислення.
Основними суб’єктивними клінічними проявами в обстежених хворих були головний біль, запаморочення, порушення в емоційній сфері, погіршення пам’яті й здатності до навчання, зниження працездатності, що поступово призводять до дезадаптації (табл. 1).
При дослідженні рівня астенії на 30-й день лікування виявили динаміку показників, що дорівнювала 19,2 % в I групі та 9,6 % — у II групі (р < 0,05). Після успішної фармакологічної кардіоверсії спостерігали вірогідне покращення когнітивних функцій за даними МMSE і БТЛД у пацієнтів із ФП (табл. 2).
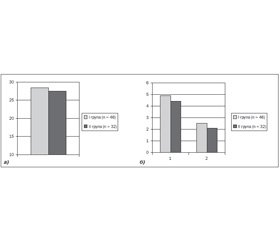
Порівняння динаміки показників загального сумарного балу за шкалою MMSE і субтестів «Серійний рахунок» і «Пам’ять» на тлі лікування (рис. 1) виявило, що позитивна динаміка показників у хворих І групи статистично вірогідно відрізняється від аналогічних показників ІІ групи (p < 0,05). Відзначали покращення концентрації уваги й рахунку (4,9 ± 0,2 і 4,4 ± 0,5 відповідно, р < 0,05), пам’яті (2,5 ± 0,5 і 2,1 ± 0,7 відповідно, р < 0,05), мовленнєвих функцій (9 ± 0 і 8,6 ± 0,8 відповідно, р < 0,05).
Після проведеної терапії аналіз темпу сенсомоторних реакцій і уваги за таблицями Шульте показав зменшення середнього витраченого часу на 9,2 % (з 195 до 177 с) в I групі (р < 0,01) і лише на 1 % — у ІІ групі (з 238,7 до 236 с). Порівняння результатів на тлі лікування між досліджуваними групами встановило, що динаміка показників ефективності роботи, ступеня впрацьованості, психічної стійкості у хворих І групи вірогідно відрізняється від динаміки цих показників у ІІ групі (p < 0,05), що показано на рис. 2.
Зменшувалась вираженість лобної дисфункції за даними БТЛД у пробах на концептуалізацію (2,4 ± 0,6 і 3,0 ± 0 відповідно, р < 0,05), побіжність мовлення (2,4 ± 0,6 і 2,7 ± 0,5 відповідно, р < 0,05), динамічний праксис (2,5 ± 0,6 і 2,9 ± 0,4 відповідно, р < 0,05 ), просту й ускладнену реакцію вибору (2,5 ± 0,6 і 2,8 ± 0,4; 1,8 ± 0,6 і 2,4 ± 0,5 відповідно, р < 0,05). Встановлено збільшення об’єму літеральних і категоріальних асоціацій (9,1 ± 2,7 і 10,8 ± 2,4; 12,3 ± 3,3 і 14,9 ± 2,9 відповідно, р < 0,05), покращувалась пам’ять за даними проби на запам’ятовування 12 слів (7,5 ± 2,1 і 9,9 ± 1,4 відповідно, р < 0,05). Когнітивні функції пацієнтів ІІ групи вірогідно не змінювались.
Рівень основного прозапального цитокіну IL-6 у пацієнтів I групи до лікування дорівнював 14,3 ± 0,9 пг/мл, після лікування — 12,0 ± 0,6 пг/мл (р < 0,05). У хворих групи II рівень IL-6 до лікування становив 14,5 ± 0,7 пг/мл, а після лікування — 13,2 ± 0,6 пг/мл, тобто відмінності були статистично незначимими. Рівень TNF-α у периферичній крові у хворих I групи до лікування дорівнював 12,0 ± 0,8 пг/мл, а після лікування — 8,8 ± 0,3 пг/мл (р < 0,01).
У II групі до лікування рівень TNF-α становив 11,8 ± 0,7 пг/мл, після лікування — 10,2 ± 0,6 пг/мл (табл. 3).
У І групі відзначали статистично значуще зниження рівня прозапальних цитокінів, що свідчить про важливість відновлення синусового ритму. Співвідношення IL-6/TNF-α у хворих I групи до лікування становило 1,19, а після лікування — 1,36; у II групі —1,23 та 1,29 відповідно.
При використанні аміодарону як антиаритмічного препарату отримали добрий клінічний ефект, що поєднувалося зі статистично значущим зменшенням вироблення прозапальних цитокінів (TNF-α, IL-6) та СРБ. Відновлення синусового ритму призводило до зниження рівня прозапальних цитокінів, що вказує на зменшення активності імунного запалення.
Зменшення проявів серцевої недостатності після відновлення синусового ритму у хворих з ФП супроводжувалося зниженням СРБ на 2,40 ± 0,37 мг/л (46 %), TNF-α — на 2,06 ± 0,43 пг/мл (34 %), IL-6 — на 2,15 ± 0,48 пг/мл (35 %).
Вивчення рівнів цитокінів при когнітивній дисфункції на фоні ФП дає інформацію про функціональну активність різних типів імунокомпетентних клітин, що дозволяє оцінити динаміку імунопатологічного процесу та перебігу захворювання.
Отже, важливу роль у патогенезі когнітивної дисфункції при ФП відіграють імунологічні та нейротрофічні механізми, зокрема локальне запалення, мікроциркуляторні порушення, пошкодження гематоенцефалічного бар’єра й автоімунна агресія. Автоімунний процес посилює когнітивну дисфункцію та сприяє прогресуванню когнітивних розладів.
Висновки
Проведений клініко-імунологічний порівняльний аналіз показав, що фармакологічна кардіоверсія аміодароном є ефективною в пацієнтів із когнітивною дисфункцією на тлі ФП. Фармакологічна кардіоверсія істотно впливає на корекцію нейропсихологічної сфери, покращуючи стан хворих з ФП і підвищуючи якість їх життя.
Позитивна клінічна динаміка в процесі фармакологічної кардіоверсії при ФП поєднується із статистично значущим зниженням вмісту прозапальних цитокінів (TNF-α, IL-6) і СРБ. У процесі лікування отримана більш виражена позитивна динаміка рівнів усіх досліджуваних прозапальних цитокінів у хворих, яким проводилася фармакологічна кардіоверсія, порівняно з групою пацієнтів без такої.
Продемонстрований у даному дослідженні сприятливий вплив аміодарону на когнітивні функції в пацієнтів з ФП дозволяє розцінювати даний препарат не тільки як ефективний антиаритмічний засіб, але й як засіб, що дозволяє зменшити прогресування когнітивних розладів та ризик розвитку деменції в цих пацієнтів.
1. Алехин А.Н. Психологические проблемы в аритмологии (на модели фибрилляции предсердий) / А.Н. Алехин, Е.А. Трифонова, Д.С. Лебедев // Вестник аритмологии. — 2011. — № 63. — С. 45–54.
2. Белова А.Н. Шкалы, тесты и опросники в неврологии и нейрохирургии / А.Н. Белова. — М., 2004. — 432 с.
3. Гусев Е.И. Ишемия головного мозга / Е.И. Гусев, В.И. Скворцова. — М.: Медицина, 2001. — 328 с.
4. Кетлинский С.А., Симбирцев А.С. Цитокины / С.А. Кетлинский, А.С. Симбирцев. — СПб.: Фолиант, 2008. — 552 с.
5. Крятова Т.В. Особенности обследования и лечения больных с фибрилляцией предсердий, страдающих нозогениями: Автореф. дис... канд. мед. наук.: спец. 14.01.05 — «Кардиология» / Т.В. Крятова. — СПб., 2010. — 20 с.
6. Скворцова В.И. Участие аутоиммунных механизмов в развитии ишемического повреждения головного мозга / В.И. Скворцова // Журн. неврологии и психиатрии. — 2005. — Т. 105, № 8. — С. 36–40.
7. Cуслина З.А. Практическая кардионеврология / З.А. Cуслина, А.В. Фонякин, Л.А. Гераскина, В.Вл. Машин, Е.С. Трунова, В.В. Машин, М.В. Глебов. — М.: ИМА-пресс, 2010. — С. 205–207.
8. Anderson J.L. Frequency of elevation of C-reactive protein in atrial fibrillation / J.L. Anderson, C.A. Maycock, D. Lappe // Am. J. Cardiol. — 2004. — Vol. 94. — Р. 1255–1259.
9. Aviles R.J., Martin D.O., Apperson-Hansen C. Infiammation as a rick factor for atrial fibrillation / R.J. Aviles, D.O. Martin, С. Apperson-Hansen // Circulation. — 2003. — Vol. 108 (24). — Р. 3006–3010.
10. Kalantarian S. Cognitive Impairment Associated With Atrial Fibrillation: A Meta-analysis / S. Kalantarian, Т.А. Stern, М. Mansour, J.N. Ruskin // Ann. Intern. Med. — 2013. — Vol. 158. — Р. 338–346.
11. Kannel W.B. Prevalence, incidence, prognosis and predisposing conditions for atrial fi brillation: population-based estimates / W.B. Kannel, Р.А. Wolf, Е.J. Benjamin // Am. J. Cardiol. — 1998. — Vol. 82 (8A). — P. 2–9.
12. O’Brien J.T. Vascular cognitive impairment / J.T. O’Brien, T. Erkinjuntti, B. Reisberg // Lancet Neurology. — 2003. — Vol. 2. — Р. 89–98.
13. Ott A. Atrial fibrillation and dementia in a population-based study. The Rotterdam Study / А. Ott, М.М. Breteler, М.С. de Bruyne, F. van Harskamp, D.E. Grobbee, А. Hofman // Stroke. — 1997. — Vol. 28 (2). — Р. 316–321.
14. Sabatini T. Regarding atrial fibrillation and cognitive function in older people / Т. Sabatini, G.B. Frisoni, P. Barbisoni, G. Bellelli, R. Rozzini, M. Trabucchi // J. Am. Geriatr. Soc. — 2000. — Vol. 48. — P. 387–390.
15. Schmidtke K. Cerebral small vessel disease: how does it progress? / K. Schmidtke, M. Hull // J. Neurol. Sci. — 2005. — Vol. 229/230. — P. 13–20.
16. Van Deelen B.A. Cognitive impairment as determinant for sub-optimal control of oral anticoagulation treatment in elderly patients with atrial fibrillation / В.А. Van Deelen, Р.М. van den Bemt, Т.С. Egberts // Drugs Aging. — 2005. — Vol. 22, № 4. — P. 353–360.
17. Zito M. Silent lacunar infarcts in erderly with chronic nonvalvular atrial fibrillation / M. Zito, A. Muscari, E. Marini // Aging. Clin. Exp. Res. — 1996. — Vol. 8. — P. 341–346.

/94/94.jpg)
/95/95.jpg)
/96/96.jpg)