Журнал «Медицина неотложных состояний» 2 (65) 2015
Вернуться к номеру
Вплив метоклопраміду та L-аргініну на показники моторно-евакуаторної функції ШКТ та гемодинаміку після невідкладних абдомінальних операцій
Авторы: Новицька-Усенко Л.В. — ДЗ «Дніпропетровська медична академія» МОЗ України; Дьомін С.Г. — КЗ «Дніпропетровська шоста міська клінічна лікарня» ДОР
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Мета роботи: оцінити вплив післяопераційно призначеного метоклопраміду та L-аргініну на показники моторно-евакуаторної функції шлунково-кишкового тракту (ШКТ) та гемодинаміку після невідкладних абдомінальних операцій.
Результати. У статті наведені дані про використання метоклопраміду та L-аргініну для профілактики розвитку післяопераційних порушень моторики кишечника. Доведено, що використання L-аргініну призводить до зменшення явищ периферичного вазоспазму, що, покращуючи мікроциркуляцію стінки кишки, сприяє більш швидкому відновленню моторно-евакуаторної функції ШКТ.
Цель работы: оценить влияние послеоперационно назначенных метоклопрамида и L-аргинина на показатели моторно-эвакуаторной функции желудочно-кишечного тракта (ЖКТ) и гемодинамику после неотложных абдоминальных операций.
Результаты. В статье приводятся данные об использовании метоклопрамида и L-аргинина для профилактики развития послеоперационных нарушений моторики кишечника. Доказано, что использование L-аргинина приводит к уменьшению явлений периферического вазоспазма, что, улучшая микроциркуляцию стенки кишки, способствует более быстрому восстановлению моторно-эвакуаторной функции ЖКТ.
Objective of the study: to assess the effect of postoperative metoclopramide and L-arginine administration on the performance of motor-evacuation function of the gastrointestinal tract and on hemodynamics after urgent abdominal surgeries.
Results. The article presents data on the use of metoclopramide and L-arginine to prevent postoperative gastrointestinal dysmotility. It is proved that the use of L-arginine leads to a decrease in peripheral vasospasm phenomena that, improving microcirculation of the intestinal wall, resulting in a more rapid recovery of the motor-evacuation function of the gastrointestinal tract.
післяопераційні порушення моторики шлунково-кишкового тракту, L-аргінін, гемодинаміка.
послеоперационные нарушения моторики желудочно-кишечного тракта, L-аргинин, гемодинамика.
postoperative gastrointestinal dysmotility, L-arginine, hemodynamics.
Статья опубликована на с. 98-103
Вступ
Моторно-евакуаторна дисфункція шлунково-кишкового тракту (ШКТ) дуже поширена в післяопераційному періоді і виникає не тільки після великих операцій на черевній порожнині, заочеревинному просторі, гінекологічних, урологічних операцій, а і після невеликих за обсягом оперативних втручань, у тому числі виконаних лапароскопічно [13, 15]. Наслідки розвитку післяопераційних порушень моторики шлунково-кишкового тракту істотно збільшують тривалість перебування в стаціонарі, мають несприятливий вплив на наслідки захворювання та підвищують вартість лікування [11]. В Україні для медикаментозної профілактики їх розвитку використовується метоклопрамід та неостигмін, призначення яких регламентовано Наказом МОЗ України № 297 від 02.04.2010 «Про затвердження стандартів та клінічних протоколів надання медичної допомоги зі спеціальності «Хірургія». Проте застосування агоністів ацетилхоліну супроводжується великою кількістю побічних ефектів, зокрема таких як розвиток брадикардії, провокація розвитку атріовентрикулярної блокади, подовження інтервалу Q-T, екстрасистолія, шлуночкова тахікардія, тріпотіння та фібриляція шлуночків, гіпотензія, бронхоспазм, бронхорея, гіперсалівація, підвищена пітливість, гіперемія обличчя, спастичні болі в животі, затримка сечовипускання [1, 2, 6, 7], а перевищення добової дози 1,5 мг (у тому числі за рахунок неодноразового введення) може призвести до пригнічення моторної активності кишечника [10].
У літературі останніх років з’явилися відомості про універсальний регулятор клітинного та тканинного метаболізму — оксид азоту. Науковий інтерес до оксиду азоту (NO) обумовлений насамперед тим, що він бере участь у регуляції багатьох функцій, таких як судинний тонус, серцева скоротливість, агрегація тромбоцитів, нейротрансмісія, синтез аденозинтрифосфорної кислоти та білка, модулює імунну відповідь [3, 8].
При перитоніті відбувається зниження рівня кровотоку по мікроциркуляторному руслу в пошкодженому відділі ШКТ. При цьому зміни регуляції мікроциркуляції присутні як на органному рівні, так і на периферії в цілому. Зміни модуляції кровотоку кишечника розвиваються після порушення процесів транскапілярного обміну на периферії, що призводить до посилення вазомоторного компонента регуляції, зміни пре- та посткапілярного опору, що викликає порушення мікроциркуляції та перфузії стінки кишки [4]. L-аргінін, виступаючи в ролі попередника NO, може модулювати імунну відповідь організму, зменшуючи експресію прозапального IL-8 та клітинних молекул адгезії у хірургічних хворих [16], а збагачене на L-аргінін парентеральне харчування підтримувало захист очеревини та покращувало наслідки лікування у хворих із перитонітом [14].
Позитивний вплив L-аргініну на відновлення функції ендотелію при ішемічно-реперфузійному ураженні кишечника [12, 16] та слизової оболонки шлунка, можливість покращувати адаптацію організму після резекції тонкої кишки [5], а також участь L-аргініну у підтриманні тонусу шлунка та модуляції транзиту нутрієнтів по різних відділах кишечника [9] стали підставою для його застосування в нашому дослідженні.
Мета дослідження: оцінити вплив післяопераційно призначеного метоклопраміду та L-аргініну (Тівортін, «Юрія-Фарм», Україна) на показники моторно-евакуаторної функції ШКТ, гемодинаміку та маркери запалення після невідкладних абдомінальних операцій.
Матеріали й методи
До дослідження був включений 51 хворий, яким у КЗ «Дніпропетровська шоста міська клінічна лікарня» ДОР проводилися невідкладні оперативні втручання з приводу защемлених кил, гострої кишкової непрохідності, перфорації виразок дванадцятипалої кишки з поширеним перитонітом. Залежно від медикаментозної профілактики післяопераційних порушень моторики ШКТ хворі були розділені на 2 групи. Хворим 1-ї групи (n = 27) у післяопераційному періоді проводилася стандартна медикаментозна корекція моторно-евакуаторної функції ШКТ метоклопрамідом та неостигміном (прозерин). Хворим 2-ї групи (n = 24) для медикаментозної профілактики розвитку післяопераційних порушень моторики ШКТ призначали метоклопрамід та L-аргінін.
Для оцінки моторно-евакуаторної функції ШКТ ми використовували значення внутрішньочеревного тиску (ВЧТ), вимірювання якого проводили непрямим методом шляхом реєстрації тиску в сечовому міхурі. Результат, отриманий у см Н2О, переводили в мм рт.ст. за формулою: 1 мм рт.ст. = 1,36 см Н2О. Перфузійний тиск (ПТ) у черевній порожнині розраховували за формулою:
ПТ = САТ – ВЧТ,
де САТ — середній артеріальний тиск.
Визначали частоту здуття живота, відчуття нудоти, блювання, затримки відходження газів, початок самостійного відходження газів та час першої самостійної дефекації. Реєстрацію показників центральної гемодинаміки та хронокардіометричних показників здійснювали реоплетизмографом DX-NT Regina 2000 (Україна), що з’єднаний із персональним комп’ютером. Величину внутрішньочеревного тиску вивчали до операції, через 1, 2 і 3 доби після неї. Параметри гемодинаміки реєстрували на 4 етапах: до операції, через 1, 3 і 7 діб після неї. Прикінцевими результатами лікування були: тривалість перебування у ВАІТ, тривалість перебування в стаціонарі, летальність у ВАІТ, летальність у стаціонарі, строки відновлення самостійного відходження газів та строки відновлення самостійної дефекації. Кінцевою точкою дослідження була 28-ма доба після оперативного втручання, коли ми оцінювали загальну летальність та кількість осіб, які досягли VIII рівня якості життя за шкалою RLAS (Rancho Los Amigos Scale).
Для встановлення регіональних особливостей обстежено 15 здорових добровольців віком від 20 до 60 років (середній вік — 30,3 ± 5,3 року). Показники здорових добровольців були прийняті за норму.
Статистична обробка отриманих даних проводилась за допомогою пакету програм Statistica v8.0. Етичні аспекти роботи затверджені на засіданні комісії з питань біомедичної етики ДЗ «Дніпропетровська медична академія» МОЗ України (протокол № 2 від 25.01.2011 р.).
Результати та їх обговорення
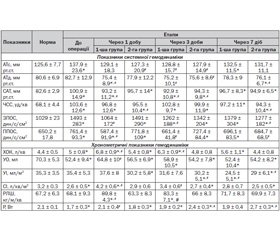
Для досягнення поставленої мети ми провели аналіз змін указаних показників при надходженні хворих до стаціонару. Встановлено, що розвиток запальних процесів у черевній порожнині супроводжувався порушенням моторно-евакуаторної функції ШКТ. У 53,4 % обстежених перед операцією ми спостерігали затримку відходження газів, у 68,9 % була наявна нудота, у 31 % — блювання. Підвищення ВЧТ ми спостерігали у 63,1 % хворих, при цьому значення внутрішньочеревного тиску перевищувало верхню межу норми на 58,5 % (р < 0,001). Перфузійний тиск у черевній порожнині лишався в межах норми. Підвищення ВЧТ супроводжувалося гемодинамічними змінами. Аналіз показників гемодинаміки до операції показав, що на тлі незначного зростання систолічного артеріального тиску (АТс) та середнього артеріального тиску спостерігалося збільшення загального периферичного опору судин (ЗПОС) — на 45,1 % (р < 0,001) та питомого периферичного опору судин (ППОС) — на 17,1 % (р < 0,001) понад норму. При цьому ударний об’єм (УО) був меншим за норму на 34,2 % (р < 0,001). Збільшення постнавантаження супроводжувалося підвищенням хвилинного об’єму кровообігу (ХОК) на 13,6 % (р = 0,034) понад норму за рахунок збільшення частоти серцевих скорочень (ЧСС), величина якої на 52,2 % (р < 0,001) перевищувала норму. Це призводило до зменшення потужності лівого шлуночка (Р) на 23,5 % (р < 0,001) відносно норми. У цілому тип гемодинаміки до операції відповідав помірно-нормодинамічному. Через 1 добу після операції затримка відходження газів, здуття живота та відчуття переповнення в животі мали місце в абсолютної більшості хворих обох груп, що вказувало на розвиток післяопераційних порушень моторики ШКТ. При цьому відчуття нудоти було у 53,9 % хворих 1-ї групи і лише у третини хворих 2-ї групи.
Розвиток моторно-евакуаторних порушень ШКТ через 1 добу після операції супроводжувався підвищенням ВЧТ у 54,1 % хворих при застосуванні метоклопраміду та L-аргініну й у 92,6 % обстежених при застосуванні метоклопраміду та прозерину. У хворих 1-ї групи середнє значення внутрішньочеревного тиску перевищувало верхню межу норми на 66,6 % (р < 0,001) та статистично значимо не змінювалося порівняно з доопераційним рівнем (табл. 1).
Розглянувши структуру значення ВЧТ, ми виявили, що 63 % хворих мали підвищений внутрішньочеревний тиск, 26,9 % — внутрішньочеревну гіпертензію (ВЧГ) 1-го ступеня, 2,7 % — ВЧГ 2-го ступеня, 7,4 % — мали нормальні значення ВЧТ. У хворих 2-ї групи значення ВЧТ хоча і перевищувало верхню межу норми, проте статистично значимо від неї не відрізнялося. Крім того, при застосуванні метоклопраміду та L-аргініну ми спостерігали зменшення величини ВЧТ на 21,2 % (р = 0,018) порівняно з доопераційним рівнем. Розглянувши структуру значень ВЧТ у 2-й групі, ми виявили, що 38 % хворих мали підвищений внутрішньочеревний тиск, 8 % — внутрішньочеревну гіпертензію 1-го ступеня, 4 % — ВЧГ 2-го ступеня, 50 % — мали нормальні значення ВЧТ. Величина ПТ при цьому в обох групах залишалася на доопераційному рівні, вірогідно не відрізняючись від початкової, що свідчило про достатню перфузію кишечника.
На тлі парезу кишечника, який розвинувся, змінювався судинний тонус, про що свідчили гемодинамічні показники. На збереження периферичного вазоспазму вказували ЗПОС та ППОС, які в 2-й групі були найбільшими, перевищуючи норму на 44,9 % (р < 0,001) і 18,7 % (р < 0,001) відповідно.
Підвищення ВЧТ, розвиток стрес-реакції організму на операційну травму вимагали відповідного підвищення роботи серця для забезпечення метаболічних процесів, насамперед для доставки кисню. Аналіз показав, що через 1 добу після операції у хворих усіх груп зберігалася тахікардія. При цьому в 1-й групі відбувалося подальше підвищення ХОК, тоді як в обстежених 2-ї групи ХОК лишався на доопераційному рівні, що було меншим за показник 1-ї групи на 20 % (р = 0,003). Підвищення ХОК у 1-й групі відбувалося як за рахунок збільшення ЧСС, так і внаслідок підвищення УО. Разом із цим на тлі застосування L-аргініну величина ХОК не змінювалася порівняно з доопераційним етапом, що пояснювалося відсутністю змін УО та ударного індексу (УІ). За умов підвищеного постнавантаження, збереження стабільних УО, УІ і ХОК на тлі L-аргініну супроводжувалося сталою роботою лівого шлуночка (РЛШ) та його потужністю (Р), тоді як у хворих 1-ї групи РЛШ зростала, перевищуючи показник 2-ї групи на 31,3 % (р < 0,001). Загалом через 1 добу після операції кровообіг у хворих 2-ї групи лишався на попередньому рівні, 1-ї групи — переходив у помірно-гіпердинамічний тип, на що вказувала величина серцевого індексу (СІ).
Максимальне підвищення ВЧТ у хворих усіх груп ми спостерігали на 2-гу добу після операції. У 1-й групі 100 % хворих мали підвищений ВЧТ, натомість у 2-й групі 20 % хворих мали нормальне його значення. Середнє значення ВЧТ перевищувало норму у хворих 1-ї групи на 48,5 % (р < 0,001), 2-ї — на 45,7 % (р = 0,002). У більшості хворих обох груп рівень ВЧТ не досягав ВЧГ 2-го ступеня. ВЧГ 3-го та 4-го ступенів не було зареєстровано в жодній групі. ПТ у всіх обстежених лишався сталим та перебував у межах норми.
Частота розвитку моторно-евакуаторних порушень через 3 доби після операції значно зменшувалася. Це підтверджувалося величиною ВЧТ, що знижувалася в обох групах. Найбільша кількість хворих із підвищеним ВЧТ була в 1-й групі — 58,8 % проти 43,8 % у 2-й групі. Так, у хворих 1-ї групи його середнє значення перевищувало норму на 27 % (р = 0,037) і знаходилося на доопераційному рівні, проте не досягало ВЧГ 1-го ступеня. У хворих 2-ї групи середнє значення ВЧТ було нижче порівняно з доопераційним рівнем на 30,9 % (р < 0,001). 56,2 % обстежених 2-ї групи мали ВЧТ у межах норми, 33,3 % — підвищений ВЧТ, 10,5 % — ВЧГ 1-го ступеня. ПТ через 3 доби після операції в обох групах не змінювався порівняно з доопераційним та перебував у межах норми.
Зниження ВЧТ через 3 доби після операції супроводжувалося зменшенням частоти розвитку моторно-евакуаторних порушень в обох групах. Затримку відходження газів ми спостерігали лише в 7,4 % хворих групи прозерину. При цьому у всіх хворих групи L-аргініну спостерігалося самостійне відходження газів. Найменша кількість хворих зі здуттям живота (47,8 %) була у 2-й групі, у той час як кількість таких хворих у 1-й групі досягала 77,8 %. Проте через 3 доби після операції у багатьох хворих лишалися неприємні суб’єктивні відчуття, пов’язані з порушенням моторно-евакуаторної функції ШКТ. Так, відчуття переповнення в животі при застосуванні прозерину було у 88,9 % хворих проти 47,8 % у групі L-аргініну. Нудота та блювання були відсутніми в більшості хворих обох груп. Зниження ВЧТ та зменшення проявів моторно-евакуаторних порушень ШКТ формували гемодинамічну реакцію. У хворих обох груп АТс знижувався та перебував у межах норми. Аналогічно зменшувався діастолічний АТ (АТд).
У групі метоклопраміду та неостигміну явища периферичного вазоспазму посилювалися. Разом із тим у групі L-аргініну явища периферичного вазоспазму лишалися, проте зменшувалися. Так, у 2-й групі рівень ЗПОС перевищував норму лише на 30,4 % (р < 0,001), ППОС — на 11,8 % (р = 0,002). Зменшення проявів парезу кишечника, зниження ВЧТ та зміна периферичного судинного тонусу формували зміни в роботі серцевого м’яза, що впливало на серцевий викид.
У хворих 1-ї групи збільшення ЗПОС викликало додаткове навантаження на серцевий м’яз та призводило до зменшення серцевого викиду. На це вказувало зниження УО, значення якого при застосуванні прозерину було меншим за норму на 16,2 % (р = 0,012). У хворих 2-ї групи УО та УІ знаходилися на попередньому рівні, статистично значимо не відрізнялися від доопераційних. Зміни УО та УІ супроводжувалися компенсаторною тахікардією, що зберігалася в обох групах.
Збереження тахікардії впливало на ХОК, величина якого в 1-й групі на 23,8 % (р < 0,001) перевищувала показник 2-ї групи. У хворих 1-ї групи збереження тахікардії, зменшення УО при збільшенні постнавантаження призводили до змін РЛШ та Р. Аналіз показав, що при застосуванні метоклопраміду та прозерину робота лівого шлуночка перевищувала доопераційний рівень на 22,3 %, норму — на 23,9 % (р < 0,001). Потужність лівого шлуночка зменшувалася та була нижчою за норму на 9,5 % (р = 0,006). Це призводило до зниження СІ та переходу гемодинаміки з помірно-гіпердинамічного в нормодинамічний тип. В обстежених 2-ї групи РЛШ лишалася на попередньому рівні з одночасним збільшенням Р на 26,4 % (р < 0,001) порівняно з показником 1-ї групи. Збільшення потужності лівого шлуночка у 2-й групі при зменшенні постнавантаження, сталому УО та збереженні тахікардії сприяло збереженню СІ на попередньому помірно-нормодинамічному рівні.
Через 7 діб після операції у 100 % обстежених було наявне самостійне відходження газів. Проте у деяких хворих лишалися неприємні відчуття. Так, 11,5 % хворих 1-ї групи відчували переповнення в животі, 7,6 % — нудоту, у 3,8 % було наявне здуття живота. Водночас у 2-й групі не було зареєстровано жодного випадку нудоти та блювання. Здуття живота, що супроводжувалося відчуттям переповнення в животі, було наявним у 8,4 % обстежених 2-ї групи. Вищевикладене свідчило про те, що під впливом L-аргініну прискорювалося відновлення активної моторно-евакуаторної діяльності ШКТ та зменшувалися неприємні суб’єктивні відчуття на 7-му добу післяопераційного періоду.
Нормалізація пасажу по кишечнику сприяла змінам гемодинаміки. Явища периферичного вазоспазму зберігалися в усіх групах, проте тенденція до змін ЗПОС та ППОС у групах була різною. Так, на продовження посилення периферичного вазоспазму у 1-й групі вказувало зростання ЗПОС на 34 % (р < 0,001) та ППОС — на 7 % (р = 0,049) порівняно з нормою. Посилення постнавантаження призводило до зниження серцевого викиду, на що вказували УО та УІ, значення яких у 1-й групі були меншими за норму на 25,5 % (р < 0,001) і 30,6 % (р < 0,001) відповідно. Зниження серцевого викиду компенсувалося підвищеною ЧСС, величина якої в 1-й групі перевищувала норму на 42,7 % (р < 0,001). Збільшена ЧСС підтримувала ХОК на підвищених значеннях. Вищевказане супроводжувалося зменшенням СІ у 1-й групі та переходом гемодинаміки з нормодинамічного типу в помірно-нормодинамічний. РЛШ та Р у 1-й групі статистично значимо не відрізнялися від норми.
Водночас у 2-й групі ЗПОС продовжував знижуватися, був нижчим за доопераційний на 16,9 % (р = 0,049), однак перевищуючи норму на 24 % (р < 0,001). Аналогічно змінювався ППОС, повертаючись у межі норми. Разом із цим зменшення постнавантаження у 2-й групі полегшувало роботу серця, на що вказували сталі показники УО та УІ, які не змінювалися порівняно з попереднім етапом, проте були дещо нижчими за норму. Для підтримання ХОК на сталому рівні при дещо зниженому серцевому викиді спостерігалася компенсаторна тахікардія, проте зберігалася тенденція до нормалізації ЧСС, величина якої у 2-й групі була нижчою за доопераційну на 8,9 % (р = 0,024). Гемодинаміка відповідала помірно-нормодинамічному типу. При цьому відбувалося збільшення потужності лівого шлуночка. Р у 2-й групі перевищувала доопераційний рівень на 58,8 % (р < 0,001), на 28,6 % (р < 0,001) — норму, на 38,7 % (р < 0,001) — показник 1-ї групи.
Аналіз кінцевих та прикінцевих результатів лікування виявив, що найбільш швидке відновлення перистальтики після операції було у хворих 2-ї групи. Так, при застосуванні метоклопраміду та L-аргініну самостійне відходження газів спостерігалося через 2,22 ± 0,30 доби після операції. Це на 21,8 % (р = 0,001) було меншим за показник 1-ї групи. Більш швидке відновлення перистальтики сприяло скороченню тривалості перебування у ВАІТ. Так, у хворих 2-ї групи тривалість перебування у ВАІТ становила 2,25 ± 0,30 доби проти 2,81 ± 0,30 доби в 1-й групі. Летальних випадків в обох групах на 28-му добу після операції зареєстровано не було. 100 % хворих обох груп на 28-му добу після операції досягли VIII рівня якості життя за шкалою RLAS, що свідчило про їх повернення до звичайного життя.
Висновки
1. У більшості хворих у ранньому післяопераційному періоді після невідкладних абдомінальних операцій розвиваються післяопераційні порушення моторики ШКТ, проте на тлі використання L-аргініну та метоклопраміду через 3 доби в більшості обстежених прояви моторно-евакуаторних порушень були слабко виражені. Активна моторно-евакуаторна діяльність ШКТ відновлювалась через 2–3 доби після операції.
2. Використання L-аргініну та метоклопраміду супроводжувалося зменшенням явищ периферичного вазоспазму при сталій роботі лівого шлуночка та збільшенням його потужності.
1. Беляев А.В. Парентеральное и энтеральное питание в интенсивной терапии — К.: КИМ, 2009. — 344 с.
2. Губергриц Н.Б. Современный прокинетик итоприд в лечении диспепсии / Н.Б. Губергриц, П.Г. Фоменко // Внутрішня медицина. — 2009. — № 3 (15). — С. 27-35.
3. Климочкина Е.М. Влияние состояния К+-АТФ-зависимых каналов на содержание стабильных метаболитов оксида азота в культуре мононуклеарных клеток здоровых добровольцев / Е.М. Климочкина // Український журнал експериментальної медицини ім. Г.О. Можаєва. — 2008. — Т. 9, № 1. — С. 93-96.
4. Колосовских А.А. Функциональное состояние микроциркуляции кишечника при разлитом перитоните / А.А. Колосовских, С.Л. Кан, Ю.А. Чурляев, О.С. Золоева // Общая реаниматология. — 2012. — № 8. — С. 33-37.
5. Camli A., Barlas М., Yagmurlu A. Does L-arginine induce intestinal adaptation by epithelial growth factor? // ANZ J. Surg. — 2005. — Vol. 75. — P. 73-75.
6. DeGiorgio R., Knowles C.H. Acute colonic pseudo-obstruction // Br. J. of Surg. — 2009. — Vol. 96. — P. 229-239.
7. Delgago-Aros S., Camilleri M. Pseudo-obstruction in the critically ill // Best Pract. Res. Clin. Gastroenterol. — 2003. — Vol. 17. — P. 427-444.
8. DeMeirelles L.R., Santoro M.M., Mendes M. Inhibitore effects os endogenous L-arginine analogues os nitricoxide synthesis in platelets: role in platelet hyperaggrebility in hypertension // Clin. and Experiment Pharmacol and Phisiol. — 2007. — Vol. 34. — P. 1267-1271.
9. Fraser R., Vozzo R., Di Matteo A.C. Endogenous nitricoxide modulates small intestinal nutrient transit and activity in healthy adulthumans // Scand. J. Gastroenterol. — 2005. — Vol. 40. — P. 1290-1295.
10. Herbert M.K., Holzer P. Standartized concept for the treatment of gastrointestinal dysmotility in critically ill // Clin. Nutr. — 2008. — Vol. 27. — P. 25-41.
11. Johnson M., Walsh R. Current therapies to shorten posto–perative ileus // Cleveland Clinic Journal of Medicine. — 2009. — Vol. 76. — P. 641-648.
12. Kabaroglu C., Akisu M., Habif S. Effects of L-arginine and L-carnitine in hypoxia/reoxygenation-induced intestinal injury // Pediatrics International. — 2005. — Vol. 47. — P. 10-14.
13. Procacciante F., DeLuca M., Abilaliaj V. Post-operative ileus in hemicolectomy for cancer: open versus laparoscopic approach // Ann. Ital. Chir. — 2013. — Vol. 84. — P. 557-562.
14. Ueno C., Fukatsu K., Maeshima Y. Arginine-enriched total parenteral nutrition improves survival in peritonitis by normalizing NF kappa B activation in peritoneal resident and exudative leukocytes // Ann. Surg. — 2010. — Vol. 251(5). — P. 959-965.
15. Wolff B.G., Weese J.L., Ludwig K.A. Postoperative ileus-related morbidity profile in patient streated with alvimopan after bowelresection // J. Am. Coll. Surg. — 2007. — Vol. 204. — P. 609-616.
16. Yeh C.L., Hsu C.S., Chen S.C. Effect os arginine os cellular adhesion molecule expression and leukocyte transmigration in endothelial cells stimulated by biological fluid from surgical patients // Shok. — 2007. — Vol. 28(1). — P. 39-44.
1. Belyaev AV. [Parenteral and enteral nutrition in intensive care]. Kyiv.KIM.2009. 344 p. Russian.
2. Gubergrits NB, Fomenko PG. [Modern itoprideprokinetics in the treatment of dyspepsia]. Vnutrіshnya meditsina.2009;3(15):27-35.Russian.
3. Klimochkina EM. [Influence of the state K +-ATP-dependent channels on the content of stable nitric oxide metabolites in the culture of mononuclear cells of healthy volunteers]. Ukraїns'kiyzhurnaleksperimental'noїmeditsiniіm. G.O. Mozhaeva.2008;1(9):93-96.Russian.
4. Kolosovskikh AA, Kan SL, Churlyaev Yu A, Zoloeva OS.[Functional state of the microcirculation of the intestine in diffuse peritonitis]. Obshchaya reanimatologiya.2012;8:33-37.Russian.
5. Camli A, Barlas М, Yagmurlu A. Does L-arginine induce intestinal adaptation by epithelial growth factor?.ANZ J Surg.2005;75:73-5.
6. De Giorgio R , Knowles CH. Acute colonic pseudo-obstruction. Br J of Surg.2009;96:229-39.
7. Delgago-Aros S, Camilleri M. Pseudo-obstruction in the critically ill. Best Pract Res Clin Gastroenterol.2003;17:427-44.
8. De Meirelles LR, Santoro MM, Mendes M. Inhibitore effects of endogenous L-arginine analogues on nitric oxide synthesis in platelets: role in platelet hyperaggrebility in hypertension.Clin and Experiment Pharmacol and Phisiol.2007;34:1267-71.
9. Fraser R, Vozzo R, Di Matteo AC. Endogenous nitric oxide modulates small intestinal nutrient transit and activity in healthy adult humans.Scand J Gastroenterol.2005;40:1290-5.
10. Herbert MK, Holzer P. Standartized concept for the treatment of gastrointestinal dysmotility in critically ill.Clin. Nutr.2008;27:25-41.
11. Johnson M, Walsh R. Current therapies to shorten postoperative ileus.Cleveland Clinic Journal of Medicine.2009;76:641-8.
12. Kabaroglu C, Akisu M, Habif S. Effects of L-arginine and L-carnitine in hypoxia/reoxygenation-induced intestinal injury. Pediatrics International.2005;47:P.10-4.
13. Procacciante F, De Luca M, Abilaliaj V. Post-operative ileus in hemicolectomy for cancer: open versus laparoscopic approach.AnnItal Chir.2013;84:557-62.
14. Ueno C, Fukatsu K, Maeshima Y. Arginine-enriched total parenteral nutrition improves survival in peritonitis by normalizing NFkappaB activation in peritoneal resident and exudative leukocytes. Ann.Surg.2010;251(5):959-65.
15. Wolff BG, Weese JL, Ludwig KA. Postoperative ileus-related morbidity profile in patients treated with alvimopan after bowel resection. J Am Coll Surg.2007;204:609–16.
16. Yeh CL, Hsu CS, Chen SC. Effect of arginine on cellular adhesion molecule expression and leukocyte transmigration in endothelial cells stimulated by biological fluid from surgical patients. Shok.2007;28(1):39-44.

/100/100.jpg)
/101/101.jpg)