Журнал «Медицина неотложных состояний» 2 (65) 2015
Вернуться к номеру
Нутритивная терапия в клинике критических состояний
Авторы: Мальцева Л.А., Мосенцев Н.Ф., Черненко В.Г. — ГУ «Днепропетровская медицинская академия МЗ Украины»
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
В статье представлены международные рекомендации по проведению нутритивной терапии при критических состояниях.
У статті подано міжнародні рекомендації з проведення нутритивної терапії при критичних станах.
The article presents the international guidelines on nutritional therapy in critical conditions.
критическое состояние, нутритивная терапия.
критичні стани, нутритивна терапія.
critical condition, nutritional therapy.
Статья опубликована на с. 130-133
Нутритивная терапия при острой дыхательной недостаточности, остром респираторном дистресс-синдроме, механической вентиляции легких
Нутритивная недостаточность оказывает влияние на дыхательную мускулатуру, в том числе и на диафрагму: ее масса снижается на 40–43 %; сила дыхательной мускулатуры диафрагмы — на 58–63 %; жизненная емкость легких — на 35–37 %; максимальная производная вентиляция — на 50–59 %. В итоге наступают дисфункция дыхательного центра, длительная респираторная зависимость. Симптомокомплекс, развивающийся у пациентов в критическом состоянии при недостаточности питания, можно представить в виде следующей схемы: недостаточное питание — недостаточность дыхательных мышц — длительная респираторная зависимость — электролитные и эндокринные расстройства — прогрессирует острая дыхательная недостаточность — явления гипоксемии, ацидоза, гипервентиляции, обструкции дыхательных путей, микроателектазирование, нарушение вентиляционно-перфузионных соотношений — явления катаболизма — явления синдрома полиорганной недостаточности [1].
Воздействие раннего полного парентерального питания (ППП) на компартменты мышц и жировой ткани во время критической болезни не предотвращает явное истощение скелетных мышц, наблюдаемое за первую неделю критической болезни. Раннее ППП увеличивает количество жировой ткани в пределах мышечных лакун.
Целью нутритивной поддержки является восстановление потенциала дыхательной мускулатуры для прекращения проведения максимальной вентиляции легких (МВЛ).
В питательные смеси у данной категории пациентов должны быть включены полиненасыщенные жирные кислоты: гамма-линоленовая и эйкозапентаеновая, которые уменьшают агрегацию тромбоцитов, синтез провоспалительных агентов, снижают уровень связанных с воспалительным каскадом метаболитов арахидоновой кислоты, тромбоксана А2, простагландина Е2, повреждающих легкие при остром респираторном дистресс-синдроме (ОРДС).
Пациентам с ОРДС рекомендуется низкоуглеводная/высоколипидная формула. Уровень глюкозы выше 5 мг/кг/мин может увеличить дыхательный коэффициент более 1, увеличить работу дыхания, производство двуокиси углерода, что клинически значимо при ОРДС.
Фосфор обеспечивает нормальное функционирование диафрагмы, поддерживает адекватный уровень 2,3-дифосфоглицерата, который участвует в регуляции тканевого дыхания. Гипофосфатемия способствует повышенному потреблению глюкозы из-за быстрого внутриклеточного сдвига фосфора для использования в аденозинтрифосфатгенерирующем пути.
Магний необходим для клеточного метаболизма, является компонентом, играющим важную роль в сокращении мышц; гипомагниемия легко возникает при ОРДС при использовании диуретиков. Одновременно развиваются гипофосфатемия и гипокалиемия.
Оптимальная нутритивная поддержка у пациентов в отделении реанимации и интенсивной терапии (ОРИТ) позволяет снизить: частоту госпитальных пневмоний на 20–25 %; частоту ранней инфекции на 15–40 %; сроки пребывания на МВЛ; длительность синдрома полиорганной недостаточности; сроки пребывания в ОРИТ на 25 %; послеоперационную летальность на 8–15 %.
Нутритивная терапия при обширных ожогах
Нутритивная терапия при ожогах является краеугольным камнем при лечении ожогов от ранней ресусцитационной фазы до окончания реабилитации [2].
Если многие аспекты нутритивного питания являются схожими при обширных ожогах и других критических состояниях, патофизиология ожогового повреждения с большими эндокринными, воспалительными, метаболическими и иммунными нарушениями требует некоторых специфических нутриционных интервенций. Данные рекомендации на основе доказательной терапии ранжированы с помощью методики GRADE и представлены как строгие, умеренные или слабые (strong, moderate, weak).
1. Нутритивная терапия должна быть начата в первые 12 часов после повреждения, преимущественно как энтеральное (пероральное) питание (Grade В). Способ: рекомендовано отдать предпочтение энтеральному питанию, парентеральное питание (ПП) назначается значительно реже (Grade C).
2. Потребность в энергии и определяющие уравнения.
Рекомендована непрямая калориметрия как золотой стандарт для оценки энергопотребности. Если нет такой возможности, рекомендовано использовать уравнение Toronto у взрослых обожженных, у детей с ожогами — формулу Schoffield (Grade D).
Уравнение для определения энергопотребности у взрослых Toronto:
–4343 + (10,5 % TBSA) + (0,23 х caloric intane) + (0,84 х REE by Harris — Benedict «Crude») + (114 х t °C) – (4,5 х days after injury).
Уравнения для определения энергопотребности у детей Schoffield:
— девочки 3–10 лет: (16,97 х вес в кг) + (1618 х рост в см) + 371,2;
— мальчики 3–10 лет: (19,6 х вес в кг) + (1033 х рост в см) + 414,9;
— девочки 10–18 лет: (8365 х вес в кг) + (4,65 х рост в см) + 200;
— мальчики 10–18 лет: (16,25 х вес в кг) + (1372 х рост в см) + 515,5.
3. Белки: потребность в белках у обожженных выше, чем у других категорий больных, и должна удовлетворяться в количестве 1,5–2 г/кг/сут у взрослых и 1,5–3 г/кг/сут у детей (Grade D). Настойчиво предлагается рассмотреть глутаминовые добавки (или орнитидин-альфа-кетоглутарат как прекурсор глутамина в дозе 0,3 г/кг в сутки в течение 5–10 дней), но не аргинин (Grade С).
4. Глюкоза: настойчиво предлагается ограничить доставку углеводов (с целью питания или разведения лекарств) до 60 % от общих калорий, не превышая 5 мг/кг/мин как у взрослых, так и у детей (Grade D). Предлагается поддерживать уровень глюкозы крови строго ниже 8 ммоль/л, но выше 4,5 ммоль/л, используя продленную внутривенную инфузию глюкозы и инсулина (Grade D).
5. Липиды: предлагается мониторировать общую доставку жиров и удерживать получение энергии из жиров < 35 % от общих калорий.
Роль омега-3 жирных кислот и других моно- и полиненасыщенных жирных кислот требует уточнения (Grade С).
6. Микронутриенты: предлагаются у взрослых и детей добавки цинка, меди и селена; витаминов В1, С, D, Е (Grade С).
7. Метаболическая модуляция: рекомендуется использование ненутриционных стратегий для ослабления гиперметаболизма и гиперкатаболизма как у взрослых, так и у детей: поддержание теплового режима, ранняя хирургическая некрэктомия, неселективные бета-блокаторы, оксандролон 10 мг каждые 12 часов (Grade С).
8. Рекомбинантный человеческий гормон роста (rh GH) не рекомендован у взрослых обожженных, назначается детям с ожогами > 60 % площади тела (Grade В).
Нутритивная терапия при тяжелом сепсисе и септическом шоке
1. Проводить пероральное или энтеральное питание (ЭП) в зависимости от переносимости вместо полного воздержания от пищи или исключительно в/в введения глюкозы в течение первых 48 часов после диагностики тяжелого сепсиса/септического шока (уровень 2С).
2. Избегать обязательного полноценного калорийного питания в первую неделю. Вместо этого предлагается проводить низкую дозу кормления (например, 500 калорий в день), увеличивая дозу только при хорошей переносимости (уровень 2В).
3. Использовать в/в введение глюкозы и энтеральное питание вместо полного парентерального питания или проводить парентеральное питание с энтеральным в первые 7 дней после диагностирования тяжелого сепсиса и септического шока (уровень 2В).
4. Не использовать питание со специфическими иммуномодулирующими добавками у пациентов с тяжелым сепсисом (уровень 2С) [3, 4].
Нутритивная терапия при остром панкреатите
1. Пероральное питание при средне- и тяжелом остром панкреатите может возобновляться, если абдоминальная боль снижается и маркеры воспаления регрессируют (Grade 2B).
2. Энтеральное питание (зондовое) должно быть первоочередной терапией у пациентов с тяжелыми панкреатитами, требующими нутритивной поддержки (Grade 1B).
3. При остром панкреатите могут быть использованы либо элементарные, либо полимерные питательные смеси (Grade 1B).
4. Энтеральное питание при остром панкреатите может быть использовано как назоеюнальным, так и назогастральным способом (Grade 2А).
5. Парентеральное питание при остром панкреатите может применяться как терапия второй линии, если назоеюнальное питание плохо переносится, а нутритивная поддержка необходима (Grade 2С) [5, 6].
Нутритивная терапия при хронических воспалительных заболеваниях кишечника
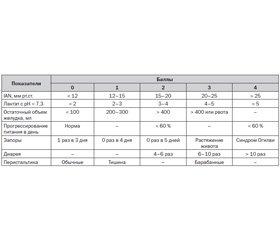
Оценку гастроинтестинальной недостаточности осуществляют по шкале LIFE (Lausanne Intestinal Failure Estimation; Reintam A. et al., 2008) (табл. 1).
Болезнь Крона является хроническим воспалительным заболеванием кишечника, обычно развивается у молодых (15–30 лет), чаще у женщин. В Великобритании 115 000 заболевших, 3000–6000 новых случаев в год, примерно 5 % протекают в тяжелой форме [7].
Согласно NICE guidelines [CG152], 2012 (Cron’sdisease: Management on adults children and young people), существует несколько лекарств от этой патологии: глюкокортикоиды назначаются до достижения ремиссии, азатиоприн или меркаптопурин — как поддерживающая терапия.
Нутритивная терапия при хронических воспалительных заболеваниях кишечника и язвенном колите включает: 1) питание малыми порциями пищи каждые 3–4 часа; 2) использование пищи с низким содержанием волокон; 3) достаточное питье жидкости для избегания дегидратации; 4) употребление пищи с добавлением пробиотиков; 5) использование мультивитаминов; 6) в периоды, когда отсутствуют симптомы болезни, добавление в питание других продуктов и различных фруктов, начинать прием новых продуктов с малых количеств; 7) избегание употребления молока и молочных продуктов у индивидов с лактозной непереносимостью; 8) при приеме стероидов назначение кальция и витамина D; 9) при хронической железодефицитной анемии парентеральное назначение препаратов железа, если пероральный их прием непереносимый; 10) назначение парентерального питания, если пациенты плохо переносят энтеральное, а также у пациентов с фистулами, когда энтеральное питание ограниченно; 11) назначение периоперативного парентерального питания у пациентов с выраженным дефицитом питания; 12) обычно комбинирование парентерального питания с энтеральным, если нет явлений интраабдоминального сепсиса или перфорации; 13) до получения данных исследований, согласно существующим рекомендациям, использование глутамина, ненасыщенных жирных кислот и других фармаконутриентов; 14) при В12-дефиците — применение данного препарата; 15) избегание употребления любых количеств алкоголя и кофеина [8–10].
Нутритивная терапия у онкохирургических больных
Показания к назначению клинического питания: снижение массы тела — 5 % за последние 6 месяцев; индекс массы тела (ИМТ) — 19 кг/м2; дефицит массы тела — 10 % от идеальной; гипопротеинемия — 60 г/л или гипоальбуминемия — 30 г/л; наличие сопутствующей патологии: сахарного диабета, хронической органной недостаточности.
Предоперационная нутритивная подготовка должна проводиться не менее 7, но и не более 14 суток с сопутствующим мониторингом альбумина, лимфоцитов, ИМТ, экскреции азота с мочой.
Схема начала нутритивной поддержки в послеоперационном периоде у онкохирургических пациентов (0-е сутки):
— энтеральное питание: сбалансированный кристаллоид — 200 мл;
— парентеральное питание: раствор для ПП «3 в одном» — 625 мл (750 ккал) со скоростью 1,7 мл/кг/ч.
Начинать инфузию через 10–12 часов после окончания операции при наличии стабильного АД.
Схема начала нутритивной поддержки в послеоперационном периоде у онкохирургических пациентов (1-е сутки):
— энтеральное питание: тип «стандарт» или «диабет» — 500 мл (500 ккал) со скоростью 25 мл/ч. При невозможности начать энтеральное питание продолжить введение сбалансированного раствора кристаллоидов — 200 мл;
— парентеральное питание: раствор для ПП «3 в одном» — 625 мл (750 ккал) со скоростью 1,7 мл/кг/ч; при невозможности начать энтеральное питание — раствор для парентерального питания «3 в одном» — 1250 мл (1250 ккал) со скоростью 2 мл/кг/ч.
Ккал/сутки — 1250.
Схема начала нутритивной поддержки в послеоперационном периоде у онкохирургических пациентов (2-е сутки):
— энтеральное питание: тип «стандарт» или «диабет» — 500 мл (500 ккал) со скоростью 50 мл/ч;
— парентеральное питание: раствор для ПП «3 в одном» с омега-3 жирными кислотами — 1250 мл (1250 ккал) со скоростью 1,7 мл/кг/ч.
Ккал/сутки — 2000.
Схема начала нутритивной поддержки в послеоперационном периоде у онкохирургических пациентов (3-и сутки):
— энтеральное питание: тип «стандарт» или «диабет» — 1000 мл (1000 ккал) со скоростью 75 мл/ч;
— парентеральное питание: раствор для ПП «3 в одном» с омега-3 жирными кислотами — 1250 мл (1250 ккал) со скоростью 1,7 мл/кг/ч.
В Женеве (Швейцария) 5–9 сентября 2014 года состоялся 36-й конгресс Европейского общества по парентеральному и энтеральному питанию (ESPEN) «Клиническое питание и метаболизм». Девиз ESPEN — «Что нового?»
В Европе, где ежегодно оперируется 5 % населения, в результате анализа анкет, оценивающих различные аспекты нутритивной поддержки в Дании, Швеции, Норвегии, установлено, что 25 % врачей не смогли оценить необходимость в нутритивной поддержке, 39 % — не знали методик выявления больных с недостаточным питанием, 53 % — не смогли рассчитать потребность в энергетических компонентах, 66 % — не знали национальных рекомендаций по клиническому питанию и 28 % врачей отметили, что недостаточное питание может привести к осложнениям и более длительной госпитализации. По данным ASPEN, за последние 20 лет наблюдается увеличение в 2,5 раза частоты использования ППП.
Однако общая ситуация с применением клинического питания все еще остается не на должном уровне: 5,2 % больных получали ЭП; 8,9 % — ПП; 0,7 % — ППП.
Важность нутритивной поддержки исследована у 2772 больных, находящихся на МВЛ в 167 отделениях интенсивной терапии в 37 странах мира: уровень смертности пациентов в течение 60 дней после операции снизился на 50 %.
Акценты конгресса ESPEN-2014
Наступает быстрое истощение пластических и энергетических ресурсов организма у больных отделения ОИТ.
Отрицательный энергетический баланс связан с увеличением числа осложнений, особенно инфекций.
Провоспалительные цитокины являются важными факторами в регуляции различных аспектов функции скелетных мышц. При критических состояниях катаболизм белка в скелетных мышцах усиливается.
Цитокин-обусловленная активация ЦНС через активацию гипоталамо-гипофизарно-надпочечниковой регуляции запускает катаболические процессы, сопровождающиеся потерей белка и атрофией скелетных мышц у больных ОИТ.
При проведении нутритивной поддержки должны вводиться сбалансированные смеси аминокислот в дозе 1,3–1,5 г/кг идеального веса в сутки одновременно с адекватным обеспечением энергетических потребностей.
Назначение исключительно ЭП не позволяет достичь нутритивных целей (к 3–4-му дню покрывает не более 60 % от REE).
Поскольку задачей энтеральной поддержки не является покрытие энергетических потребностей организма, энтеральная поддержка должна сочетаться с дополнительным парентеральным питанием.
Обогащенные рыбьим жиром липидные эмульсии снижают продолжительность нахождения в стационаре пациентов с критическими состояниями.
1. Heyland D.K. Clinical Practice Guidelines for Nutrition Supportin Mechanically Ventilated, Critically // Adult Patients. — 2009. — Ref. Type: Internet Communication.
2. Rousseau A.F., Losser M.R., Ichai C., Berger M.M. ESPEN endorsed recommendations: Nutritional therapy in major burns // Clinical Nutrition. — 2013. — Vol. 32. — P. 497-502.
3. Dellinger R.P., Levy M.M., Rhodes A., Annane D. et al. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock // Crit. Care Med. — 2013. — Vol. 41(2). — P. 580-637.
4. Amstrong C. Practice Guidelines Updated Guideline on Diagnosis and Treatment of Intraabdominal Infections // Am. Fam. Physican. — 2010. — Vol. 82(6). — P. 694-709.
5. JAP/APA evidence-based guidelines for the management of acute pancreatatis. Working Group JAP/APA Acute Pancreatitis Guidelines // Pancreatology. — 2013. — Vol. 13(4), suppl. 2. — P. 15.
6. Tenner S., Bailli J., Witt J., Vege S.S. American College of Gastroenterology Guidelines: Management of Acute Pancreatitis // Am. G. Gastroenterol. — 2013. — Vol. 108(9). — P. 1400-1415.
7. Brown A.C., Rampertab S.D., Mullin G.E. Existing Dietary Guidelines for Chrohn’s Disease and Ulcerative Colitis // Expert. Rev. Gastroenterol. Hepatol. — 2011. — Vol. 5(3). — P. 411-415.
8. Braun A.C., Rampertab S.D., Mullin G.E. Existing Dietary Guidelines for Chrohn’s Disease and Ulcerative Colitis // Expert. Rev. Gastroenterol. Hepatol. — 2011. — Vol. 5(3). — P. 411-425.
9. Van Gossum A. et al. ESPEN Guidelines on parenteral Nutrition: Gastroenterology // Clinical Nutrition. — 2009. — Vol. 28. — P. 415-427.
10. McClave S.A., Martindale R.G., Vanek V.W., McCarthy et al. Guidelines for the provision ans assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N) // J. Parenter. Enter. Nutr. — 2009. — Vol. 33(3). — Р. 277-316.

/132/132.jpg)