Журнал «Медицина неотложных состояний» 2 (65) 2015
Вернуться к номеру
Оптимизация периоперационной аналгезии при септопластике в условиях комбинированной анестезии
Авторы: Айварджи А.А., Ковырев В.Н., Кобеляцкий Ю.Ю. — ГУ «Днепропетровская медицинская академия МЗ Украины», кафедра анестезиологии и интенсивной терапии; КУ «Днепропетровская городская клиническая больница № 8» ДОС
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Целью работы являлся поиск методов улучшения периоперационной аналгезии при септопластике в условиях комбинированной анестезии. В настоящее исследование было включено 52 пациента в возрасте 18–60 лет с классом по ASА 1–2. Пациенты были разделены на основную группу (27 человек, которым проводилась внутривенная инфузия парацетамола (инфулган) 15 мг/кг за 30 минут до оперативного вмешательства) и контрольную (25 человек). Исследовались показатели гемодинамики, объема кровопотери, длительности анестезии и оперативного вмешательства, интенсивность боли по визуальной аналоговой шкале. Уровень болевых ощущений по визуальной аналоговой шкале через 6 часов в основной группе был ниже (1,22 ± 0,13 балла), чем в контрольной (3,89 ± 0,18 балла); через 12 часов отмечались аналогичные различия — 1,29 ± 0,12 балла и 3,45 ± 0,18 балла соответственно (р ≤ 0,05). Отмечалась достоверная корреляция (r = 0,63, p ≤ 0,05) между применением парацетамола перед оперативным вмешательством и снижением послеоперационной тошноты и рвоты. Таким образом, парацетамол обеспечивает адекватный профиль аналгезии, снижение послеоперационной тошноты и рвоты при септопластике в условиях комбинированной анестезии.
Метою роботи був пошук методів покращення периопераційної аналгезії при септопластиці в умовах комбінованої анестезії. У це дослідження було залучено 52 хворих віком 18–60 років з класом за ASA 1–2. Пацієнти були розподілені на основну групу (27 чоловік, якім проводилась внутрішньовенна інфузія парацетамолу (інфулган) 15 мг/кг за 30 хвилин до оперативного втручання) та контрольну (25 чоловік). Вивчалися показники гемодинаміки, обсягу крововтрати, тривалості анестезії та оперативного втручання, інтенсивність болю за візуальною аналоговою шкалою. Рівень болю після 6 годин в основній групі був нижче (1,22 ± 0,13 бала), ніж у контрольній (3,89 ± 0,18 бала), за візуальною аналоговою шкалою; після 12 годин відмічалися аналогічні відмінності — 1,29 ± 0,12 бала и 3,45 ± 0,18 бала відповідно (р ≤ 0,05). Спостерігалася вірогідна кореляція (r = 0,63, p ≤ 0,05) між використанням парацетамолу перед оперативним втручанням і зниженням післяопераційної тошноти і блювання. Таким чином, парацетамол забезпечує адекватний профіль аналгезії, зниження післяопераційної тошноти та блювання під час септопластики в умовах комбінованої анестезії.
The objective was the search for methods to improve perioperative analgesia during septoplasty under combined anesthesia. The present study included 52 patients aged 18–60 years with class 1–2 by ASA. Patients were divided into the study group (27 people who received intravenous infusion of paracetamol (infulgan) 15 mg/kg 30 minutes before surgery) and control one (25 persons). We have studied hemodynamic parameters, volume of blood loss, duration of anesthesia and surgery, pain severity by a visual analogue scale. The level of pain by a visual analogue scale after 6 hours in the study group was lower (1.22 ± 0.13 points) than in controls (3.89 ± 0.18 points); in 12 hours there were similar differences — 1.29 ± 0.12 and 3.45 ± 0.18 points, respectively (p ≤ 0.05). There was a significant correlation (r = 0.63, p ≤ 0.05) between the use of paracetamol before surgery and decreased postoperative nausea and vomiting. Thus, paracetamol provides adequate profile of analgesia, reduction of postoperative nausea and vomiting during septoplasty under combined anesthesia.
септопластика, аналгезия, парацетамол.
септопластика, аналгезія, парацетамол.
septoplasty, analgesia, paracetamol.
Статья опубликована на с. 137-140
Введение
Актуальность изучения и усовершенствования методов периоперационной аналгезии при септопластике обусловлена большой частотой распространенности этой проблемы в нашей стране и во всем мире, постоянным увеличением сложности и травматичности лор-операций, а также повышением требований к анестезиологическому обеспечению. Так, R. Mladina и L. Bastaic, исследуя частоту искривления перегородки носа в популяции, выявили его почти у 90 % взрослых людей. А.А. Воробьев и В.М. Моренко при обследовании 2153 взрослых выявили искривление перегородки носа у 58,5 % осмотренных (39,2 % женщин и 76,3 % мужчин). Здесь явно имеется в виду простое наличие той или иной формы деформации, выявляемое при передней риноскопии, а не вызываемых ею симптомов. R. Mladina попытался сравнить распространенность искривлений перегородки носа и их вариантов в разных этнических группах. На основании обследования 2600 случайно отобранных людей в разных странах мира автору не удалось выявить различий в распространенности различных типов деформаций перегородки носа у лиц, принадлежащих к разным этническим группам и проживающих в различных географических зонах. В другом исследовании в 17 лор-центрах 14 стран эта группа авторов выявила искривление перегородки носа в 89 % случаев [8].
Задачи, которые стоят перед анестезиологом и оториноларингологом при септопластике: адекватная периоперационная аналгезия, улучшение визуализации операционного поля путем уменьшения интраоперационного кровотечения, стабилизация гемодинамики, повышение комфорта и удовлетворенности пациентов.
Важнейшие принципы аналгезии — это преэмптивное использование аналгетиков и мультимодальный подход, благодаря чему достигается более стабильная гемодинамика в течение и после анестезии, улучшение послеоперационного обезболивания и более быстрая реабилитация пациентов. Под преэмптивной аналгезией понимают обезболивающую терапию, которую начинают до болевого события, в частности до оперативного вмешательства. Эффект преэмптивной аналгезии сравним с эффектом аналгезии, проводимой в том же режиме, но после операции [4]. Это связано с процессами предупреждения центральной и периферической сенситизации.
Многие вопросы лечения послеоперационной боли остаются актуальными как в нашей стране, так и за рубежом. По данным литературы, от выраженного болевого синдрома в послеоперационном периоде страдают от 30 до 75 % пациентов (Овечкин А.М., 2000; Harmer M., Davies К., 1998; Neugebauer E., 1998; Carr D., Goudas L., 1999; Chauvin M., 1999; Dolin S., 2002; Seers К., 2004).
На IV Конгрессе европейских ассоциаций по изучению боли (Прага, сентябрь 2003 г.) было отмечено, что не менее 35 % пациентов, перенесших плановые и экстренные хирургические вмешательства, страдают от послеоперационной боли. В одном из наиболее крупных исследований (около 20 000 пациентов хирургических отделений Великобритании) послеоперационные болевые ощущения средней интенсивности были отмечены в 29,7 % случаев (26,4–33 %), высокой интенсивности — в 10,9 % случаев (8,4–13,4 %) (Dolin S., Cashman J., 2002).
В России подобные масштабные исследования пока не проводились, поэтому можно руководствоваться только отдельными разрозненными данными. В частности, результаты, полученные в 1998–1999 гг. при опросе 1550 пациентов трех различных клиник (двух московских и одной областной), выявили, что 40,7 % пациентов, перенесших плановые и экстренные операции, выразили неудовлетворенность качеством послеоперационного обезболивания (Овечкин А.М. и др., 2001) [3].
Удивительно, что «малые» хирургические операции сопровождаются более интенсивной болью, вероятно, из-за того, что больные, которым выполнялись эти операции, считающиеся менее болезненными, получали неадекватное обезболивание [9].
Перспективным и безопасным препаратом для улучшения периоперационной аналгезии при септопластике является внутривенная форма парацетамола.
Точный механизм реализации эффектов парацетамола остается не до конца ясным. В отличие от опиоидов у него нет известных эндогенных мест связывания, а в отличие от нестероидных противовоспалительных препаратов (НПВП) он не подавляет активность периферической циклооксигеназы (ЦОГ). В последнее время появляются данные о центральном антиноцицептивном эффекте парацетамола, который реализуется по пути L-аргинин — NO. Хотя механизм аналгетической эффективности парацетамола остается неустановленным, он может прямо или косвенно угнетать центральные циклооксигеназы (в частности, ЦОГ-3). Среди других возможных важных механизмов упоминаются активация эндоканнабиноидной системы и спинальных серотонинергических путей (Bertolini et al., 2006; Botting, 2006; Pickering et al., 2006; Mallet et al., 2008; Pickering et al., 2008). Установлено предотвращение парацетамолом продукции простагландинов на уровне клеточной транскрипции независимо от циклооксигеназной активности (Mancini et al., 2003). Связь с серотонинергическими механизмами доказана у добровольцев, когда совместное введение антагонистов серотониновых рецепторов трописетрона и гранисетрона блокировало аналгетические эффекты парацетамола (Pickering et al., 2006; Pickering et al., 2008). Клиническое значение этих находок еще не доказано. Таким образом, многие авторы среди основных механизмов реализации эффектов парацетамола упоминают ингибирование изоферментов циклооксигеназы, взаимодействие с эндогенными опиоидными путями, активацию серотонинергического бульбоспинального пути, вовлечение оксида азота или активацию каннабиноидно-ваниллоидной системы (Mattia A. еt al., 2009) [2].
Доказательные положения по использованию парацетамола:
1. Парацетамол — эффективный аналгетик для устранения острой боли; частота побочных эффектов сравнима с плацебо (Level I [CochraneReview]).
2. НПВП, добавленные к парацетамолу, улучшают аналгезию (Level I) [1].
Появляется все больше работ по преэмптивному и превентивному введению парацетамола. Так, S. Arici и соавт. исследовали эффекты внутривенного парацетамола, который вводили перед гистерэктомией. Это сопровождалось повышением послеоперационной аналгезии и снижением использования опиатов после оперативного вмешательства [5].
А. Chethan, М. Koteswara, D. Sheetal показали в своей работе, что преэмптивное использование парацетамола перед эндоскопическими назальными операциями сопровождается улучшением послеоперационной аналгезии [6].
Другие авторы использовали для преэмптивной и превентивной аналгезии внутривенный парацетамол при ортопедических операциях. Они пришли к выводу, что внутривенный парацетамол повышает послеоперационную аналгезию и снижает потребность в опиатах [10].
Кроме того, внутривенный парацетамол при введении до анестезии или до перевода в блок интенсивной терапии может быть использован для профилактики послеоперационной тошноты и рвоты (ПОТР), что связано как с прямым противорвотным влиянием, так и с уменьшением боли [7].
Таким образом, дальнейшее изучение и внедрение в практику внутривенной формы парацетамола является логичным и оправданным с точки зрения мультимодальных подходов аналгезии в доказательной медицине.
Материалы и методы
На базе КУ «Днепропетровская городская клиническая больница № 8» ДОС с декабря 2013 по февраль 2014 г. исследовались показатели пациентов в возрасте от 18 до 60 лет с искривлением перегородки носа (класс по АSA 1–2), которым проводилась септопластика в условиях комбинированной анестезии: тотальная внутривенная анестезия с искусственной вентиляцией легких (ИВЛ) + местная анестезия (2% раствор лидокаина + адреналин 1 : 100 000). План анестезии: премедикация — атропин 0,1 мг/кг, сибазон 0,5% 0,15 мг/кг, дексаметазон 0,5 мг/кг в/м; индукция: пропофол 2–2,5 мг/кг, фентанил 2 мкг/кг, тракриум 0,5 мг/кг; ИВЛ через интубационную трубку; базисный наркоз — пропофол 4–5 мг/кг/ч, фентанил по схеме 10–5–3 мкг/кг/ч; инфузия кристаллоидов — 4–5 мл/кг/ч. За 10 мин до окончания оперативного вмешательства — декскетопрофен 100 мг в/в. Послеоперационное обезболивание проводилось декскетопрофеном каждые 8 часов по 100 мг в/в. Больные распределены на 2 группы — 25 и 27 человек соответственно: 1-я — К; 2-я — П (табл. 1).
/139/139.jpg)
В группе П проводилась в/в инфузия парацетамола за 30 мин до начала операционного вмешательства в дозе 15 мг/кг. В обеих группах исследовались показатели гемодинамики (артериальное давление (АД), среднее АД, частота сердечных сокращений, сердечный индекс, общее периферическое сосудистое сопротивление, вариабельность сердечного ритма) с помощью монитора «ЮМ 300-12», общий анализ крови определялся на гематологическом анализаторе BC-2800. Объем кровопотери измерялся посредством электроаспиратора В-80. Регистрировались длительность анестезии и оперативного вмешательства, количество анестетиков и аналгетиков, уровень боли по визуальной аналоговой шкале (ВАШ), осложнения. Отзывы пациентов исследовались с помощью модифицированной шкалы Iowa Satisfaction with Anesthesia Scale.
Этапы исследования: 1-й — первые сутки до анестезии; 2-й — непосредственно перед операцией (за 20 мин); 3-й — в течение анестезии (20–30 мин); 4-й — после пробуждения пациента; 5-й — через 6 часов после анестезии; 6-й — через 12 часов после анестезии; 7-й — на 2-е сутки после анестезии; 8-й — на 3-и сутки после анестезии.
Результаты и их обсуждение
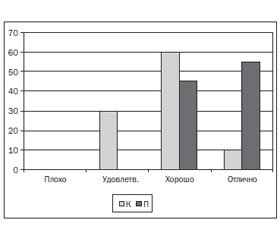
Хотя в основной группе отмечалась тенденция к снижению таких показателей, как среднее артериальное давление, ударный объем и общее периферическое сопротивление, индекс централизации, объем кровопотери, длительность оперативного вмешательства и анестезии, доза анестетиков и аналгетиков, повышение вагосимпатического отношения, достоверных различий по этим параметрам выявлено не было. Различий в показателях гемостаза и общего анализа крови между основной и контрольной группами не обнаружили. Уровень болевых ощущений через 6 часов в основной группе был ниже (1,22 ± 0,13 балла), чем в контрольной (3,89 ± 0,18 балла) по ВАШ; через 12 часов отмечались аналогичные различия — 1,29 ± 0,12 балла и 3,45 ± 0,18 балла по ВАШ соответственно (р < 0,05), что, возможно, связано с преэмптивным действием парацетамола путем предотвращения центральной сенситизации (рис. 1). Интересным фактом является то, что в группе П частота ПОТР ниже, чем в контрольной — 12 и 20 % соответственно (рис. 2).
Это, скорее всего, обусловлено улучшением аналгезии в послеоперационном периоде, а возможно, и прямыми противорвотными механизмами. Отзывы об анестезии были выше в группе с инфузией парацетамола (р < 0,05) (рис. 3).
/140/140.jpg)
Выводы
1. Адекватная послеоперационная аналгезия — результат совместных усилий анестезиолога и хирурга.
2. Преэмптивная аналгезия посредством внутривенной инфузии парацетамола в комбинации с послеоперационным введением декскетопрофена обеспечивает адекватный профиль аналгезии после септопластики.
3. Инфузия внутривенного парацетамола перед оперативным вмешательством коррелирует со снижением ПОТР.
1. Кобеляцкий Ю.Ю. Современные подходы к периоперационной аналгезии в различных областях хирургии с доказательных позиций // Медицина неотложных состояний. — 2011. — № 1–2. — C. 32-33.
2. Кобеляцкий Ю.Ю. Расширение возможностей периоперационной анальгезии // Медицина неотложных состояний. — 2012. — № 2. — C. 7-12.
3. Овечкин А.М., Cвиридов С.В. Послеоперационная боль и обезболивание: современное состояние проблемы // Медицина неотложных состояний. — 2011. — № 6. — C. 20-31.
4. Цегла Т., Готтшальк А. Лечение боли. — М.: Медпресс-информ, 2011. — 183 с.
5. Arici S., Gurbet A., Türker G., Yavaşcaoğlu B., Sahin S. Preemptive analgesic effects of intravenous paracetamol in total abdominal hysterectomy // Agri. — 2009. — Vol. 21(2). — Р. 54-61.
6. Chethan M. Koteswara, Sheetal D. A Study on Pre-Emptive Analgesic Effect of Intravenous Paracetamol in Functional Endoscopic Sinus Surgeries (FESSs): A Randomized, Double-Blinded Clinical Study // J. Clin. Diagn. Res. — 2014. — Vol. 8. — P. 108-111.
7. Christian C., Apfela В., Turanc A., Souzaa K., Pergolizzid J. Intravenous acetaminophen reduces postoperative nausea and vomiting: Asystematic review and meta-analysis // PAIN. — 2013. — Vol. 154. — Р. 677-689.
8. Babakhanov G., Khasanov S., Makhsudov S., Bobokhonov M., Almamatov A. Methods of septum surgery (septoplasty) with cresto- and suturotomy // Medical and Health Science Journal. — 2012. — Vol. 13. — P. 74-79.
9. Gerbershagen H.J., Aduckathil S., Albert J., Van Wijck M., Peelen L., Kalkman C., Meissner M. Pain Intensity on the First Day after Surgery // Anesthesiology. — 2013. — Vol. 118. — P. 934-44.
10. Khalili G., Janghorbani M., Saryazdi H., Emaminejad A. Effect of preemptive and preventive acetaminophen on postoperative pain score: a randomized, double-blind trial of patients undergoing lower extremity surgery // J. Clin. Anesth. — 2013. — Vol. 25(3). — P. 188-92.

/139/139_2.jpg)