Журнал «Здоровье ребенка» 2 (61) 2015
Вернуться к номеру
Активированные кислородсодержащие метаболиты организма человека при заболеваниях органов дыхания. Генераторы и генерация (Часть 2)
Авторы: Абатуров А.Е. — ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. — Национальный медицинский университет им. А.А. Богомольца, г. Киев; Чернышова О.Е. — Донецкий национальный медицинский университет им. М. Горького, г. Красный Лиман
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В обзоре даны общие представления о механизмах генерации активированных кислородсодержащих метаболитов.
В огляді надані загальні уявлення про механізми генерації активованих кисневмісних метаболітів.
The review presents general ideas about the mechanisms of generation of activated oxygen-containing metabolites.
активированные кислородсодержащие метаболиты, легкие.
активовані кисневмісні метаболіти, легені.
activated oxygen-containing metabolites, lungs.
Статья опубликована на с. 202-207
Активация NOX
Активация НАДФH-оксидазы
Механизмы рецептор-ассоциированной активации НАДФH-оксидаз (NOX2) наиболее изучены у фагоцитирующих клеток, у которых во время фагоцитоза наблюдается усиленная продукция активированных кислородных метаболитов (АКМ) [3–5, 7, 8]. Основными стимулирующими факторами механизмов активации НАДФH-оксидазы являются цитокины — TGF-β1, TNF-α и IL-1β, пептидные факторы роста (PDGF; EGF, VEGF, bFGF и инсулин), патоген-ассоциированные молекулярные структуры (РАМР) инфекционных агентов, активирующие Toll-подобные рецепторы (TLR), агонисты G-протеин-связанных рецепторов (GPCR — G-protein-coupled receptors) — ангиотензин II, тромбин, эндотелин-1, серотонин, лизофосфатидиновая кислота, 1-фосфат сфингозина, гистамин, брадикинин. РАМР, в частности флагеллин Pseudomonas aeruginosa, могут взаимодействовать и с рецептором P2Y, что ведет к высвобождению АТФ, которая индуцирует активность НАДФН-оксидазы [14, 23]. НАДФH-оксидаза в нефагоцитирующих клетках активируется лигандами GPCR, некоторыми интерлейкинами и клеточными факторами роста [18].
Инициализация процесса сборки НАДФH-оксидазы в фагоцитирующих клетках связана с двумя внутриклеточными сигнальными факторами — с активностью фосфоинозитол-3-киназы (PI3K) и с повышением внутриклеточной концентрации ионов Са2+. Активация PI3K обусловливает фосфорилирование протеина Rac, что способствует его перемещению к внутренней поверхности цитоплазматической мембраны клетки [7, 17]. Повышение внутриклеточной концентрации ионов Са2+ индуцирует кальцийзависимую протеинкиназу Сб (РКСб), которая обусловливает фосфорилирование цитоплазматической фосфолипазы А2 (PLA2). Цитоплазматическая PLA2 из фосфатидилхолина высвобождает свободную арахидоновую кислоту, дальнейшая метаболизация которой представлена липооксигеназным и циклооксигеназным вариантами. Под влиянием 5-липоксигеназы из арахидоновой кислоты образуется гидропероксиэйкозатетраеновая кислота (HPETE), которая преобразуется в лейкотриены, эпоксилины, липоксины и гидроксиэйкозатетраеновую кислоту (HETE). При участии циклооксигеназ (COX1, COX2) арахидоновая кислота метаболизируется до эндопероксида PGG2, из которого в дальнейшем образуются гидроксигептадекатриеновая кислота (ННТ), простагландины (ПГЕ2, ПГF2, ПГI2, ПГD2), тромбоксан А2. Цитоплазматическая PLA2, свободная арахидоновая кислота и ее дериваты инициализируют ключевой процесс каскада активации НАДФH-оксидазы — фосфорилирование цитоплазматических p47phox и p67phox [26]. В процесс фосфорилирования субъединиц p47phox и p67phox НАДФH-оксидазы также вовлечены несколько других киназ — p38-активированная протеинкиназа, p21-активированная киназа (PAK), казеиновая киназа-2, протеинкиназа-B. Однако среди этого множества киназ доминирующую роль в процессе активации субъединиц НАДФH-оксидазы играет РКС. Вызванные фосфорилированием конформационные изменения молекулы p47phox обусловливают перемещение цитоплазматически расположенного комплекса p47phox/p67phox к внутренней поверхности мембраны клетки [12, 15] с одновременной транслокацией p40phox и Rac [7].
Активация НАДФH-оксидазы в фагоцитирующих клетках происходит при взаимодействии комплекса p47phox/p67phox/p40phox и Rac с мембрано-ассоциированным цитохромом Cytb558. Предполагают, что фосфорилирование аминокислотных остатков Ser303, Ser304 и Ser328 протеина p47phox обусловливает взаимодействие комплекса p47phox/p67phox/p40phox с богатыми пролиновыми аминокислотными остатками областями эндоплазматического хвоста субъединицы p22phox мембранного Cytb558, что обусловливает формирование активного ферментного комплекса (рис. 1) [19].
Регуляция ферментативной активности НАДФH-оксидазы достигается двумя механизмами: пространственным разъединением субъединиц фермента и модуляциями протеин-протеиновых и протеин-липидных взаимодействий [7, 15].
Активация других протеинов семейства NOX
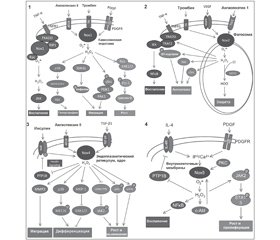
Ферменты NOX нефагоцитирующих клеток активируются лигандами GPCR, некоторыми интерлейкинами и клеточными факторами роста [18]. Процесс активации протеинов семейства NOX нефагоцитирующих клеток отличается от активации НАДФН-оксидазы некоторыми особенностями (рис. 2).
По всей вероятности, генерируемый разными NOX O2– выполняет различные функции. АКМ, генерируемые протеинами семейства NOX, оказывают действие как внутри клетки, так и во внеклеточном пространстве. Протеины NOX2 и DUOX1/2 генерируют АКМ во внеклеточное пространство, где они оказывают преимущественно бактерицидное действие. Другие представители семейства NOX генерируют АКМ преимущественно внутрь клетки, таким образом регулируя различные функции клетки (рис. 3) [9]. Так, внутриклеточно генерируемые АКМ ингибируют активность фосфатаз, активируют деятельность киназ (р38 MAPK), регулируют функцию ионных каналов, кальций-зависимое возбуждение, экспрессию генов некоторых протеинов (TNF-α, TGF-β1, ангиотензина II, моноцитарного хемоаттрактантного протеина-1, ингибитора активатора плазминогена-1) [6].
Функциональная активность протеинов NOX предопределяет развитие разных патологических процессов (рис. 4).
Генерация АКМ
Активная, полностью собранная НАДФH-оксидаза осуществляет перенос одного электрона на молекулярный кислород. Электроны передаются от первичного электронного донора НАДФH (со средним потенциалом 320 мВ, в частности для NOX2) вдоль электрохимического градиента — ФАД → 2 гема → O2 (средний потенциал 160 мВ). Электрохимический градиент от НАДФH к O2, составляющий 160 мВ, постоянно обеспечивает движение электронного потока с внутренней стороны на внешнюю сторону мембраны [11]. НАДФH-оксидаза генерирует короткоживущий (с периодом полураспада в несколько 10–6 секунд) O2–, который без участия ферментов или под влиянием супероксиддисмутаз (SOD) дисмутирует до перекиси водорода (H2O2) с последующей организацией как гидроксильного радикала (OH•), так и, в результате действия каталазы, кислорода (O2) и воды (H2O) (рис. 5) [10, 25].
Основной активной формой кислорода является O2–, который образуется при переносе одного электрона к молекуле кислорода. Супероксидный анион-радикал может действовать как окислитель и как восстановитель. Супероксидный анион-радикал характеризуется низкой реактивностью по отношению к биоорганическим субстратам. Ключевыми субстратами O2– являются протеины, содержащие железо-серные кластеры. Он активно взаимодействует с цитохромом C, супероксиддисмутазами, аскорбиновой кислотой. И не реагирует с полиненасыщенными жирными кислотами. Однако O2– участвует в реакциях, в результате которых образуются значительно более активные радикальные дериваты кислорода: гидропероксидный и гидроксильный радикал [20].
Двухэлектронный перенос обусловливает образование умеренной по окислительной активности H2O2, трехэлектронный перенос — образование сильного окислителя гидроксильного радикала, который участвует в процессе окисления различных структур клетки [10, 25]. Критически важными являются количественные аспекты окислительно-восстановительных систем. Так, скорость потребления О2 в организме человека составляет около 0,4 л/мин, но может быть увеличена практически в 10 раз — до максимального значения 4 л/мин. От одного до четырех процентов от объема O2 в митохондриях превращается в H2O2, то есть скорость образования H2O2 составляет от 5000 до 20 000 мкмоль/кг–1/мин–1. Фактическая скорость генерации H2O2 значительно больше, так как в ее образовании участвуют и другие генераторы — оксидазы. Было показано, что до 10 % O2 может быть преобразовано в H2O2 [16]. Перекись водорода при взаимодействии с ионами железа или меди разлагается с образованием крайне реакционно-способного гидроксильного радикала по реакции Фентона: H2O2 + Fe2+ → HO• + OH– + Fe3+. Этим объясняется опосредованное цитотоксическое действие H2O2. Долгое время считалось, что вторым путем образования гидроксильного радикала может быть реакция Хабера — Вайса: H2O2 + O2–• → HO• + O2 + OH–. Однако в физиологических условиях реакция Хабера — Вайса представляет собой сумму реакций Фентона и восстановления ионов Fe3+ супероксид-анион-радикалом. Генерация гидроксильного радикала возможна и при восстановлении Н2О2 переносчиком электрон-транспортной цепи митохондрий ферредоксином. Гидроксильный радикал ОН• является самым мощным окислителем из всех форм АКМ. Он может окислять практически все низкомолекулярные органические молекулы, белки и нуклеиновые кислоты. Гидроксильный радикал способен отрывать атом водорода от молекул ненасыщенных жирных кислот и инициировать перекисное окисление липидов. Однако эти реакции строго локализованы, так как гидроксильный радикал — крайне нестабильная молекулярная форма (время жизни 10–9 секунд), и потому он реагирует только по месту своего образования [1, 20, 22].
/109/109.jpg)
Активация кислорода возможна также путем передачи ему энергии без переноса электрона, что приводит к образованию синглетного кислорода (1О2) — крайне реакционноспособной молекулы. Электронная конфигурация синглетного кислорода подчеркивает его нерадикальную природу [1, 22].
Активация NOX сопровождается проявлением некоторых вторичных эффектов, которые приводят к перераспределению АКМ: экстрацеллюлярно генерируемый супероксид-анион-радикал и образованная перекись водорода перемещаются во внутренний континуум клетки. Так, возбуждение NOX протеинов приводит к трансмембранному переносу электронов, который сопровождается деполяризацией мембраны клетки и снижением внутриклеточного уровня pH. Данные изменения индуцируют возбуждение некоторых трансмембранных каналов, в частности потенциалзависимых протонных каналов (VSOP) и Na+/H+-обменников (HNE).
Деполяризация мембраны клетки способствует открытию VSOP и перемещению ионов H+ через клеточную мембрану. Обменники HNE регулируют уровень внутриклеточного рН, предупреждая закисление цитоплазмы, и контролируют трансэпителиальный транспорт ионов Na+, H+, Cl–. Активация NOX протеинов сопровождается возбуждением аквапоринов (AQP) и хлоридного канала ClC3, которые осуществляют трансмембранный транспорт H2O2 и O2– соответственно из внеклеточного пространства во внутриклеточный континуум (рис. 6) [24].
Заключение
Генерация активных кислородсодержащих метаболитов в легких преимущественно осуществляется специфическими ферментами, представляющими семейство NOX. Ферменты семейства NOX участвуют как в физиологических реакциях, так и в развитии различных патологических процессов в легких, к тому же ткань легкого особо чувствительна к токсическому воздействию АКМ. Поэтому разработка лекарственных средств, которые специфично регулировали бы активность различных представителей семейства NOX, может открыть новые возможности в предупреждении и лечении острых и хронических заболеваний органов дыхания.
1. Половинкина Е.О., Синицына Ю.В. Окислительный стресс и особенности воздействия слабых стрессоров физической природы на перекисный гомеостаз растительной клетки: Учебно-методическое пособие. — Нижний Новгород, 2010. — 62 с.
2. Altenhöfer S. The NOX toolbox: validating the role of NADPH oxidases in physiology and disease / S. Altenhöfer, P.W. Kleikers, K.A. Radermacher, P. Scheurer, J.J. Rob Hermans, P. Schiffers, H. Ho, K. Wingler, H.H. Schmidt // Cell. Mol. Life Sci. — 2012 Jul. — 69(14). — 2327-43. doi: 10.1007/s00018-012-1010-9.
3. Babior B.M. The neutrophil NADPH oxidase / B.M. Babior, J.D. Lambeth, W. Nauseef // Arch. Biochem. Biophys. — 2002 Jan 15. — 397(2). — 342-4. doi: 10.1006/abbi.2001.2642.
4. Babior B.M. Phagocytes and oxidative stress // Am. J. Med. — 2000 Jul. — 109(1). — 33-44. doi: http: // dx.doi.org/10.1016/S0002-9343(00)00481-2.
5. Babior B.M. NADPH oxidase // Curr. Opin. Immunol. — 2004 Feb. — 16(1). — 42-7. doi: 10.1016/j.coi.2003.12.001.
6. Bedard K. NOX family NADPH oxidases: not just in mammals / K. Bedard, B. Lardy, K.H. Krause // Biochimie. — 2007 Sep. — 89(9). — 1107-12. doi: 10.1016/j.biochi.2007.01.012.
7. Bokoch G.M. Current molecular models for NADPH oxidase regulation by Rac GTPase / G.M. Bokoch, B.A. Diebold // Blood. — 2002 Oct 15. — 100(8). — 2692-6. doi: http: // dx.doi.org/10.1182/blood-2002-04-1149.
8. Bokoch G.M. NADPH oxidases: not just for leukocytes anymore! / G.M. Bokoch, U.G. Knaus // Trends Biochem. Sci. — 2003 Sep. — 28(9). — 502-8. doi: http: // dx.doi.org/10.1016/S0968-0004(03)00194-4.
9. Brown D.I. Nox proteins in signal transduction / D.I. Brown, K.K. Griendling // Free Radic. Biol. Med. — 2009 Nov 1. — 47(9). — 1239-53. doi: 10.1016/j.freeradbiomed.2009.07.023.
10. Comhair S.A. Antioxidant responses to oxidant-mediated lung diseases / S.A. Comhair, S.C. Erzurum // Am. J. Physiol. Lung Cell. Mol. Physiol. — 2002 Aug. — 283(2). — L246-55. doi: 10.1152/ –ajplung.00491.2001.
11. DeCoursey T.E. Interactions between NADPH oxidase and voltage-gated proton channels: why electron transport depends on proton transport // FEBS Lett. — 2003 Nov 27. — 555(1). — 57-61. PMID. — 14630319.
12. Groemping Y. Activation and assembly of the NADPH oxidase: a structural perspective / Y. Groemping, K. Rittinger // Biochem. J. — 2005 Mar 15. — 386(Pt 3). — 401-16. doi: 10.1042/BJ20041835.
13. Guichard C. Les Nox/Duox: une nouvelle famille de NADPH oxydases / C. Guichard, E. Pedruzzi, M. Fay, S. Ben Mkaddem, N. Coant, F. Daniel, E. Ogier-Denis // Med. Sci (Paris). — 2006 Nov. — 22(11). — 953-9. doi: http: // dx.doi.org/10.1051/medsci/20062211953.
14. Imai H. Biological significance of phospholipid hydroperoxide glutathione peroxidase (PHGPx, GPx4) in mammalian cells / H. Imai, Y. Nakagawa // Free Radic. Biol. Med. — 2003 Jan 15. — 34(2). — 145-69. doi: 10.1016/S0891-5849(02)01197-8.
15. Jiang J. TGF-2 reduces nitric oxide synthase mRNA through a ROCK-dependent pathway in airway epithelial cells / J. Jiang, S.C. George // Am. J. Physiol. Lung Cell. Mol. Physiol. — 2011 Sep. — 301(3). — L361-7. doi: 10.1152/ajplung.00464.2010.
16. Jones D.P. Radical-free biology of oxidative stress // Am. J. Physiol. Cell. Physiol. — 2008 Oct. — 295(4). — C849-68. doi: 10.1152/ajpcell.00283.2008.
17. Kobayashi-Miura M. Oxygen sensing and redox signaling: the role of thioredoxin in embryonic development and cardiac diseases / M. Kobayashi-Miura, K. Shioji, Y. Hoshino, H. Masutani, H. Nakamura, J. Yodoi // Am. J. Physiol. Heart Circ. Physiol. — 2007 May. — 292(5). — H2040-50. doi: 10.1152/ajpheart.01316.2006.
18. Lambeth J.D. Nox/Duox family of nicotinamide adenine dinucleotide (phosphate) oxidases // Curr. Opin. Hematol. — 2002 Jan. — 9(1). — 11-7. PMID. — 11753072.
19. Leto T.L. Targeting and regulation of reactive oxygen species generation by Nox family NADPH oxidases / T.L. Leto, S. Morand, D. Hurt, T. Ueyama // Antioxid. Redox. Signal. — 2009 Oct. — 11(10). — 2607-19. doi: 10.1089/ARS.2009.2637.
20. Migdal C. Espéces réactives de l’oxygéne et stress oxidant / C. Migdal, M. Serres // Med. Sci (Paris). — 2011 Apr. — 27(4). — 405-12. doi: 10.1051/medsci/2011274017.
21. Mori I.C. Reactive Oxygen Species Activation of Plant Ca2+ Channels. A Signaling Mechanism in Polar Growth, Hormone Transduction, Stress Signaling, and Hypothetically Mechanotransduction / I.C. Mori, J.I. Schroeder // Plant. Physiol. — 2004 Jun. — 135(2). — 702-8. doi: 10.1104/pp.104.042069.
22. Nishinaka Y. Singlet oxygen is essential for neutrophil extracellular trap formation / Y. Nishinaka, T. Arai, S. Adachi, A. Takaori-Kondo, K. Yamashita // Biochem. Biophys. Res. Commun. — 2011 Sep 16. — 413(1). — 75-9. doi: 10.1016/j.bbrc.2011.08.052.
23. Rhee S.G. Cellular Regulation by Hydrogen Peroxide / S.G. Rhee, T.-S. Chang, Y.S. Bae, S.-R. Lee, S.W. Kang // J. Am. Soc. Nephrol. — 2003 Aug. — 14(8 Suppl 3). — S211-5. doi: 10.1097/01.ASN.0000077404.45564.7E.
24. Van der Vliet A. NADPH oxidases in lung biology and pathology: host defense enzymes, and more // Free Radic. Biol. Med. — 2008 Mar 15. — 44(6). — 938-55. doi: 10.1016/j.freeradbiomed.2007.11.016.
25. Vignais P.V. The superoxide-generating NADPH oxidase: structural aspects and activation mechanism // Cell. Mol. Life Sci. — 2002 Sep. — 59(9). — 1428-59. PMID. — 12440767.
26. Zmijewski J.W. Cell signalling by oxidized lipids and the role of reactive oxygen species in the endothelium / J.W. Zmijewski, A. Landar, N. Watanabe, D.A. Dickinson, N. Noguchi, V.M. Darley-Usmar // Biochem. Soc. Trans. — 2005 Dec. — 33(Pt 6). — 1385-9. doi: 10.1042/BST20051385.

/106/106.jpg)
/107/107.jpg)
/108/108.jpg)
/109/109_2.jpg)