Журнал «Здоровье ребенка» 3 (63) 2015
Вернуться к номеру
Механизм действия активированных кислородсодержащих метаболитов в респираторном тракте (часть 1)
Авторы: Абатуров А.Е. — ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. — Национальный медицинский университет им. А.А. Богомольца, г. Киев
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В обзоре даны современные представления об антимикробном механизме действия активированных кислородсодержащих метаболитов в респираторном тракте.
В огляді надані сучасні уявлення про антимікробний механізм дії активованих кисневмісних метаболітів у респіраторному тракті.
The review provides the current understanding of antimicrobial mechanism of action of activated oxygen-containing metabolites in the respiratory tract.
активированные кислородсодержащие метаболиты, заболевания органов дыхания.
активовані кисневмісні метаболіти, захворювання органів дихання.
activated oxygen-containing metabolites, respiratory diseases.
Статья опубликована на с. 122-126
Введение
На протяжении длительного периода изучения активированных кислородсодержащих метаболитов (АКМ) единственно полезным для макроорганизма их физиологическим эффектом считалось бактерицидное действие [2]. В последние годы появились доказательства, что АКМ являются внутриклеточными мессенджерами, которые играют важнейшую роль в регуляции активности внутриклеточных сигнальных молекулярных структур, модулирующих генную транскрипцию, скорость клеточной пролиферации, канализированность цитодифференцировки, характер клеточных реакций, процессы воспаления, апоптоза [9, 30].
Мессенджерная активность АКМ
В настоящее время идентифицированы бактериальные редокс-сенсоры (OxyR, SoxR редокс-чувствительные факторы транскрипции, молекулы шаперона Hsp33, FNR датчик кислорода и др.). Молекулы редокс-сенсоров характеризуются структурными особенностями, которые позволяют им «ощущать» конкретные АКМ и передавать возбуждение компонентам внутриклеточных сигнальных путей. В процессе эволюции простые бактериальные редокс-сенсоры были усовершенствованы или заменены на более специализированные протеины, такие как тиоловые пероксидазы дрожжей (ферменты, принадлежащие к семейству пероксиредоксинов или глутаредоксинов), факторы транскрипции Yap1 и Rap2.4a. У млекопитающих основными редокс-сенсорами являются: фактор транскрипции, индуцируемый гипоксией (HIF); ядерный фактор 2, подобный эритроидному деривату-2 (NRF-2); хлоридный внутриклеточный канал 2-го типа (chloride intracellular channel 2 — CLIC-2); рецептор-зависимый катионный канал переходного потенциала субсемейства M (transient receptor potential cation channel, subfamily M — TRPM); гомолог фосфатазы и тензина (phosphatase and tensin homolog — PTEN); рецептор продуктов конечного гликозилирования (receptor for advanced glycation endproducts — RAGE); протеин группы высокой мобильности бокс-1 (HMGB-1/амфотерин) (рис. 1) [26, 33].
/114/114.jpg)
Спектр пато- или физиологического действия АКМ во многом зависит от уровня их продукции. Умеренное увеличение внутриклеточного уровня cупероксидного анион-радикала (O2–•) приводит к образованию перекиси водорода (H2O2) в микромолярных концентрациях, что обусловливает пролиферацию различных типов клетки. В многочисленных исследованиях последних лет было установлено, что Н2О2 является одной из ключевых молекул внутриклеточной сигнализации, которая участвует в регуляции метаболизма клетки и является посредником митогенного эффекта активации рецепторов факторов роста. АКМ регулируют аутофагию, проницаемость ионов кальция мембран митохондрии, высвобождение кальция из эндоплазматического ретикулума. Чуть в более высоких концентрациях Н2О2 вызывает «арест» клеточного цикла или апоптоз клетки, а в милимолярных концентрациях может стать причиной выраженного окислительного повреждения внутриклеточных структур и некротической гибели клетки [13, 37].
Деструктивное действие АКМ
Чрезмерная продукция АКМ может стать причиной гибели эпителиоцитов и других клеток легочной ткани при острых и хронических заболеваниях органов дыхания. АКМ-индуцированное поражение ткани респираторного тракта при различных воспалительных заболеваниях является одним из основных патогенетических факторов, обусловливающих как тяжесть, так и течение болезни [3, 14, 15]. В основе повреждающего действия АКМ лежит окисление липидов, протеинов ДНК. Гидроксильные радикалы обусловливают перекисное окисление липидов, протекающее по типу цепной реакции, цитоплазматической мембраны и любых внутриклеточных органелл. Свободные аминокислоты и протеины также являются мишенью для окислительного повреждения. Окисление боковых цепей молекул аминокислот приводит к образованию карбонильных групп (альдегиды и кетоны). К оксидантной атаке особенно чувствительны такие аминокислоты, как пролин, аргинин, лизин и треонин. Окисление тиоловых групп цистеиновых аминокислотных остатков может привести к образованию дисульфидных связей и возникновению аномальной структуры протеина. Нарушение структуры белка приводит не только к потере им функциональной активности, но и к агрегации белков и гибели клеток. ДНК является основным субстратом супероксид анион-радикала. Окисление сахарных остатков нуклеотидов может стать причиной обрыва нити ДНК, окисление гистоновых белков протекает с формированием перекрестных связей, которые нарушают декомпактизацию хроматина и, как следствие, транскрипцию генов и репарацию ДНК. Влияние АКМ может привести к возникновению мутаций. Особенно уязвима митохондриальная ДНК. Повреждение митохондриальной ДНК даже при физиологических условиях происходит в пять-десять раз чаще, чем ядерной ДНК [6].
Примеры действия АКМ на липиды, протеины и ДНК приведены ниже.
Повреждение липидов, белков и ДНК активными кислородсодержащими метаболитами [31]
Окислительное повреждение липидов:
— Нарушение функционирования и целостности липидного бислоя клеточной мембраны.
Окислительное повреждение протеинов:
— Фрагментация пептидной цепи.
— Агрегирование продуктов деградации сшитых продуктов.
— Изменение электрического заряда молекулы.
— Повышение чувствительности к протеолитическим ферментам.
— Сайт-специфическая модификация аминокислот (аминокислоты отличаются по своей восприимчивости к действию АКМ).
— Окисление специфических аминокислот «отмечает» протеины для деградации специфическими протеазами.
— Окисление Fe-S-центров.
Окислительное повреждение ДНК:
— Делеция, транслокация.
— Деградация, однонитевые поломки.
— Образование сшивок белков и ДНК.
Процессы окисления протеинов, липидов и нуклеиновых кислот избыточными концентрациями АКМ в респираторном тракте подробно рассмотрены в обзорах Irfan Rahman [25], Marian Valko и соавт. [29], Jean Cadet и соавт. [7, 8], Gabriella Leonarduzzi и соавт. [19], Zsolt Radak и соавт. [1].
Антибактериальное действие АКМ
При инфекционном поражении респираторного тракта происходит возбуждение эпителиоцитов, альвеолярных макрофагов и нейтрофилов, которое характеризуется значительным увеличением концентрации АКМ как во внутритканевом пространстве, так и в бронхоальвеолярной жидкости [22]. Киллинг микроорганизмов АКМ осуществляется за счет непосредственного окисления молекулярных структур инфекционных агентов или опосредованно через активацию нейтрофильных протеаз супероксидным анионом радикалом и перекисью водорода [24, 35].
Функциональное взаимодействие АКМ и нейтрофильных протеаз увеличивает скорость эрадикации инфекционных агентов в нейтрофилах, находящихся в состоянии покоя, субъединицы gp91phox и p22phox преимущественно локализованы в мембране вторичных гранул. Во время активации нейтрофилов происходит слияние первичных (азурофильных) и вторичных гранул с фагоцитарной вакуолью, в которой компоненты их содержимого взаимодействуют между собой. Одним из эффектов этого взаимодействия является активация нейтрофильных сериновых протеаз, содержащихся в первичных гранулах [18]. Представляет интерес тот факт, что мыши с дефицитом нейтрофильной эластазы отличаются склонностью к развитию септического процесса при инфицировании грамотрицательными бактериями, в то время как катепсин-G (CG)-дефицитные мыши достаточно устойчивы к бактериальным инфектам. Оценивая вклад НАДФH-оксидазы и сериновых протеаз в антибактериальную защиту организма, R. Robert Vethanayagam и соавт. [28] установили, что НАДФH-оксидаза является несомненно более значимым компонентом этого процесса.
Супероксидный анион-радикал (O2–•)
В настоящее время существуют различные и в некоторой степени противоречивые данные об участии супероксидного анион-радикала (O2–•) в непосредственном киллинге микроорганизмов. Однако было показано, что при низких уровнях рН O2–• может быть прямым эффективным участником бактериального киллинга [24].
Перекись водорода
Перекись водорода, окисляя детерминанты клеточной стенки, играет важнейшую роль в киллинге бактерий. Во внутреннем пространстве фагосомы отмечается высокий уровень содержания АКМ. И хотя этот уровень концентрации АКМ ниже, чем те, которые необходимы для проявления антибактериального действия в условиях in vitro, в условиях фагосомы он достаточно эффективен. Считают, что концентрация АКМ в пространстве фагосомы распределена неравномерно, основное их содержание сосредоточено в непосредственной близости от инфекционного агента [12]. Используя H2O2, миелопероксидаза (MPO) нейтрофилов при физиологических концентрациях галоген-анионов генерирует мощный окислитель — гипохлорную кислоту, которая как сама, так и образующиеся при дальнейших ее преобразованиях радикалы обладают выраженным бактерицидным и противогрибковым действием. Определенную роль в бактериальном киллинге также играют производные взаимодействия лактопероксидазы с анионом тиоцианита и анионом йода.
Пероксинитрит
Супероксидный анион-радикал активно реагирует с монооксидом азота, образуя высокореактивный пероксинитрит, который обладает мощным бактерицидным действием [23].
Инактивация факторов вирулентности инфекционных патогенов
Показано, что АКМ не только оказывают бактерицидное действие, но и инактивируют различные факторы вирулентности патогенных микроорганизмов. Так, показано, что окисление АМК метионинового остатка в С-терминальном регионе молекулы бактериальных аутоиндукторов ингибирует активность кворум сенсинга, предупреждая организацию бактериальной биопленки [4, 20].
Регуляция рН и концентрации ионов в фагосоме
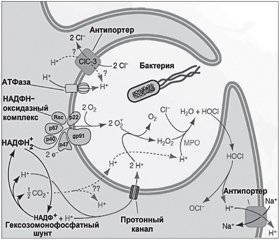
Генерируемые NOX2 АКМ, изменяя внутрифагосомальный уровень рН, концентрации ионов водорода и калия, обусловливают гибель патогенных микроорганизмов. Активация NOX2 приводит к увеличению концентрации O2–• в фагосомах и как следствие — к повышению регионального уровня рН. Emer P. Reeves и соавт. [27] показали, что повышение концентрации O2–• в фаголизосоме сопровождается увеличением как концентрации ионов K+, так и уровня pH. Активация NOX2 ассоциирована с компенсаторным усилением притока ионов H+ и K+ в фагосому, что изменяет осмолярность среды и увеличивает аффинность катионных протеаз, способствуя повышению активности бактериального киллинга. Щелочные условия и высокий уровень концентрации K+ усиливают протеолитическую деятельность эластазы и катепсина G — мощных эффекторов процесса бактериального киллинга (рис. 2) [4].
Участие АКМ в организации нейтрофильных внеклеточных ловушек
Под влиянием АКМ нейтрофилы во время инфекционного процесса «выбрасывают» сетевидные образования, которые получили название нейтрофильных внеклеточных ловушек — НВЛ (NET — Neutrophil Extracellular Traps) [32]. Выброс НВЛ сопровождается гибелью нейтрофилов — НВЛозом и высвобождением большого количества различных биологически активных веществ, в том числе и обладающих антибактериальной, антигрибковой и противовирусной активностью [21]. Также НВЛ образуются при активации нейтрофилов форболмиристатацетатом, IL-8/CXCL8 и некоторыми РАМР, в частности LPS. НВЛ представляют собой сети из гладких волокон с диаметром 15–17 нм, которые состоят из деконденсированного хроматина и содержат разнообразные пептиды и антимикробные факторы (BPI, L37, адреномедуллин, азуроцидин, гистоны Н1, Н2А, H2B, H3, H4, желатиназа, кальпротектин, каталаза, катепсин G, лактоферрин, лизоцим, MPO, миозин-9, нейтрофильная эластаза). ДНК является основным структурным компонентом НВЛ. Объемная сетевая структура НВЛ обеспечивает фиксацию патогенов, а высокая локальная концентрация антимикробных веществ — гибель микроорганизмов. НВЛ-ассоциированный бактериальный киллинг является высокоэффективным механизмом уничтожения грамположительных и грамотрицательных бактерий, в том числе и таких респираторно-тропных инфекционных агентов, как Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes [5, 11, 34, 36].
Считают, что нарушение формирования АКМ-индуцированного НВЛ-ассоциированного внеклеточного бактериального киллинга является важнейшим звеном патогенеза системного инфекционного процесса у новорожденных [16, 17].
1. Age-associated neurodegeneration and oxidative damage to lipids, proteins and DNA / Z. Radak, Z. Zhao, S. Goto, E. Koltai // Mol. Aspects Med. — 2011 Aug. — 32(4–6). — 305-15. — doi: 10.1016/j.mam.2011.10.010.
2. Babior B.M. Phagocytes and oxidative stress // Am. J. Med. — 2000 Jul. — 109(1). — 33-44. — doi: http://dx.doi.org/10.1016/S0002-9343(00)00481-2.
3. Bae Y.S., Oh H., Rhee S.G., Yoo Y.D. Regulation of reactive oxygen species generation in cell signaling // Mol. Cells. — 2011 Dec. — 32(6). — 491-509. — doi: 10.1007/s10059-011-0276-3.
4. Bedard K., Lardy B., Krause K.H. NOX family NADPH oxidases: not just in mammals // Biochimie. — 2007 Sep. — 89(9). — 1107-12. — doi: 10.1016/j.biochi.2007.01.012.
5. Brinkmann V., Zychlinsky A. Beneficial suicide: why neutrophils die to make NETs // Nat. Rev. Microbiol. — 2007 Aug. — 5(8). — 577-82. — doi: 10.1038/nrmicro1710.
6. Burton G.J., Jauniaux E. Oxidative stress // Best Pract. Res. Clin. Obstet. Gynaecol. — 2011 Jun. — 25(3). — 287-99. — doi: 10.1016/j.bpobgyn.2010.10.016.
7. Cadet J., Douki T., Ravanat J.L. Oxidatively generated base damage to cellular DNA // Free Radic. Biol. Med. — 2010, Jul 1. — 49(1). — 9-21. — doi: 10.1016/j.freeradbiomed.2010.03.025.
8. Cadet J., Douki T., Ravanat J.L. Oxidatively generated damage to cellular DNA by UVB and UVA radiation // Photochem. Photobiol. — 2015 Jan — Feb. — 91(1). — 140-55. — doi: 10.1111/php.12368.
9. Ciencewicki J., Trivedi S., Kleeberger S.R. Oxidants and the pathogenesis of lung diseases // J. Allergy Clin. Immunol. — 2008 Sep. — 122(3). — 456-68; quiz 469-70. — doi: 10. 1016/j.jaci.2008.08.004.
10. DeCoursey T.E. Voltage-gated proton channels find their dream job managing the respiratory burst in phagocytes // Physiology (Bethesda). — 2010 Feb. — 25(1). — 27-40. — doi: 10.1152/physiol.00039.2009.
11. Dying for a cause: NETosis, mechanisms behind an antimicrobial cell death modality / Remijsen Q., Kuijpers T.W., Wirawan E., Lippens S., Vandenabeele P., Vanden Berghe T. // Cell. Death Differ. — 2011 Apr. — 18(4). — 581-8. — doi: 10.1038/cdd.2011.1.
12. Fang F.C. Antimicrobial actions of reactive oxygen species // MBio. — 2011, Sep 6. — 2(5). — pii: e00141-11. — doi: 10.1128/mBio.00141-11.
13. Hawkes W.C., Alkan Z. Regulation of redox signaling by selenoproteins // Biol. Trace Elem. Res. — 2010 Jun. — 134(3). — 235-51. — doi: 10.1007/s12011-010-8656-7.
14. Hyperoxia sensing: from molecular mechanisms to significance in disease / A. Gore, M. Muralidhar, M.G. Espey, K. Degenhardt, L.L. Mantell // J. Immunotoxicol. — 2010 Oct — Dec. — 7(4). — 239-54. — doi: 10.3109/1547691X.2010.492254.
15. Hyperoxia-induced signal transduction pathways in pulmonary epithelial cells / T.E. Zaher, E.J. Miller, D.M. Morrow, M. Javdan, L.L. Mantell // Free Radic. Biol Med. — 2007, Apr 1. — 42(7). — 897-908. — doi: 10.1016/j.freeradbiomed.2007.01.021.
16. Impaired neutrophil extracellular trap (NET) formation: a novel innate immune deficiency of human neonates / C.C. Yost, M.J. Cody, E.S. Harris, N.L. Thornton, A.M. McInturff, M.L. Martinez, N.B. Chandler, C.K. Rodesch, K.H. Albertine, C.A. Petti, A.S. Weyrich, G.A. Zimmerman // Blood. — 2009, Jun 18. — 113(25). — 6419-27. — doi: 10.1182/blood-2008-07-171629.
17. Impaired neutrophil extracellular trap formation: a novel defect in the innate immune system of aged individuals / J. Hazeldine, P. Harris, I.L. Chapple, M. Grant, H. Greenwood, A. Livesey, E. Sapey, J.M. Lord // Aging Cell. — 2014 Aug. — 13(4). — 690-8. — doi: 10.1111/acel.12222
18. Killing activity of neutrophils is mediated through activation of proteases by K+ flux / E.P. Reeves, H. Lu, H.L. Jacobs, C.G. Messina, S. Bolsover, G. Gabella, E.O. Potma, A. Warley, J. Roes, A.W. Segal // Nature. — 2002, Mar 21. — 416(6878). — 291-7. — doi:10.1038/416291a.
19. Leonarduzzi G., Sottero B., Poli G. Targeting tissue oxidative damage by means of cell signaling modulators: the antioxidant concept revisited // Pharmacol. Ther. — 2010 Nov. — 128(2). — 336-74. — doi: 10.1016/j.pharmthera.2010.08.003.
20. NADPH oxidases in lung health and disease / K. Bernard, L. Hecker, T.R. Luckhardt, G. Cheng, V.J. Thannickal // Antioxid. Redox Signal. — 2014, Jun 10. — 20(17). — 2838-53. — doi: 10.1089/ars.2013.5608.
21. Neutrophil extracellular traps: how to generate and visualize them / V. Brinkmann, B. Laube, U. Abu Abed, C. Goosmann, A. Zychlinsky // J. Vis. Exp. — 2010, Feb 24. — 36. — pii: 1724. — doi: 10.3791/1724.
22. Oxidant-Antioxidant Balance in Acute Lung Injury / J.D. Lang, P.J. McArdle, P.J. O’Reilly, S. Matalon // Chest. — 2002 Dec. — 122(6 Suppl). — 314S-320S. — doi:10.1378/chest.122.6_suppl.314S.
23. Peroxynitrite-An ugly biofactor? / P. Ascenzi, A. di Masi, C. Sciorati, E. Clementi // Biofactors. — 2010 Jul — Aug. — 36(4). — 264-73. — doi: 10.1002/biof.103.
24. Rada B., Leto T.L. Oxidative innate immune defenses by Nox/Duox family NADPH oxidases // Contrib. Microbiol. — 2008. — 15. — 164-87. — doi: 10.1159/000136357.
25. Rahman I. Oxidative Stress, Chromatin Remodeling and Gene Transcription in Inflammation and Chronic Lung Diseases // J. Biochem. Mol. Biol. — 2003, Jan 31. — 36(1). — 95-109.
26. Redox modulation of HMGB1-related signaling / C. Janko, M. Filipović, L.E. Munoz, C. Schorn, G. Schett, I. Ivanović-Burmazović, M. Herrmann // Antioxid. Redox Signal. — 2014, Mar 1. — 20(7). — 1075-85. — doi: 10.1089/ars.2013.5179.
27. Reeves M.A., Hoffmann P.R. The human selenoproteome: recent insights into functions and regulation // Cell. Mol. Life Sci. — 2009 Aug. — 66(15). — 2457-78. — doi: 10.1007/s00018-009-0032-4.
28. Role of NADPH oxidase versus neutrophil proteases in antimicrobial host defense / R.R. Vethanayagam, N.G. Almyroudis, M.J. Grimm, D.C. Lewandowski, C.T. Pham, T.S. Blackwell, R. Petraitiene, V. Petraitis, T.J. Walsh, C.F. Urban, B.H. Segal // PLoS One. — 2011. — 6(12). — e28149. — doi: 10.1371/journal.pone.0028149.
29. Role of oxygen radicals in DNA damage and cancer incidence / M. Valko, M. Izakovic, M. Mazur, C.J. Rhodes, J. Telser // Mol. Cell. Biochem. — 2004 Nov. — 266(1–2). — 37-56.
30. Rosanna D.P., Salvatore C. Reactive oxygen species, inflammation, and lung diseases // Curr. Pharm. Des. — 2012. — 18(26). — 3889-900. — doi: 10.2174/138161212802083716.
31. Scandalios J.G. Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses // Braz. J. Med. Biol. Res. — 2005 Jul. — 38(7). — 995-1014 // http://dx.doi.org/10.1590/S0100-879X2005000700003.
32. Singlet oxygen is essential for neutrophil extracellular trap formation / Y. Nishinaka, T. Arai, S. Adachi, A. Takaori-Kondo, K. Yamashita // Biochem. Biophys. Res. Commun. — 2011, Sep 16. — 413(1). — 75-9. — doi: 10.1016/j.bbrc.2011.08.052.
33. Tang D., Kang R., Zeh H.J. 3rd, Lotze M.T. High-mobility group box 1, oxidative stress, and disease // Antioxid. Redox Signal. — 2011, Apr 1. — 14(7). — 1315-35. — doi: 10.1089/ars.2010.3356.
34. Vorobjeva N.V., Pinegin B.V. Neutrophil extracellular traps: mechanisms of formation and role in health and disease // Biochemistry (Mosc.). — 2014 Dec. — 79(12). — 1286-96. — doi: 10.1134/S0006297914120025.
35. Winterbourn C.C. Reconciling the chemistry and biology of reactive oxygen species // Nat. Chem. Biol. — 2008 May. — 4(5). — 278-86. — doi: 10.1038/nchembio.85.
36. Yam-Puc J.C., García-Marín L., Sánchez-Torres L.E. Trampas extracelulares de neutrífilos (NET), consecuencia de un suicidio cellular // Gac. Med. Mex. — 2012 Jan — Feb. — 148(1). — 68-75.
37. Ye Z.W., Zhang J., Townsend D.M., Tew K.D. Oxidative stress, redox regulation and diseases of cellular differentiation // Biochim. Biophys. Acta. — 2014, Nov 15. — pii: S0304-4165(14)00387-0. — doi: 10.1016/j.bbagen.

/117/117.jpg)