Журнал «Медицина неотложных состояний» 4 (67) 2015
Вернуться к номеру
Вплив інфузійної терапії на редокс-баланс оксидант-антиоксидантних систем у тканині легенів при тяжкій поєднаній травмі в експерименті
Авторы: Рощін Г.Г. — Кафедра медицини катастроф НМАПО ім. П.Л. Шупика, м. Київ, ДЗ «Український науково-практичний центр екстреної медичної допомоги та медицини катастроф МОЗ України», м. Київ; Крилюк В.О., Кузьмін В.Ю. — Кафедра медицини катастроф НМАПО ім. П.Л. Шупика, м. Київ; Гудима А.А. — ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України»; Іванов В.І., Максименко М.А., Пенкальський О.О. — ДЗ «Український науково-практичний центр екстреної медичної допомоги та медицини катастроф МОЗ України», м. Київ
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
На фоні експериментальної тяжкої поєднаної травми вивчено вплив інфузійної терапії на цитотоксичність прооксидантних систем (малонового діальдегіду та дієнових кон’югат) і активність антиоксидантної ланки ферментів (супероксиддисмутази та каталази) у тканині легень піддослідних тварин. Встановлено, що на фоні ранньої інфузійної терапії вже через 6 годин перебігу травматичного процесу настає зниження активності цих показників та встановлення редокс-балансу оксидант-антиоксидантних систем у тканині легень. Отримано кращі результати виживання упродовж доби тварин, яким уводили препарат комбінованої інфузійної терапії (HAES-LX-5%) на основі 5% ГЕК 130/0,4, 5% ксилітолу, 1,5% натрію лактату та збалансованого розчину електролітів.
На фоне экспериментальной тяжелой сочетанной травмы изучено влияние инфузионной терапии на цитотоксичность прооксидантных систем (малонового диальдегида и диеновых конъюгат) и активность антиоксидантного звена ферментов (супероксиддисмутазы и каталазы) в ткани легких подопытных животных. Установлено, что на фоне ранней инфузионной терапии уже через 6 часов травматического процесса наступает снижение активности этих показателей и установление редокс-баланса оксидант-антиоксидантных систем в тканях легких. Получены лучшие результаты выживания в течение первых суток животных, которым вводили препарат комбинированной инфузионной терапии (HAES-LX-5%) на основе 5% ГЭК 130/0,4, 5% ксилитола, 1,5% натрия лактата и сбалансированного раствора электролитов.
Against the background of experimental severe concomitant injury, there has been studied the effect of infusion therapy on cytotoxicity of prooxidant systems (malondialdehyde and diene conjugates) and the activity of antioxidant level of enzymes (superoxide dismutase and catalase) in the lung tissues of experimental animals. It has been established that in the context of early infusion therapy, already within 6 hours of the traumatic process, there occurs a decrease in the activity of these indicators, as well as the redox-balance of oxidant-antioxidant systems in the lung tissues. The best survival rates during 24 hours were in animals which were administered a drug of combined infusion therapy (HAES-LX-5%) based on 5% hydroxyethyl starch 130/0.4, 5% xylitol, 1.5% sodium lactate and balanced electrolyte solution.
тяжка поєднана травма, малоновий діальдегід, дієнові кон’югати, каталаза, супероксиддисмутаза, індекс оксидації, експеримент.
тяжелая сочетанная травма, инфузионная терапия, малоновый диальдегид, диеновые конъюгаты, каталаза, супероксиддисмутаза, индекс оксидации, эксперимент.
severe concomitant injury, malondialdehyde, diene conjugates, catalase, superoxide dismutase, oxidation index, experiment.
Статья опубликована на с. 39-44
Вступ
Сучасний етап удосконалення лікування постраждалих із поєднаною травмою (ПТ) в Україні характеризується зміною науково-практичної концепції — від статичної теорії травматичного шоку до динамічної концепції травматичної хвороби [7]. У патогенезі розвитку травматичної хвороби одне з провідних місць займає перекисне окислення ліпідів (ПОЛ), що являє собою первинну реакцією, яка призводить до деструкції ліпопротеїдного комплексу мембран і порушує їх транспортну функцію, а також пригнічує процеси генерації енергії, що в кінцевому підсумку знижує життєдіяльність клітин [3, 16]. Ці процеси є найбільш суттєвими та значимими в адаптивному оновленні та репарації ліпопротеїдних мембран, зростанні потужності та буферної ємності редокс-систем, підвищенні ефективності ферментативного та неферментативного антиоксидантного захисту (АОЗ) [12, 19].
Одним з органів, найбільш схильних до системної мембранопатії, є легені, оскільки активні форми кисню перш за все діють на альвеолярну поверхню легенів, вкриту сурфактантом, що складається на 90 % із фосфоліпідів та на 5–10 % із білків. У тканинах легенів під впливом ПТ найбільша інтенсифікація ПОЛ і виснаження системи АОЗ спостерігається на 3-тю добу, проте до початку проявів травматичної хвороби у тканині легенів інтенсивність ПОЛ та АОЗ не досліджена [2, 5, 8, 16].
Альвеолярні макрофаги є першими імунологічно-компетентними клітинами, що взаємодіють з антигеном і потім представляють його Т-лімфоцитам. Цитоплазма макрофагів містить велику кількість лізосом, що мають набір гідролітичних ферментів: пероксидази, каталази (КАТ) й оксидазно-ферментативний комплекс — нікотинамідаденіндинуклео–тидфосфат (НАДФ), що забезпечують виділення бактеріоцидного супероксид-аніону кисню (O2–) [16, 20, 21].
Утворений O2– є попередником широкого спектра вільних радикалів і пероксидів органічних та неорганічних сполук, що обумовлюють пошкодження та деструкцію білків і ліпідів мембран, нуклеїнових кислот об’єкта фагоцитозу, — синглетного кисню (О2–), гідроксильного радикала (ОН–), пероксиду водню (Н2О2). За цих умов у нейтрофілах 90 % кисню відновлюється до O2–, розвивається так званий кисневий спалах, або «дихальний вибух». Вільнорадикальне окислення є універсальним механізмом, за допомогою якого контролюються найважливіші гомеостатичні фізико-хімічні параметри клітини: в’язкість, вибіркова проникність і цілісність клітинних мембран [24, 26].
Процеси ПОЛ починаються в мітохондріях, причому спостерігається як утворення вільнорадикальних продуктів ПОЛ, так і перегрупування подвійних зв’язків у дієнову кон’юговану систему, тобто дієнові кон’югати (ДК), та в карбонільні сполуки, наприклад малонового діальдегіду (МД) як метаболіту кінцевого продукту ПОЛ, частка якого становить 40 % усіх метаболітів [1, 4, 13, 24]. З ушкоджувальним ефектом цих сполук пов’язують порушення структури й експресії мітохондріального геному клітин унаслідок конверсії мікросомального цитохрома Р450 в нативну форму Р420. Пошкоджені мітохондрії втрачають здатність накопичувати іони кальцію (Ca2+), що підвищуєть активність мембранних фосфоліпази, призводить до накопичення вільних жирних кислот та збільшує інтенсивність ПОЛ, отже, через нестачу енергії настає апоптоз клітин [1, 12].
При цьому сам фагоцит захищений від дії вказаних вище агентів, оскільки в його цитоплазмі є комплекси захисних неферментних факторів (глутатіон, вітаміни Е, С, жирні кислоти) і ферментів (супероксиддисмутаза (СОД), глутатіонпероксидаза, КАТ, що інактивують H2O2) [11, 14, 25].
Першу лінію захисту становлять внутрішньоклітинні інгібітори вільнорадикального окислення: СОД, КАТ та пероксидаза. СОД за участі b-токоферолу каталізують каскад реакцій (формули 1–3) [18]:
2O2– + 2Н+ → H2O2 + O2, (1)
або
Н+ + О2– → НО2–, (2)
та далі:
НО2– + НО2– • СОД чи спонтанно Н2О2 + О2, (3)
причому H2O2, що утворюється під час різних окислювальних процесів флавопротеїдів в організмі, може розкладатися на КАТ або використовуватися в реакціях, що каталізуються пероксидазою [23]. Фермент КАТ, що бере участь у тканинному диханні, є другою ланкою захисту від власного О2–. Взаємодія каталази з H2O2 відбувається у дві стадії, тобто вона може бути й окислювачем (формула 4), і відновником (формула 5) [9, 15]:
R(Fe2+)2 + H2O2 → R(Fe3++OH–)2; (4)
H2O2 + H2O2 → O2 + 2H2О, (5)
де R — молекула ферменту КАТ. Як і в разі СОД, швидкість реакції визначається дифузією і не вимагає енергії для активації [18].
Зростання активності СОД у тканинах органів черевної порожнини та легенях додатково свідчить про провідну роль утворення активних форм кисню в патогенезі тяжкої ПТ, що обумовлено оксидативним стресом і має місце у фазу «гіперметаболізму» травматичної хвороби [5, 22]. Як було наведено В.К. Казімірко і співавт. (2004), інтенсифікація вільнорадикальних процесів і ПОЛ спостерігається при розвитку загального неспецифічного адаптаційного синдрому (стресу) [6]. Активація ПОЛ є універсальним механізмом розвитку запалення та тканинної дистрофії, в процесі яких переплітаються механізми судинно-тромбоцитарного гемостазу [17, 25].
Через це динаміка змін показників системи ПОЛ та антиоксидантного захисту є одним із критеріїв міри напруження реакцій адаптації у постраждалих із ПТ, інтегральну оцінку якої відображає індекс оксидації (ІО) [6, 8]. Саме у період із 6 до 48 год після травмування розгортаються основні патофізіологічні реакції, що обумовлюють дисбаланс оксидант-антиоксидантних систем. У цей же період, а саме до завершення першої доби, у більшості постраждалих розвивається дистрес-реакція органів та систем, що в подальшому призводить до розвитку системної поліорганної недостатності [7, 22, 27].
Вищезазначене стало теоретичною передумовою для проведеного нами експериментального дослідження з вивчення впливу комбінованої інфузійної терапії за умов гемічної гіпоксії на початок розвитку гострого періоду ПТ у піддослідних тварин. Причому початок розвитку ПТ як на морфологічному, так і біохімічному рівні, особливо відповідає змінам у тканині легенів як органу-мішені. Тому при застосуванні препарату HAES-LX-5% та препарату колоїдної інфузійної терапії рефортан проведено порівняльний аналіз виживання тварин у додобовий період ПТ.
Мета дослідження — в умовах експериментальної тяжкої ПТ вивчити вплив інфузійної терапії на редокс-баланс оксидант-антиоксидантних систем, на основі оцінки відношення між показниками системи перекисного окислення ліпідів (МД і ДК) та антиоксидантної ланки ферментів (СОД і КАТ) у тканині легень піддослідних тварин. Причому стає можливим встановити вплив комбінованої інфузійної терапії на виживання при її застосуванні вже на початку гострого періоду ТП.
Матеріали та методи
У статевозрілих самців білих щурів (лінії Wistar) масою від 200 г до 220 г змодельовано тяжку ПТ органів черевної порожнини. Тварин обстежували через 1, 6, 12 та 24 год після нанесення ПТ. Кожна дослідна підгрупа включала 12 тварин. У подальшому нами було сформовано такі групи досліджень: ГД-1 — травма без проведення лікування (n = 48); ГД-2 — травма та застосування препарату рефортан (n = 48); ГД-3 — травма та застосування препарату HAES-LX-5% (n = 48). Отримані дані порівнювали з групою контролю (ГК) — 12 здорових тварин, яких тільки вводили в наркоз. Стан ферментативної системи ПОЛ визначали у тканинах легень тварин, які залишались живими впродовж експерименту. Активність КАТ (КФ 1.11.1.6) визначали за швидкістю утилізації H2O2 з використанням FOX-реактиву. Активність СОД (КФ 1.15.1.1.) розраховували за відсотком гальмування реакції автоокислення кверцетину, зарахованому до кількості протеїдів у пробі (мг) (за методом В.А. Костюкова, 1990) [10]. За характеристику груп для ознак із розподілом, відповідно до закону Гаусса, визначали середнє арифметичне значення та стандартну похибку (M ± m).
З метою оцінки відношення між системами ПОЛ та АОЗ використовувався інтегральний показник — ІО (ум.од.) як співвідношення середнього значення вмісту ланки ферментів у травмованої тварини та контролю, поділеного на кількість доданків, за впровадженою нами формулою (6), причому нормальні значення знаходяться в межах (0,9–1,1):
/41/41.jpg)
де т — травмовані піддослідні тварини; к — піддослідні тварини ГК.
Динаміку змін ІО та показника виживання піддослідних тварин відображено у вигляді поліноміальної лінії тренда через 1, 6, 12 та 24 год після нанесення ПТ. Близькість значень лінії тренда до фактичних даних визначали на підставі коефіцієнта вірогідності апроксимації (R2), що обчислюється в межах від 0 до 1. Якщо значення R2 близьке до 1, то поліноміальна лінія тренда найбільшою мірою наближається до наведеної на діаграмі залежності та відображає прогноз подальшої динаміки тренда.
Результати та обговорення
Дані проведеного експериментального дослідження подано в табл. 1 і 2. На початковому етапі дослідження встановлено, що у відповідь на ПТ органів черевної порожнини в ГД-1 відзначались односпрямовані відхилення активності метаболітів кінцевого продукту ПОЛ — МД та ДК у тканинах легенів тварин у бік зростання з 1 до 24 год експерименту, з тенденцією до подальшого зростання (табл. 1).
А саме, в ГД-1 через 1 год. експерименту активність МД зросла порівняно з ГК (0,025 ± 0,003 мкмоль/кг) на 84,0 %, через 6 год досягла збільшення у 2,9 раза, через 12 год — у 4,8 раза та до 24 год зросла у 6,7 раза (0,168 ± 0,050 мкмоль/кг).
Також через 1 год експерименту активність ДК порівняно з ГК (0,211 ± 0,070 ум.од./мг) досягала збільшення у 2,1 раза, через 6 год — у 2,9 раза, через 12 год — у 3,1 раза та до 24 год зросла у 3,3 раза (0,69 ± 0,09 ум.од./мг), але відзначається щодо повільного зростання активності ДК до 12 та 24 год порівняно зі зростанням активності МД. Це вказує на дисбаланс активності цих ферментів у тварин, яким не проводилось лікування в умовах оксидативного стресу при ПТ.
У ГД-2 та ГД-3 відзначалось хвилеподібне зростання рівня активності МД та ДК із 1 до 6 год експерименту та зниження на 12 год із тенденцією до подальшого зростання до 24 год експерименту (табл. 1). Але в ГД-3 виявляються менш повільні хвилеподібні зміни активності цих ферментів, тобто через 1 год експерименту активність МД зросла порівняно з ГК (0,025 ± 0,003 мкмоль/кг) на 52,0 %, до 6 год відзначалось збільшення активності ферменту у 2,5 раза (0,065 ± 0,001 мкмоль/кг) та утрималось до 12 год, з подальшою тенденцією до зниження на 12,0 % до 24 год експерименту. Також через 1 год експерименту активність ДК порівняно з ГК (0,211 ± 0,070 ум.од./мг) досягала збільшення на 65,0 %, через 6 год — у 2,6 раза, але до 12 год активність ферменту зменшилась (0,366 ± 0,006 ум.од./мг) в 1,5 раза з тенденцією до попереднього подальшого зростання до 24 год у 2,1 раза (0,448 ± 0,030 ум.од./мг).
У відповідь на інтенсифікацію вільнорадикальних процесів та ПОЛ спостерігається підвищення активності ферментів АОЗ, а саме КАТ та СОД. У ГД-1 через 1 год експерименту активність КАТ зросла порівняно з ГК (3,67 ± 0,68 мккат/кг) на 15,0 %, через 6 год — на 20,0 %, через 12 год — на 30,5 %, але до 24 год відзначалося повільне зниження активності КАТ (3,64 ± 0,01 мккат/кг) до показника ГК (табл. 2).
Також через 1 год експерименту в ГД-1 спостерігалось зростання активності СОД порівняно з ГК (0,95 ± 0,18 ум.од./мг) на 13,7 %, через 6 год — на 93,7 %, через 12 год — збільшення у 2,1 раза, але до 24 год також відзначалося повільне зниження активності СОД (1,01 ± 0,01 ум.од./мг) до показника ГК.
Таким чином, у ГД-1 зниження активності показників ферментів АОЗ до 24 год експерименту та їх дисбаланс свідчать про порушення адаптивного співвідношення систем ПОЛ та АОЗ у тварин, яким не проводилось лікування з приводу ПТ.
Між показниками АОЗ у ГД-2 взагалі відзначаються динамічні зміни активності ферментів за типом «ножиць» (табл. 2), що вказує на підвищену здатність КАТ тривало зберігати свою активність в ураженому органі. Зниження ферментативної активності показників системи ПОЛ до 6 год та впродовж 12 год експерименту, з неухильним зростанням до 24 год характеризує порушення рівноваги ПОЛ — АОЗ ланки ферментів внаслідок виснаження активності системи АОЗ та прояви його дисбалансу як можливої реакції на гіпертрансформацію Н2О2, що провокуює клітинний апаптоз та некроз тканин легенів. Це обумовлює потребу в корекції інфузійної терапії при застосуванні препарату рефортан упродовж гострого періоду травматичного процесу.
У ГД-3 між показниками АОЗ відзначаються позитивні динамічні зміни активності ферментів вже на 6-ту та 12-ту год експерименту. Через 1 год експерименту активність КАТ зросла порівняно з ГК (3,67 ± 0,68 мкмоль/кг) на 6,2 % та утримувалась упродовж 6 год. До 12-ї год активність КАТ зросла в 1,7 раза (6,39 ± 0,01 мкмоль/кг) із подальшим зниженням активності практично до показників ГК (3,84 ± 0,01 мкмоль/кг), відповідно до чого через 1 год експерименту активність СОД зросла порівняно з ГК (0,95 ± 0,18 ум.од./мг) на 25,1 %, через 6 год — у 2,1 раза (1,92 ± 0,01 ум.од./мг) із тенденцією до подальшого зменшеня активності ферменту (0,92 ± 0,01 ум.од./мг) до показників ГК. До 24-ї год відзначається деяке виснаження ферментативної активності СОД (0,68 ± 0,01 ум.од./мг), що нижче за показник ГК на 40 % (табл. 2). На наш погляд, це пов’язано з індивідуальними особливостями організму: в одних — як результат адаптаційно-компенсаторних процесів, в інших — виснаження адаптаційних процесів, що слід ураховувати в тактиці експериментальної інтенсивної терапії.
Для більш ретельної оцінки відношення між системами ПОЛ та АОЗ в ГД-1, ГД-2 та ГД-3 проведено порівняльний аналіз показника ІО (табл. 3, рис. 1).
/42/42.jpg)
Встановлено, що в ГД-1 відзначається збільшення показника ІО від 1,6 ум.од. за 1 год експерименту до 3,24 ум.од. до 24 год. Тобто співвідношення середнього значення вмісту ланки ферментів у травмованих тварин, що не отримали лікування політравми, вказує на потужне зростання активності системи ПОЛ у 2 рази та дисбаланс у прооксидантно-оксидантному відношенні. У ГД-2 відзначається збільшення показника ІО від 1,3 ум.од. за 1 год eксперименту до 2,5 ум.од. до 24 год, що вказує на зростання активності системи ПОЛ в 1,9 раза, але динаміка зміни показника ІО значно менша, ніж у ГД-1. У ГД-3 виявляється збільшення показника ІО від 1,25 ум.од. за 1 год eксперименту до 1,45 ум.од. до 12 год, що вказує на зростання активності системи ПОЛ лише в 1,1 раза.
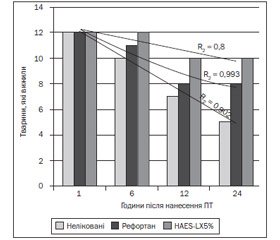
За даними стратифікаційного аналізу виживання піддослідних тварин встановлено, що у ГД-1 із 48 тварин померло 14, що становило 29,2 %; у ГД-2 — 9 (18,7 %) тварин; у ГД-3 померло 4 (8,3 %) тварини впродовж 24 год кожного експерименту (табл. 3, рис. 2).
/43/43.jpg)
Отже, у ГД-3 при використанні препарату HAES-LX-5% у піддослідних тварин відзначається повільна динаміка змін показника ІО та близького до нормального його значення, ніж в інших групах експерименту.
Висновки
1. У ранньому травматичному періоді (через 6 год після травмування та впродовж 12 год) відзначається зростання вмісту КАТ та СОД у тканинах легенів піддослідних тварин, що підтверджує активізацію АОЗ у відповідь на збільшення активності системи перекисного окислення при травмі незалежно від її тяжкості.
2. На фоні ранньої інфузійної терапії вже через 6 год перебігу травматичного періоду настає зниження активності показників ферментативної ланки оксидант-антиоксидантних систем та встановлення редокс-балансу, що підтверджено повільною динамікою зміни показника ІО та близького до нормального його значення при використанні препарату HAES-LX-5% у піддослідних тварин, ніж в інших групах експерименту.
3. Упродовж доби та через 24 год після травми отримано кращі результати виживання піддослідних тварин, яким уводили препарат комбінованої інфузійної терапії (HAES-LX-5%). Експериментальне дослідження підтверджує правило «золотої години» в хірургії про необхідність проведення раннього комплексного лікування постраждалих у гострому періоді травматичної хвороби незалежно від ступеня клінічних проявів.
1. Барабой В.А., Сутковой Д.А. Окислительно-антиоксидантный гомеостаз в норме и при патологии: монография / Под ред. акад. АМН Украины Ю.А. Зозули. — К.: Чернобыльинтеринформ, 1997. — 220 с.
2. Бородин Е.А., Егоршина Е.В., Самсонов В.П. Биохимия эндотоксикоза. Механизмы развития и оценка степени тяжести при воспалительных заболеваниях легких. — Благовещенск: АГМА, 2003. — 129 с.
3. Вавин В.Г, Григорьев Е.В., Разумов А.С. Патогенетическое обоснование интенсивной коррекции липопероксидазного статуса у пострадавших с политравмой // Вестник интенсивной терапии. — 2005. — № 5. — С. 106-109.
4. Гончарук Є.Г., Коршун М.М. Вільнорадикальне окислення як універсальний неспецифічний механізм пошкоджуючої дії шкідливих чинників довкілля // Журнал АМН України. — 2004. — Т. 10, № 1. — С. 131-150.
5. Ельский В.Н., Климовицкий В.Г., Золотухин С.Е. и др. Избранные аспекты патогенеза и лечения травматической болезни. — Донецк: ООО «Лебедь», 2002. — 360 с.
6. Казимирко В.К., Мальцев В.И., Бутылин В.Ю., Горобец Н.И. Свободнорадикальное окисление и антиоксидантная терапія. — К.: Морион, 2004. — 160 с.
7. Калинкин О.Г. Травматическая болезнь // Травма. — 2013. — № 3(14) — С. 59-65.
8. Козак Д.В. Антиоксидантно-прооксидантное соотношение в тканях легких в динамике политравмы // Медицина образования Сибири. — 2014. — № 1. — С. 14-16.
9. Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы // Лаб. дело. — 1988. — № 1. — С. 16-19.
10. Костюк В.А., Потапович А.И., Ковалева Ж.В. Простой и чувствительный метод определения активности супероксиддисмутазы, основанный на реакции окисления кверцетина // Вопроcы медицинской химии. — 1990. — № 2. — С. 88-91.
11. Костюк В.А., Потапович А.И. Биорадикалы и биоантиоксиданты. — Минск: БГУ, 2004. — 174 с.
12. Курашвили Л.В., Васильков В.Г. Липидный обмен при неотложных состояниях. — Пенза: Пензенский институт усовершенствования врачей, 2003. — 198 с.
13. Лущак В.І., Багнюкова Т.В., Лужна Л.І. Показники оксидативного стресу. Пероксиди ліпідів // Укр. біохім. журн. — 2006. — Т. 78, № 5. — С. 113-119.
14. Меньщикова Е.В., Зенков И.П. Антиоксиданты и ингибиторы радикальных окислительных процессов // Успехи современной биологии. — 1993. — Т. 113, вып. 4. — С. 442-455.
15. Мирошниченко О.С. Биогенез, физиологическая роль и свойства каталазы // Биомембраны и клетка. — 1989. — № 7. — С. 32-41.
16. Петухова О.В., Устьянцева И.М., Агаджанян В.В. Содержание липопротеидов и продуктов перекисного окисления липидов у больных в остром периоде политравмы // Политравма. — 2006. — № 3. — С. 65-68.
17. Міщенко І.В. Реакції перекисного окислення ліпідів і гемостазу у різних тканинах при гострому емоційно-больовому стресі // Фізіол. журн. — 2002. — Т. 48, № 6. — С. 66-69.
18. Поберезкина Н.Б., Осинская Л.Ф. Биологическая роль супероксиддисмутазы // Украинский биохим. журнал. — 1989. — Т. 61, № 2. — C. 14-23.
19. Тимочко М.Ф., Єлісєєва О.П., Кобилянська Л.І., Тимочко І.Ф. Метаболічні аспекти формування кисневого гомеостазу в екстремальних станах. — Львів, 1998. — 142 с.
20. Яковлев М.Ю., Зубаирова Л.Д., Крупник А.Н., Пермяков Н.К. Альвеолярные макрофаги в физиологии и патологии легких // Архив патологии. — 1991. — № 4. — С. 3-7.
21. Bedard K., Krause K. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology // Physiol. Rev. — 2007. — 87(1). — Р. 245-313. doi: 10.1152/physrev.00044.2005
22. Clark J.A., Coopersmith C.M. Intestinal crosstalk: a new paradigm for understanding the gut as the “motor” of critical illness // Shock. — 2007. — Vol. 28. — P. 384-393. doi: 10.1097/shk.0b013e31805569df
23. Esterbauer H., Gebicki J., Puhl H., Jurgens G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL // Free Radic. Biol. Med. — 1992. — Vol. 13. — P. 341-390. PMID: 1398217
24. Gueraud F., Atalay M., Bresgen N., Cipak A., Eckl P.M., Huc L., Jouanin I., Siems W., Uchida K. Chemistry and biochemistry of lipid peroxidation products // Free Radic. Res. — 2010. — Vol. 44, 10. — P. 1098-1124. doi: 10.3109/10715762.2010.498477
25. Lamb N.J., Gutteridge J.M.C., Baker C. et al. Oxidative damage to proteins of bronchoalveolar lavage fluid in patients with acute respiratory distress syndrome: evidence for neutrophil-mediated hydroxylation, nitration and chlorination // Intens Care Med. — 1999. — Vol. 2. — P. 1738-1744.
26. Richter C. Biophysical consequences of lipid peroxidation in membranes // Chemistry and physics of lipids. — 1987. — Т. 44, № 2. — P. 175-189.
27. Tscherne H., Regel G. Surgical procedures in the stabilized patient. The Integrated Approach to Trauma Care: The First 24 Hours // Eds. RJ.A. Goris, O. Trents. — Berlin, 1995. — P. 188-190.

/41/41_2.jpg)
/42/42_2.jpg)