Журнал «Медицина неотложных состояний» 4 (67) 2015
Вернуться к номеру
Нутритивная поддержка больных в отделении интенсивной терапии: старые правила и новые возможности
Авторы: Галушко О.А. — Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Проблема адекватного и полноценного клинического питания больных, находящихся на лечении в отделениях интенсивной терапии, остается в центре внимания многих клиницистов. Проведение комплекса современного энтерального и парентерального питания позволяет предотвращать возникновение осложнений и побочных реакций у этих пациентов. Общее содержание калорий и пропорции между отдельными элементами питания имеют существенное значение для организации нутритивной поддержки и должны соответствовать рекомендациям Европейской и Американской ассоциаций парентерального и энтерального питания (ESPEN, ASPEN). Интересной и перспективной комбинацией является возможность сочетанного применения смеси аминокислот (Аминол) и препаратов с альтернативными источниками энергии (Глюксил). Нужны дополнительные экспериментальные и клинические исследования комбинации этих веществ для того, чтобы окончательно выяснить роль и место этих препаратов в программах парентерального питания пациентов отделений интенсивной терапии.
Проблема адекватного та повноцінного клінічного харчування хворих, які знаходяться на лікуванні у відділеннях інтенсивної терапії, залишається в центрі уваги багатьох клініцистів. Проведення комплексу сучасного ентерального та парентерального харчування дозволяє запобігати виникненню ускладнень і побічних реакцій у цих пацієнтів. Загальний вміст калорій і пропорції між окремими елементами харчування мають суттєве значення для організації нутритивної підтримки і повинні відповідати рекомендаціям Європейської і Американської асоціацій парентерального та ентерального харчування (ESPEN, ASPEN). Цікавою і перспективною комбінацією є можливість поєднаного застосування суміші амінокислот (Амінол) та препаратів з альтернативними джерелами енергії (Глюксил). Потрібні додаткові експериментальні та клінічні дослідження комбінації цих речовин для того, щоб остаточно з’ясувати роль і місце зазначених препаратів в програмах парентерального харчування пацієнтів відділень інтенсивної терапії.
The problem of adequate and complete clinical nutrition of patients of the intensive care units remains in the focus of many clinicians. A complex of modern enteral and parenteral nutrition enables to prevent the occurrence of complications and adverse reactions in these patients. Total calories and proportions between different food elements are essential to the organizing nutritional support and must meet the recommendations of the European and American Society for Parenteral and Enteral Nutrition (ESPEN, ASPEN). An interesting and promising combination is the possibility of combined use of a mixture of amino acids (Aminol) and preparations with alternative energy sources (Gluxyl). We need more experimental and clinical studies of the combination of these substances in order to finally clarify the role and place of these drugs in the programs of parenteral nutrition of patients in intensive care units.
клиническое питание, энтеральное питание, парентеральное питание, Аминол, Глюксил.
клінічне харчування, ентеральне харчування, парентеральне харчування, Амінол, Глюксил.
clinical nutrition, enteral nutrition, parenteral nutrition, Aminol, Gluxyl.
Статья опубликована на с. 58-62
Установлено, что более 50 % пациентов, находящихся в отделениях интенсивной терапии, имеют признаки белково-энергетической недостаточности. Совершенствование технологий интенсивной терапии больных в критических состояниях различной этиологии сопровождалось увеличением случаев полиорганной недостаточности, быстрым снижением массы тела таких пациентов, значительными потерями белка, развитием «госпитального истощения», которое влияло на увеличение летальности и количества осложнений. Нутритивный дефицит приводит к серьезным нарушениям метаболизма и иммунного статуса, которые в значительной степени снижают эффективность лечения пациентов в критических состояниях, увеличивает продолжительность их госпитализации в отделении интенсивной терапии (ОИТ) и связанные с этим расходы на лечение. Оказалось, что нутритивная поддержка (НП), методами которой являются энтеральное и парентеральное питание, должна занять свое место наряду с респираторной, инфузионной и инотропной поддержкой, рациональной антибактериальной терапией в комплексе ИТ больных в критическом состоянии [1]. Американское общество парентерального и энтерального питания (American Society for Parenteral and Enteral Nutrition — ASPEN) рекомендует начинать НП как можно раньше (в первые 24–48 часов) после стабилизации состояния больного [12]. Для получения желаемого эффекта от НП необходимо правильно подобрать дозу вводимых препаратов и определиться с их составом. Для расчета суточной дозы используют:
— уравнение Харриса — Бенедикта;
— определение азотистого баланса для оценки направленности обмена белков, позволяющее вовремя диагностировать катаболическую фазу болезни:
Азотистый баланс (г/сут) = Nпоступ – Nпотери = [(пищевой белок х 0,16) — (азот мочевины в моче) + 4 г].
Положительный баланс свидетельствует об анаболическом статусе, отрицательный — о катаболическом;
— динамическое мониторирование метаболизма аппаратными методами (например, аппаратом «Датекс Омеда»);
— метод непрямой калориметрии.
Согласно международным рекомендациям, энтеральное питание является приоритетным методом нутритивной поддержки с достаточным уровнем безопасности (категория рекомендаций А).
Энтеральное питание у пациентов ОИТ
Энтеральное питание (ЭП, от греч. entericos — «кишечный, тонкокишечный» — тот, который размещен в пределах тонкой кишки или касается ее) — это способ нутритивной поддержки, при котором питательные ингредиенты доставляют в кишечник через зонд в случае невозможности адекватного перорального питания [1]. Его положительные качества (физиологичность, низкий уровень осложнений, относительная простота доставки нутриентов и относительно низкая стоимость) были известны ранее. Сегодня ЭП начинает занимать позицию важного компонента в оказании помощи пациентам в критических состояниях. Оказалось, что кишечник играет центральную роль в генезе метаболических сдвигов при критических состояниях. Помимо обеспечения организма необходимыми питательными веществами, кишечник выполняет иммунную, эндокринную и барьерную функции. Для сохранения целостности слизистой оболочки самого кишечника наряду с многочисленными эндогенными факторами необходимо наличие в просвете питательных ингредиентов. Слизистая оболочка кишечника постоянно обновляется, имеет высокую степень метаболической активности и, таким образом, является более уязвимой для ишемии и гипоксии. Кроме того, если отсутствует адекватное поступление питательных веществ в эпителиоциты, снижается их способность к регенерации и утрачивется барьерная функция кишечника, прежде всего защита от огромного количества микроорганизмов, которые там «живут и работают».
Приведенные патофизиологические данные могут быть основой для применения энтерального питания как компонента интенсивной терапии с целью уменьшения рисков полиорганной недостаточности и сепсиса. Вместе с тем, чтобы стать приоритетным способом нутритивной поддержки, энтеральное питание должно отвечать трем следующим требованиям:
— быть безопасным, то есть его использование не должно приводить к серьезным побочным эффектам и осложнениям;
— полностью удовлетворять потребности организма в макро- и микронутриентах;
— предусматривать модификацию компонентов в составе пищевых диет в зависимости от клинического состояния пациентов.
Общее содержание калорий и пропорции между отдельными элементами питания имеют существенное значение для организации нутритивной поддержки и должны соответствовать рекомендациям Европейской и Американской ассоциаций парентерального и энтерального питания (ESPEN, ASPEN):
— ежедневная энергетическая ценность — 25–30 ккал на 1 кг актуальной массы тела;
— содержание белков из расчета 1,3–2 г/кг ежедневно;
— углеводы должны составлять 50–70 % небелковых калорий для поддержания уровня глюкозы в сыворотке крови в пределах 4,4–6,1 ммоль/л;
— содержание липидов составляет 15–30 % общих небелковых калорий.
Для усвоения основных энергосубстратов необходимо применение микронутриентов (железо, фолиевая кислота, витамины групп В, С, D, микроэлементы).
Кроме того, известно, что у пациентов, находящихся в ОИТ, энтеральный способ питания позволяет лучше контролировать уровень сахара в крови и предотвращает возникновение осложнений, вызванных гипергликемией, у критических пациентов с сахарным диабетом или у больных со стрессовым повышением сахара в крови [2].
Следует отметить, что многочисленные исследования продемонстрировали опасность стрессовой гипергликемии и ухудшение последствий критических состояний при уровнях гликемии более 6,1 ммоль/л. Для поддержания уровня гликемии необходимы дополнительные лечебные мероприятия:
1. Уровень гликемии более 15 ммоль/л без одновременной конкурентной гипертриглицеридемии является показанием для использования в качестве донаторов энергии при полном парентеральном питании преимущественно жировых эмульсий.
2. Использование концентрированных растворов глюкозы для парентерального питания возможно только при снижении уровня гликемии менее 15 ммоль/л.
3. Для коррекции гипергликемии необходимо использовать только внутривенный способ введения инсулина (через инфузомат или дозатор) [3].
Противопоказания к проведению энтерального питания:
— паралитическая и механическая непроходимость кишечника;
— неконтролируемая диарея (> 500 мл в сутки или в количестве, превышающем объем жидкости в виде питания);
— неконтролируемая рвота;
— свищи желудочно-кишечного тракта с большим объемом потерь;
— продолжающееся желудочно-кишечное кровотечение;
— шок, нестабильность гемодинамики.
Целесообразно рассмотреть возможность применения гастрального зондового питания у всех пациентов при отсутствии противопоказаний.
Противопоказания к гастральному зондовому питанию:
— непреодолимая тошнота/рвота;
— выраженный рефлюкс (гастрально-пищеводный);
— гастропарез;
— хирургическое вмешательство на пищеводе или кардиальном отделе желудка.
При неудовлетворительной толерантности к гастральному питанию рекомендуют применять промоторные агенты. Препаратом первого выбора является метоклопрамид. Он действует как антагонист допамин-2-рецепторов, увеличивая холинергическую сократительную активность выхода из желудка, двенадцатиперстной и тощей кишки. К препаратам второго ряда относят эритромицин, который увеличивает высвобождение мотилина энтерохромаффинными клетками двенадцатиперстной кишки и повышает сократительную способность двенадцатиперстной кишки. Разовая доза эритромицина составляет 100–200 мг внутривенно.
Парентеральное питание у пациентов ОИТ
Парентеральное питание (ПП) (греч. рara — «мимо», enteron — «кишка») — способ искусственного питания, при котором пищевые вещества доставляются в организм не через ЖКТ, а внутривенно.
Показания к проведению парентерального питания:
— предоперационная подготовка больных для улучшения результатов хирургического вмешательства;
— невозможность введения зонда для ЭП;
— нефункционирующий ЖКТ (непреодолимая рвота, профузная диарея);
— выраженная белковая или белково-энергетическая недостаточность у пациента;
— необходимость временного исключения ЖКТ;
— невозможность адекватного обеспечения питанием через зонд;
— химио- и лучевая терапия по поводу онкологических заболеваний;
— печеночная или почечная недостаточность;
— послеоперационный период, когда невозможно питание через ЖКТ;
— выраженный катаболизм, когда только ЭП не позволяет справиться с потерями и дефицитом протеинов.
Противопоказания:
— рефрактерный шок;
— выраженная сердечная декомпенсация (угроза отека легких);
— неконтролируемая артериальная гипертензия (гипертонический криз);
— значительная дегидратация или гипергидратация;
— значительные нарушения кислотно-щелочного баланса, ионного баланса и осмолярности крови;
— декомпенсация сахарного диабета;
— анафилаксия на составляющие компоненты питательных смесей;
— жировая эмболия;
— непереносимость отдельных составляющих питания.
Хотим обратить внимание на то, что выделенные нами курсивом противопоказания к ПП, которые касаются в основном больных сахарным диабетом, можно считать относительными и временными. И дегидратация, и нарушение кислотно-щелочного баланса, ионного баланса и осмолярности крови — это проявления декомпенсации сахарного диабета. На фоне проведения интенсивной терапии происходит нормализация этих параметров, а следовательно, уменьшается количество противопоказаний к проведению парентерального питания [16].
Если ЭП противопоказано или его цель не достигается и сохраняется необходимость нутритивной поддержки, целевая группа ASPEN рекомендует применение ПП. Если показано ПП, целевая группа рекомендует проводить доставку нутриентов с использованием однопросветного центрального катетера, введенного через периферическую вену. Центральный венозный доступ, как правило, необходим для назначения высокоосмолярных смесей ПП для полного обеспечения питательных потребностей (рекомендация C). Периферический катетер для венозного доступа может использоваться для ввода низкоосмолярных смесей (< 850 мОсм/л), предназначенных для частичного удовлетворения питательных потребностей и уменьшения негативного энергобаланса (рекомендация C).
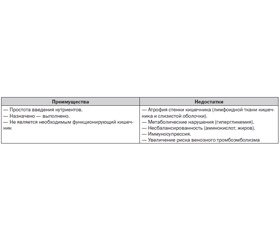
ПП может быть дополнительным, когда применяется в сочетании с зондовым или пероральным питанием, и полным, когда все нутриенты вводятся только внутривенно. Преимущества и недостатки ПП при критических состояниях приведены в табл. 1.
Основные принципы назначения парентерального питания
В состав препаратов, используемых для парентерального питания, входят те же пищевые вещества, что и при обычном ЭП. Однако следует учитывать, что питательные вещества проходят естественные пути расщепления сложных веществ до необходимых ингредиентов, они вводятся уже в виде аминокислот, расщепленных жиров и углеводов [12].
Полное ПП должно быть полноценным: все необходимые нутриенты (аминокислоты, углеводы, жиры, вода, электролиты, витамины и микроэлементы) должны быть представлены в необходимом количестве. Однако ПП дает уникальную возможность приспосабливать прием нутриентов к потребностям пациентов путем адаптации состава питательной смеси в зависимости:
— от метаболических нарушений, обусловленных болезнью и/или органной дисфункцией;
— сосуществующих дефицитов или перегрузок;
— показаний для обеспечения субстратами, которые могут влиять на последствия болезни благодаря своим фармакологическим свойствам (например, глутамин, омега-3 жирные кислоты, антиоксиданты, разветвленные аминокислоты).
Для точного планирования состава парентеральной смеси чрезвычайно важно:
— определение метаболического статуса пациента и влияния болезни на метаболизм;
— расчет потребностей пациента;
— определение цели лечения.
Различают несколько режимов парентерального питания:
— круглосуточное введение нутриентов (оптимально для больных в стационаре; лучшая толерантность и утилизация субстратов);
— удлиненная инфузия в течение 18–20 часов (хорошая толерантность; в интервалах следует внутривенно вводить 5% глюкозу);
— циклический режим — инфузия в течение 8–12 часов (удобно при домашнем парентеральном питании).
Все нутриенты разделяют на донаторы энергетического материала (углеводы, липиды) и донаторы пластического материала (аминокислоты и белки). Классическое правило парентерального питания гласит, что только сочетанное применение донаторов энергетического и пластического материала позволяет достичь синтеза белка как окончательного результата нутритивной поддержки [13].
Минимальное количество углеводов при ПП должно составлять около 2 г/кг глюкозы ежедневно. Гипергликемия (глюкоза > 10 ммоль/л) ассоциируется с повышением летальности у больных в критических состояниях и увеличением частоты инфекционных осложнений.
Как снижение, так и повышение летальности у пациентов ОИТ наблюдалось при поддержании концентрации глюкозы в крови 4,5–6,1 ммоль/л. В настоящее время однозначных рекомендаций по этому вопросу нет. Выяснилось, что количество случаев тяжелой гипогликемии (< 2,2 ммоль/л) увеличивалось у пациентов со строгим контролем гликемии. На сегодняшний день проведено несколько мультицентровых исследований (например, NICESUGAR), которые показали, что строгий контроль нормогликемии приводит к тяжелым осложнениям, связанным с гипогликемией, без улучшения выживаемости пациентов [8–11].
Жировые эмульсии должны быть составной частью ПП для обеспечения энергии и введения эссенциальных жирных кислот у пациентов, длительно находящихся в ОИТ. Жировые эмульсии для инфузий (LCT, МСТ или смешанные) могут применяться (назначаться) в количестве от 0,7 до 1,5 г/кг массы тела, начиная с 12–24 часов.
Если ПП показано, сбалансированные аминокислотные смеси должны вводиться в количестве 1,3–1,5 г/кг идеальной массы тела ежедневно, одновременно с адекватным потреблением энергосубстратов. Эти аминокислотные растворы должны содержать 0,2–0,4 г/кг/сут L-глутамина (примерно 0,3–0,6 г/кг/сут аланин-глутамина дипептида). Введенный парентерально глутамин улучшает гликемический контроль [4] через несколько потенциальных механизмов: а) через метаболизм глутамина к глюкозе в глюкозо-глутаминовом цикле; б) увеличение секреции инсулина; в) повышение чувствительности к инсулину в поперечно-полосатой мышечной ткани; г) увеличение окисления свободных жирных кислот; д) снижение ответа воспалительной реакции. Было доказано, что глутамин улучшает чувствительность к инсулину у тяжелобольных пациентов [5]. 2 многоцентровых клинических испытания показали, что у больных, получавших сбалансированное полное парентеральное питание, которое включало глутамин, наблюдалось снижение частоты инфекционных осложнений и улучшение метаболических показателей [6, 7].
В последнее время многие исследователи [13–15] отмечают новые возможности проведения ПП в результате появления новых инфузионных средств. В частности, речь идет о возможности сочетанного применения смеси аминокислот и препаратов с альтернативными источниками энергии. Интересной и перспективной комбинацией является введение отечественных растворов Аминол и Глюксил.
Аминол® как сбалансированная смесь 13 аминокислот (1 мл раствора содержит: аланина — 6,4 мг, аргинина гидрохлорида — 6,4 мг, валина — 4,9 мг, гистидина гидрохлорида моногидрат — 3,2 мг, глицина — 8,0 мг; изолейцина — 4,4 мг, лейцина — 9,8 мг, лизина гидрохлорида — 11,5 мг, метионина — 5,7 мг, пролина — 6,4 мг, треонина — 4,3 мг, триптофана — 1,44 мг, фенилаланина — 7,0 мг), 8 из которых являются незаменимыми, при медленном введении легко усваивается организмом. При условии обеспечения энергетических потребностей аминокислоты включаются в биосинтез белков, способствуют положительному азотистому балансу и устраняют белковый дефицит (донатор пластического материала).
Основными действующими веществами препарата Глюксил являются глюкоза и ксилит. О роли глюкозы в программах ПП уже говорилось выше. Но во многих клинических ситуациях при лечении пациентов отделений интенсивной терапии следует избегать избыточного введения глюкозы и выраженной гипергликемии. Поэтому интересно присмотреться к другим — альтернативным — источникам энергии. Одним из них может быть ксилит — пятиатомный спирт, который при введении быстро включается в пентозофосфатный цикл метаболизма. В отличие от фруктозы и сорбита ксилит не вызывает снижения в печени адениннуклеотидов (АТФ, АДФ, АМФ), безопасен при введении больным, имеющим чувствительность к фруктозе или дефицит фермента фруктозо-1,6-дифосфатазы. Считается, что ксилит имеет большее антикетогенное, азотосберегающее действие, чем глюкоза, и одинаково хорошо усваивается как в предоперационном, так и в послеоперационном периоде. Учитывая, что ксилит является источником энергии с независимым от инсулина метаболизмом, действует антикетогенно и липотропно, он может использоваться в комплексе парентерального питания больных. Однако нужны еще дополнительные экспериментальные и клинические исследования комбинации этих веществ для того, чтобы окончательно определить роль и место этих препаратов в лечении и программах парентерального питания пациентов отделений интенсивной терапии.
Выводы
1. Проблема адекватного и полноценного клинического питания больных, находящихся на лечении в отделениях интенсивной терапии, остается в центре внимания многих клиницистов. Проведение комплекса современного энтерального и парентерального питания позволяет предотвращать возникновение осложнений и побочных реакций у пациентов отделений интенсивной терапии.
2. Общее содержание калорий и пропорции между отдельными элементами питания имеют существенное значение для организации нутритивной поддержки и должны соответствовать рекомендациям Европейской и Американской ассоциаций парентерального и энтерального питания (ESPEN, ASPEN).
3. Интересной и перспективной комбинацией является сочетанное применение смеси аминокислот (Аминол) и препаратов с альтернативными источниками энергии (Глюксил).
4. Нужны дополнительные экспериментальные и клинические исследования комбинации этих веществ для того, чтобы окончательно выяснить роль и место этих препаратов в лечении и программах парентерального питания пациентов отделений интенсивной терапии.
1. Попова Т.С., Шестопалов А.Е., Тамазешвили Т.Ш., Лейдерман И.Н. Нутритивная поддержка больных в критических состояниях. — М.: Издат. дом «М-Вест», 2002. — 320 с.
2. Franz M.J., Warshaw H., Daly A.E., Green-Pastors J., Arnold M.S., Bantle J. Evolution of diabetes medical nutrition therapy // Postgrad. Med. — 2003. — 79. — 30–35.
3. Lopez Martinez J., Sanchez Castilla M., De Juana Velasco P., Diaz Abad R., Rodriguez Roldan J.M., Garcia de Lorenzo y Mateos A. et al. Non-glucose carbohydrates in the parenteral nutrition of patients with systemic inflammatory response syndrome // Nutr. Hosp. — 1999. — 14. — 71–80.
4. Valero M.A., Leon–Sanz M., Escobar I., Gomis P., De la Camara A., Moreno J.M. Evaluation of nonglucose carbohydrates in parenteral nutrition for diabetic patients // Eur. J. Clin. Nutr. — 2001. — 55. — 1111–6.
5. Hebert S.L., Nair K.S. Protein and energy metabolism in type 1 diabetes // Clin. Nutr. — 2010. — 29. — 13–7.
6. Borel M.J., Williams P.E., Jabbour K., Levenhagen D., Kaizer E., Flakoll P.J. Parenteral glutamine infusion alters insulin-mediated glucose metabolism // J. Parenter. Enteral. Nutr. — 1998. — 22. — 280–5.
7. Alish C.J., Garvey W.T., Maki K.C., Sacks G.S., Hustead D.S., Hegazi R.A. et al. A diabetes-specific enteral formula improves glycemic variability in patients with type 2 diabetes // Diabetes Technol. Ther. — 2010. — 12. — 419–25.
8. Finfer S., Chittock D.R., Su S.Y., Blair D., Foster D., Dhingra V. et al; NICE-SUGAR Study Investigators. Intensive versus conventional glucose control in critically ill patients // N. Engl. J. Med. — 2009. — 360. — 1283–97.
9. Griesdale D.E., De Souza R., Van Dam R., Heyland D.K., Cook D.J., Malhotra A. et al. Intensive insuline therapy and mortality among critically ill patients. A meta–analysis including NICE-SUGAR study data // CMAJ. — 2009. — 180. — 821–7.
10. Marik P.E., Preiser J.C. Toward understanding tight glycemic control in the ICU: a systematic review and metaanalysis // Chest. — 2010. — 137. — 544–51.
11. Бойко В.В., Козлова Т.В., Хижняк А.А., Мушенко В.Е. Инфузионная терапия и парентеральное питание в хирургии. — Харьков: СИМ, 2011. — 148 с.
12. Интенсивная терапия: национальное руководство: в 2 т. / Под ред. Б.Р. Гельфанда, А.И. Салтанова. — М.: ГЭОТАР-Медиа, 2011. — Т. 1. — 960 с.
13. Черний В.И., Колесников А.Н., Олейников К.Н., Егоров А.А., Билошапка В.И. Рациональная инфузионная терапия. — К.: Логос, 2012. — 128 с.
14. Заруцький Я.Л., Шматенко О.П., Соломенний А.М., Савицький О.Ф., Форостяний П.П. Інфузійні лікарські засоби в лікуванні політравми // Укр. хіміотерапевтичний журнал. — 2012. — 3 (27). — С. 31–36.
15. Гуменюк Н.И., Киркилевский С.И. Инфузионная терапия: теория и практика. — К.: Книга-плюс, 2004. — 208 с.
16. Шлапак І.П., Галушко О.А. Цукровий діабет: погляд з позиції лікаря-анестезіолога. — К.: Книга-плюс, 2010. — 160 с.

/60/60.jpg)