Статья опубликована на с. 104-108
Залежно від стану мікрофлори вагітної жінки (нормоценоз або стан дисбіозу) та функціонального стану фетоплацентарної системи відбувається формування мікрофлори новонародженого (колонізація представниками нормальної мікрофлори або умовно-патогенними мікроорганізмами) і становлення його імунної системи. Вивчення цього питання тільки починається, однак наявні відомості вже дозволяють вважати найважливішою задачею нормалізацію мікрофлори у вагітних жінок для профілактики анте- та постнатальних інфекцій.
У структурі материнської смертності частка інфекційної патології становить 13–15 %. Інфекційні захворювання посідають одне з перших місць у структурі перинатальної смертності, обумовлюючи за останні роки від 11 до 45 % втрат плода. Мертвонародження внаслідок такої патології сягає 14,9–16,8 ‰. За результатами ряду дослідників, лише в 35–40 % вагітних був констатований нормоценоз піхви.
Метою даного дослідження було вивчення системи «плацента — плід — новонароджений» у вагітних з порушенням мікробіоценозу пологових шляхів.
Методи дослідження
Під спостереженням перебували 184 вагітних з перинатальними втратами віком 19–34 роки. Контрольну групу становили 30 умовно здорових вагітних, основну — 110 вагітних, обстежених і пролікованих за розробленою схемою, 74 — за загальноприйнятою. З них І групу становили 35 вагітних пацієнток, які отримали лікування з приводу перинатальних втрат на етапі планування сім’ї; ІІ — пацієнтки, які отримували лікування з перших днів вагітності (45 осіб), ІІІ — вагітні, які лікувалися в другому-третьому триместрі (30 жінок).
Антенатальне дослідження стану плода й фетоплацентарного комплексу (ФПК) проводилось за допомогою комп’ютерної томографії (КТГ), ультразвукового дослідження (УЗД), визначався біофізичний профіль плода методом Vintzilcos. З метою динамічної оцінки стану ФПК було проведено дослідження плаценти в післяпологовому періоді.
Статистична обробка даних проведена на персональному комп’ютері методами варіаційної статистики й рангової кореляції з використанням стандартного пакета прикладних програм для Windows XP. Вірогідна різниця параметричних показників оцінювалася за допомогою t-критерію Стьюдента, значимість різниці часток оцінювалась методом кутового перетворення Фішера.
Результати та їх обговорення
У III підгрупі в терміні 10–15 тижнів загострення інфекційного процесу — ангіну було відзначено в 10 (33,33 %) пацієнток, пієлонефрит — у 8 (26,67 %), кольпіт — у 14 (46,67 %), бактеріальний вагіноз — у 12 (40,00 %).
У групі порівняння загострення інфекційного процесу — ангіну було відзначено у 23 (31,08 %), пієлонефрит — у 20 (27,03 %), гостре респіраторне вірусне захворювання зустрічалося у 18 (24,32 %) пацієнток у терміні 9–17 тижнів, кольпіт у терміні 20–21 тиждень — у 20 (27,03 %), бактеріальний вагіноз у терміні 23–27 тижнів — у 18 (24,32 %).
У жінок I і II підгруп і в контрольній групі не було відмічено жодного випадку загострення інфекційного процесу.
Передчасне дозрівання плаценти виявлялося в різні терміни гестації з 22 до 38 тижнів: у I підгрупі — у 5 (14,29 %), що було вірогідно нижче від показників у II і в III підгрупах — 13 (28,89 %) і 10 (33,33 %) жінок відповідно (р < 0,05), а в групі порівняння — 20 (32,43 %) пацієнток (р < 0,05) (рис. 1).
Під час УЗД у жінок основної й групи порівняння були виявлені кальцифікати в плаценті: у I підгрупі — 3 (8,57 %) випадки, у II — 8 (17,78 %), що було вірогідно нижче від показників III групи — 26 (86,67 %) випадків і групи порівняння — 18 (24,32 %) (р < 0,05).
Антенатальне обстеження стану плода та фетоплацентарного комплексу за допомогою вивчення КТГ, УЗД та біофізичного профілю плода виявило, що хронічна внутрішньоутробна гіпоксія плода зі зниженням адаптаційно-пристосувальних можливостей фетоплацентарного комплексу зареєстрована у 2 (6,67 %) здорових жінок, 3 (8,57 %) і 2 (4,44 %) пацієнток I і II підгруп, що було вірогідно менше, ніж в III підгрупі і у групі порівняння (8 випадків — 26,67 %, р < 0,05, та 12 випадків — 16,2 %, р < 0,05, відповідно).
Оцінка біофізичного профілю плода, проведена за методом Vintzilcos, показала, що нормальний стан плодів, тобто 10–12 балів, зареєстровано у 17 (48,57 %) пацієнток I підгрупи, у 21 (46,67 %, р > 0,05) — II групи і в 9 (30,00 %) — III (р < 0,05). Задовільний стан плодів, якому відповідали 8–9 балів, було відзначено у 10 (28,57 %) пацієнток в I підгрупі, у 12 (26,67 %, р>0,05) — в II і в 10 (33,33 %) — у III підгрупі. Сумнівний стан плода, тобто 6–7 балів, спостерігався в кожної п’ятої жінки з І і ІІ підгруп (8 (22,86 %) і 12 (26,67 %) випадків відповідно, р > 0,05) і у кожної третьої — з ІІІ підгрупи (9 (30,00 %) випадків, р < 0,05). У 2 (6,67 %) пацієнток з III підгрупи було відзначено патологічний стан плода. У групі порівняння в 37 (50,00 %) випадках стан плодів був нормальним, у 10 (13,51 %) — задовільним, у 27 (36,49 %) — сумнівним. У контрольній групі було 17 (56,67 %), 12 (40,00 %) і 1 (3,33 %) випадок відповідно (рис. 1).
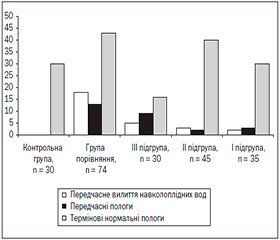
У переважної більшості жінок I і ІІ підгруп (30 (85,71 %) і 40 (88,89 %) випадків відповідно, р > 0,05), а також у всіх пацієнток контрольної групи були термінові нормальні пологи (р < 0,05), тоді як у III — лише в 16 (53,33 %, р < 0,05) пацієнток, в групі порівняння — у 43 (58,11 %, р < 0,05). У жінок всіх порівнюваних груп трапилося передчасне вилиття навколоплідних вод, а саме: у 2 (5,71 %) породіль у I підгрупі, у 3 (6,67 %) — в II, у 5 (16,67 %) — в III і у 18 (24,32 %) — у групі порівняння. Слід відмітити, що показники в ІІІ підгрупі і групі порівняння вірогідно відрізнялися від таких у І та ІІ підгрупах (р < 0,05). У 3 (8,57 %) випадках у І підгрупі, 2 (4,44 %) — у ІІ, 9 (30,00 %) — у III та 13 (17,57 %) — у групі порівняння в жінок трапилися передчасні пологи (р < 0,05) (рис. 2).
Усі діти матерів контрольної групи народжені від доношеної вагітності, у тому числі 10 (33,33 %) народилися з масою до 2800,00 г, 20 (66,67 %) — з масою від 2800,00 до 3210,00 г. Що стосується новонароджених з масою до 2800,00 г від жінок трьох підгруп основної групи та групи порівняння, то таких випадків було відповідно 12 (34,29 %), 14 (31,11 %), 12 (40,00 %) і 18 (24,32 %).
Гіпотрофія плода мала місце в усіх групах, крім контрольної: у I підгрупі — в 7 (20,00 %), в II — в 11 (24,44 %), в III — у 12 (40,00 %) випадках, у групі порівняння — у 33 (44,59 %). Отже, показники в ІІІ підгрупі та в групі порівняння вірогідно перевищували такі в І і ІІ підгрупах майже у 2 рази (р < 0,05).
Під час пологів у 5 (14,29 %) роділь I підгрупи, у 12 (26,67 %) — II підгрупи, у 12 (40,00 %) — III, у 20 (27,03 %) — групи порівняння спостерігалася асфіксія різного ступеня тяжкості, а в контрольній групі було 2 (6,67 %) таких випадки (р < 0,05).
Отже, незважаючи на те, що симптоми дизадаптації були виявлені в новонароджених всіх обстежених груп, вірогідно частіше вони спостерігалися в групі порівняння і в III підгрупі (р < 0,05). При цьому ступінь вираженості вищеозначеного синдрому був різним: так, у підгрупах I і II переважали легкі форми, а в IІI підгрупі і в групі порівняння мали місце більш виражені порушення. Більшість ознак дизадаптації, серед яких патологічна втрата маси тіла, пізнє її відновлення, відпадання пуповинного залишку після 7 дня, також частіше спостерігалися в III підгрупі і в групі порівняння.
З метою динамічної оцінки стану фетоплацентарного комплексу було проведено дослідження плацент у післяпологовому періоді (рис. 3).
Під час даного етапу дослідження було встановлено, що неправильну форму мали плаценти у 2 (5,71 %) жінок у I підгрупі, 3 (6,67 %) — II, 4 (13,33 %) — в III, в групі порівняння — у 8 (10,81 %) породіль, а в контрольній групі — у 1 (3,33 %). Слід зазначити, що показники в III підгрупі і в групі порівняння вірогідно відрізнялися від показника в I підгрупі і контрольній групі (р < 0,05). Причиною даної патології була наявність додаткових часточок, товщина, розташування й розміри яких відзначалися значною різноманітністю, що й визначало нерівний, горбистий вид плаценти, а також безліч нерівностей у пресових відділах.
Білі інфаркти різних розмірів, щільної консистенції, вогнища кальцифікації на материнській поверхні визначалися в I підгрупі в 5 (14,29 %) випадках, у II — також в 5 (11,11 %), у III — в 4 (13,33 %) випадках, у групі порівняння таких випадків було 18 (24,32 %). Розбіжності між показниками в I, II і III (р > 0,05) підгрупах не були вірогідно значущими, чого не можна стверджувати при співставленні їх з групою порівняння (р < 0,05). В 1 (2,86 %) породіллі I підгрупи, у 2 (4,44 %) — II і в 3 (10,00 %) — III на розрізі тканини плаценти характеризувалися строкатістю в результаті нерівномірного кровонаповнення, наявністю вогнищ ішемічних інфарктів, що було значно нижче від показника у групі порівняння (15 (20,27 %), р < 0,05). У контрольній групі такий випадок був лише 1 (3,33 %), і відповідні показники в І і ІІ підгрупах майже не відрізнялися за частотою (р > 0,05).
Гістологічне дослідження виявило запальну інфільтрацію амніону нейтрофільними лейкоцитами з домішкою лімфоцитів макрофагів, а також посилення проліферації епітеліальних клітин. Просвіти судин хоральної пластинки були розширені та характеризувалися повнокров’ям, а лімфоцитарні інфільтрати виділялися у базальній пластинці. У I підгрупі і в контрольній групі подібні зміни не зустрічалися, чого не можна сказати про спостереження у II і III підгрупах і в групі порівняння, де таких випадків було відповідно 3 (6,67 %, р < 0,05), 5 (16,67 %, р < 0,05) і 16 (21,62 %, р < 0,05), а показники в III підгрупі й групі порівняння вірогідно не відрізнялися (р > 0,05).
Дистрофічні зміни у вигляді вакуолізації виявлялися в окремих децидуальних клітинах, а явища хронічного продуктивного запалення в стінках судин великих і дрібних ворсин із звуженням і облітерацією просвіту судин спостерігалися лише в III підгрупі та в групі порівняння — відповідно в 4 (13,33 %) і 9 (12,16 %) випадках (р > 0,05).
Отже, у разі фетоплацентарної недостатності морфологічні особливості посліду характеризувалися патологічною незрілістю у вигляді –дисоційованого розвитку ворсинчастого хоріона, запальними змінами, інволютивно-дистрофічними процесами і циркуляторними розладами. На ступінь вираженості патологічних змін посліду впливала як тривалість інфекційного процесу, так і своєчасність лікувально-профілактичних заходів.
У I підгрупі при проведенні комплексу заходів як на етапі планування, так і в процесі лікування патологічні зміни займали не більше 9 % площі плаценти й були повністю компенсовані добре розвиненими пристосувальними процесами, а запальний інфільтрат мав вогнищевий характер: у II підгрупі у 4 (8,89 %) осіб, у III — вдвічі частіше (5 (16,67 %, р < 0,05)), у групі порівняння — у 15 (20,27 %) жінок.
Маса тіла плода й маса плаценти були пов’язані прямою кореляційною залежністю (r = 0,65, р < 0,05), і навіть збільшення маси плаценти на 10 г супроводжувалося збільшенням маси плода на 80 г. Товщина плаценти не була постійною й збільшувалася або зменшувалася. Перше спостерігалося у разі загрози переривання вагітності, прееклампсії, друге — при цукровому діабеті, гемолітичної хворобі.
У контрольній групі середня маса плаценти становила 539,70 ± 40,00 г, у I — 529,30 ± 25,00 г, у II — 520,90 ± 20,00 г, у III — 519,70 ± 18,00 г, а в групі порівняння — 500,70 ± 12,00 г (р > 0,05). Визначення маси плода виявило аналогічну тенденцію, що проявилася в такій динаміці показника: у контрольній групі — 3357,00 ± 75,00 г, у I підгрупі — 3190,00 ± 67,00 г, у II — 3105,00 ± 60,00 г, у III — 3002,00 ± 51,00 г, у групі порівняння — 3200,00 ± 85,00 г. Показники в I підгрупі і групі порівняння не мали вірогідних відмінностей від показника в контрольній групі (р > 0,05).
Для визначення залежності маси новонародженого від обсягу плаценти оцінювався плацентарно-плодовий коефіцієнт (табл. 1).
Значення плацентарно-плодового коефіцієнта в порівнюваних групах не мало вірогідно значущих розбіжностей. Отже, окремий аналіз даного показника, без використання інших способів післяпологової діагностики, не дозволяє судити про наявність або відсутність внутрішньоутробного страждання плода й прогнозувати стан новонародженого в неонатальному періоді.
Незважаючи на виражене зменшення об’єму плаценти, що відзначалося при гіпотрофії плода III ступеня, зниження й значення плацентарно-плодового коефіцієнта не є суттєвим і не може вказувати на виражене страждання плода.
Що стосується морфологічного дослідження плацент, то воно не тільки підтверджувало діагноз плацентарної недостатності, а й надавало інформацію про стан процесів компенсації, а саме адекватність терапії під час вагітності.
Так, у групі порівняння морфологічна картина посліду характеризувалася наявністю глибоких і поширених інволютивно-дистрофічних і реологічних змін. Інфекційний компонент був представлений у вигляді трансмурального запалення плодових оболонок, дифузного або великовогнищевого інтервелузиту, базального децидуїту, ураження спіральних артерій і судин ворсин, що створювало сприятливі умови для реалізації внутрішньоутробного інфікування.
Висновки
У пацієнток I і II підгруп патологічні зміни плаценти займали близько 10 % її площі й були повністю компенсовані завдяки вираженим пристосувальним процесам і вогнищевому характеру запального інфільтрату. Так, у I підгрупі лікування протягом усього гестаційного періоду з попередньою підготовкою й пролонгацією вагітності чинило сприятливий вплив. Що стосується II підгрупи, то, на жаль, воно не дозволило уникнути розвитку субкомпенсованих форм плацентарної недостатності (до 11,11 %). У групі порівняння при неповноцінному курсі лікувально-профілактичних заходів спостерігалося 12,16 % випадків компенсованої і 16,22 % — субкомпенсованої форми плацентарної недостатності.

/105.jpg)
/106.jpg)
/107.jpg)