Статья опубликована на с. 69-73
В настоящее время болезни органов пищеварения по распространенности занимают третье место среди неинфекционных заболеваний. За последние десять лет в структуре гастроэнтерологической патологии преобладают поражения верхних отделов пищеварительного тракта: гастроэзофагеальная рефлюксная болезнь, функциональные расстройства желудка, хронический гастрит и дуоденит, язвенная болезнь (ЯБ). По данным ВОЗ, от ЯБ страдает 10–15 % населения развитых стран. Распространенность ЯБ в Украине, странах ближнего и дальнего зарубежья по-прежнему не имеет тенденции к снижению, а возникающие осложнения зачастую угрожают жизни больного и требуют хирургической коррекции [2, 4, 6, 15]. ЯБ, являясь хроническим рецидивирующим заболеванием с сезонными обострениями, не просто приносит страдание пациенту, но и имеет серьезные осложнения, сопряженные с летальными исходами. По данным литературы отмечается рост осложненных форм заболевания: частота желудочно-кишечных кровотечений в 2004 г. составила 10–15 %, перфораций — 6–20 %, пенетраций — 15 %, стеноз привратника и двенадцатиперстной кишки (ДПК) — 6–15 % [5, 10, 11, 14]. Таким образом, проблема оптимальной тактики лечения и реабилитации больных с язвенной болезнью еще далека от окончательного решения. Наши исследования показывают, что ЯБ может возникать уже в подростковом возрасте. Повышение эффективности диагностики и лечения язвенной болезни двенадцатиперстной кишки или дуоденальной язвы (ДЯ) у подростков остается одной из важнейших медицинских и социально-экономических проблем, так как у 60–80 % взрослых больных заболевания формируются в детском и юношеском возрасте.
Общепризнанными и практически однозначно трактуемыми в этиологии и патогенезе ЯБ в детском и подростковом возрасте являются наследственный, ацидопептический, нервно-психический и инфекционный (Helicobacter pylori — Нр) факторы. Уточнение состояния иммунной системы организма при ЯБ является предметом многочисленных исследований. С учетом того, что ЯБ представляет собой хроническое рецидивирующее заболевание, склонное к прогрессированию, все больше исследователей склоняются к признанию активной роли иммунных изменений в возникновении, поддержании и излечении заболевания [1, 3, 4, 7–9, 12, 13]. Особый интерес представляет изучение состояния местных факторов защиты при ЯБ. Местный иммунологический статус слизистой оболочки желудка определяется степенью инфильтрации макрофагами, гранулоцитами, лимфоидными клетками, количеством межэпителиальных лимфоцитов (МЭЛ) [4, 9].
Известно, что пубертатный период жизни, когда наблюдается повышение уровня распространенности заболеваний органов пищеварения, является критическим и в нарушении иммунологической реактивности. В это время резкий скачок роста ребенка сопровождается уменьшением массы лимфоидных органов, а индукция секреции половых гормонов приводит к угнетению клеточного и стимуляции гуморального звена иммунитета. Разнообразные гормональные нарушения, которые возникают у подростков, могут влиять на процессы иммунологической защиты, обусловливая особенности течения хронических процессов желудочно-кишечного тракта.
Целью нашего исследования было изучение состояния неспецифических и специфических факторов защиты у подростков с дуоденальной язвой.
Под наблюдением находились 235 подростков с ДЯ (136 юношей и 99 девушек). Контрольную группу составили 33 подростка в возрасте 15–18 лет (16 юношей и 17 девушек). Диагноз верифицирован на основании клинико-анамнестического, эндоскопического обследования, рН-метрии, выявления наличия инфекции Hp. Иммунологическую реактивность оценивали: по содержанию Т-лимфоцитов по методу A. Jondal, субпопуляции Т-лимфоцитов по методу S. Limatibul, содержанию В-лимфоцитов по методу W. Mendes, уровню иммуноглобулинов классов А, М, G по методу Manchini, уровню циркулирующих иммунных комплексов по методу V. Haskova в модификации Ю.А. Гиневича. Уровень цитокинов интерлейкина (ИЛ)-1β, ИЛ-4, ИЛ-6 и фактора некроза опухоли (ФНО) α в сыворотке крови определяли при помощи стандартных наборов для иммуноферментного анализа «Протеиновый контур», Санкт-Петербург, Россия. Морфологическое и иммуногистохимическое исследование слизистой оболочки желудка (СОЖ) и двенадцатиперстной кишки (СОДК) было проведено на кафедре патологической анатомии Харьковского национального медицинского университета по стандартным методикам. Иммуногистохимическое исследование проводили непрямым методом Кунса по методике Brosman. Клетки-продуценты цитокинов дифференцировали с помощью моноклональных антител к ИЛ-1β, ИЛ-4, ИЛ-6, ФНО-α (Chemicon, USA). Полученные данные сравнивали с таковыми у подростков с хроническим гастродуоденитом.
Результаты и обсуждение
Определение показателей иммунологической реактивности у подростков с эрозивно-язвенными поражениями желудка и двенадцатиперстной кишки в период обострения заболевания выявило угнетение Т-клеточного звена иммунитета и напряжение гуморального. Это проявилось снижением абсолютного и относительного числа Т-лимфоцитов (Т-лимф. абс., × 109: у юношей — 0,65 ± 0,08, в контроле — 0,91 ± 0,04, р < 0,05, у девушек — 0,75 ± 0,18, в контроле — 0,93 ± 0,04, р > 0,05; Т-лимф., %: у юношей — 48,63 ± 3,26, в контроле — 58,1 ± 1,6, р < 0,05, у девушек — 44,01 ± 8,96, в контроле — 59,1 ± 1,6, р < 0,05), иммунорегуляторного индекса (у юношей — 2,23 ± 0,11, в контроле — 2,99 ± 0,65, р > 0,05, у девушек — 1,54 ± 0,09, в контроле — 3,01 ± 0,76, р < 0,05), тенденцией к снижению абсолютного и относительного числа В-лимфоцитов при повышении уровня иммуноглобулинов и ЦИК (ЦИК у юношей — 95,73 ± 0,07 усл.ед., в контроле — 75,1 ± 2,5 усл.ед., р < 0,05, у девушек — 100,78 ± 17,55 усл.ед., в контроле — 78,1 ± 2,5 усл.ед., р > 0,05). Закономерным было выявление более значимых изменений в иммунограмме у больных с ДЯ, инфицированных Нр, при нормальной кислотности желудочного сока и при большей длительности заболевания. Напряжение гуморального звена иммунной системы при ДЯ характеризовалось повышением содержания IgА (2,34 ± 0,19 г/л, контроль — 1,92 ± 0,20 г/л, р < 0,05). Существующий у подростков с ДЯ иммунологический дисбаланс способствовал хронизации патологического процесса, отягощал течение и прогноз. С другой стороны, прогрессирование ЯБ истощало адаптационные системы организма и приводило к развитию вторичной иммунологической недостаточности.
Выявленные рутинными методами изменения в иммунограмме едва достигли статистически значимого уровня достоверности, поэтому было оправданным исследование содержания цитокинов — первичных медиаторов патологических процессов и регуляторов иммунологической активности (результаты представлены в табл. 1).
У всех подростков с ДЯ в фазу обострения заболевания было выявлено достоверное в 1,5–2 раза увеличение в крови уровня провоспалительных цитокинов ИЛ-1β и ИЛ-6, а концентрация ИЛ-4 возросла в 5 раз. Содержание ФНО-α в крови юношей с ДЯ было снижено в 1,5 раза, а у девушек — в 5 раз.
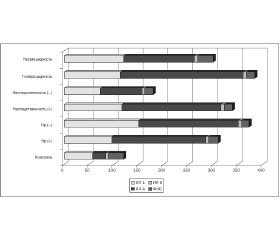
Анализ результатов исследования содержания цитокинов у юношей (рис. 1) выявил, что наиболее выражено их содержание изменялось у больных с Нр-негативной, наследственно отягощенной, протекающей с гиперацидностью ДЯ.
У девушек наибольшие изменения уровня цитокинов были выявлены при неотягощенной по ЯБ наследственности, Нр-негативной ДЯ, сопровождающейся нормальной кислотностью желудочного сока (рис. 2).
В фазу ремиссии ДЯ у девушек содержание изученных цитокинов (данные табл. 1), кроме концентрации ФНО-α, снижалось до контрольных показателей. У юношей уровень ИЛ-1β и ИЛ-6 имел только тенденцию к уменьшению, а содержание ИЛ-4, наоборот, повышалось до 208,51 ± 31,48 пкг/л, р < 0,05 по сравнению с фазой обострения. Такая динамика содержания цитокинов свидетельствовала о более благоприятном течении ДЯ у девушек. Рост уровня ИЛ-4 у юношей при ДЯ в стадию ремиссии заболеваний, по-видимому, способствовал еще большему угнетению клеточного звена иммунитета и потенцировал анафилактические реакции в СОЖ и СОДК. Это, возможно, объясняет прогредиентное течение деструктивных заболеваний верхних отделов пищеварительного тракта у лиц мужского пола.
Иммуногистохимическое исследование СОЖ и СОДК при ДЯ в подростковом возрасте выявило достоверное, по сравнению с хроническим гастродуоденитом, увеличение плотности инфильтрации СОЖ и СОДК клетками-продуцентами цитокинов (табл. 2). В СОДК были выявлены аналогичные качественные и количественные изменения характера клеточного инфильтрата, как и в СОЖ.
/72.jpg)
В отличие от большинства исследований у подростков с ДЯ нами было выявлено незначительное присутствие клеток-продуцентов ФНО-α в СОЖ, так как обычно их количество изменяется аналогично с числом клеток-продуцентов ИЛ-1β. Общепризнано, что эти цитокины продуцируются макрофагами и лимфоцитами и являются медиаторами воспалительного процесса. В то же время известно, что если основными клетками-продуцентами –ИЛ-1β являются активированные макрофаги и Th2, то ФНО-α — в основном макрофаги и Th1. В наших исследованиях повышена продукция ИЛ-1β и –ИЛ-4, что косвенно свидетельствует о том, что лимфоциты, инфильтрирующие СОЖ, относятся к Th2. Также известно, что кортизол способен блокировать рецепторы клеток-продуцентов ФНО-α, оставляя открытыми рецепторы к ИЛ-1β. Слабая плотность инфильтрации СОЖ клетками-продуцентами ФНО-α способствует низкому уровню апоптоза и потенцирует пролиферативные процессы. Это подтверждается наличием сильных положительных корреляционных связей между количеством клеток-продуцентов ФНО-α и индексом апоптоза (r = +0,8, р < 0,01).
Более чем в два раза в СОЖ увеличилось число МЭЛ: у юношей — 21,32 ± 0,31, у девушек — 21,00 ± 0,59, р > 0,05 (норма — 9,4 ± 1,4 на 100 эпителиоцитов). В поверхностном эпителии СОДК определялось большое число МЭЛ, окруженных ободками просветления: у юношей — 33,30 ± 0,42, у девушек — 34,30 ± 0,89, р > 0,05 (норма — 17,0 ± 1,8 на 100 эпителиоцитов). Это подтверждает участие местной иммунной системы в ульцергенезе и, возможно, саногенезе, так как МЭЛ нередко выступают в роли естественных киллеров и подавляют синтез иммуноглобулинов. Достоверных различий в количестве МЭЛ в зависимости от инфицированности Нр, наследственного фактора и кислотности желудочного сока выявлено не было.
Анализ коэффициентов парной корреляции между содержанием цитокинов в крови и данными иммуногистохимического исследования выявил потенцирующее влияние ИЛ-1β и ИЛ-6 на высоту эпителия СОЖ и СОДК и степень инфильтрации клетками-продуцентами ИЛ-1β и ИЛ-6 (r = +0,44, р < 0,05, для юношей — r = +0,53, р < 0,05, для девушек — r = +0,7, р < 0,05). Повышение уровня ИЛ-4 коррелировало с увеличением количества клеток-продуцентов ИЛ-4 (для юношей — r = +0,44, р < 0,05, для девушек — r = +0,53, р < 0,05). Противовоспалительный эффект ИЛ-4 проявился наличием отрицательной корреляционной связи с количеством клеток-продуцентов ИЛ-1β и ИЛ-6 в СОЖ и СОДК (для юношей — r = –0,44, р < 0,05, для девушек — r = –0,53, р < 0,05).
Выводы
1. В подростковом возрасте язвенная болезнь двенадцатиперстной кишки формируется и протекает на фоне выраженного угнетения клеточных иммунных реакций, напряжения гуморальных реакций иммунной системы и дисбаланса цитокинов, который является отражением нарушений в регуляции механизмов иммунного ответа.
2. Уровень цитокинов в сыворотке крови коррелирует со степенью инфильтрации СОЖ и СОДК цитокин-продуцирующими клетками, которая характеризуется высокой плотностью инфильтрации СОЖ и СОДК клетками-продуцентами ИЛ-1β, –ИЛ-4, ИЛ-6 и незначительной — клетками-продуцентами ФНО-α.
3. Выявленные у подростков с дуоденальной язвой общие иммунологические нарушения и местные воспалительные изменения в слизистой оболочке желудка и двенадцатиперстной кишки необходимо учитывать при проведении реабилитационных мероприятий.
Список литературы
1. Бабаева А.Р. Цитокиновая регуляция функциональных заболеваний желудочно-кишечного тракта / А.Р. Бабаева, О.Н. Родионова, Р.В. Видикер // Вестн. новых мед. технологий. — 2011. — Т. 18, № 1. — С. 163-164.
2. Бейлина Н.И. Оптимизация оказания медицинской помощи обучающейся молодежи с эрозивно-язвенными заболеваниями гастродуоденальной зоны в условиях городской студенческой поликлиники: Автореф. дис... канд. мед. наук: 14.01.04 / Н.И. Бейлина. — Казань, 2013. — 21 с.
3. Ильинцева Н.В. Гуморальный и секреторный иммунный ответ к Helicobacter pylori у детей с хроническими воспалительными заболеваниями желудка и двенадцатиперстной кишки: Автореф. дис… канд. мед. наук: 14.03.09 / Н.В. Ильинцева. — М., 2011. — 23 с.
4. Курамшина О.А. Клинико-патогенетические особенности формирования и течения язвенной болезни двенадцатиперстной кишки у лиц молодого возраста: Автореф. дис… д-ра мед. наук: 14.01.04 / О.А. Курамшина. — Уфа, 2014. — 37 с.
5. Лебедев Н.В. Язвенные гастродуоденальные кровотечения / Н.В. Лебедев, А.Е. Климов. — М.: Бином, 2010. — 176 с.
6. Лобанков В.М. Язвенная болезнь: концепция популяционной тяжести // Вестн. хир. гастроэнтерол. — 2009. — № 1. — С. 19-25.
7. Уровень сывороточных цитокинов детей, инфицированных различными штаммами Helicobacter pylori / О.В. Решетников, С.А. Курилович, Н.А. Вараксин и др. // Эксперим. и клин. гастроэнтерология. — 2010. — № 9. — С. 52-54.
8. Царегородцева Т.М., Серова Т.И. Цитокины в гастроэнтерологии. — Москва, 2003. — 96 с.
9. Циммерман Я.С. Проблема этиологии и патогенеза язвенной болезни: перечитывая В.Х. Василенко / Я.С. Циммерман // Клин. медицина. — 2011. — № 1. — С. 14-19.
10. Bardhan K.D. Time, change and peptic ulcer disease in Rotherham, UK / K.D. Bardhan, C. Royston // Dig. Liver Dis. — 2008. — Vol. 40, № 7. — P. 540-6.
11. David J. Bjorkman. Prevalence of Idiopathic PUD in a Developed Country // David J. Bjorkman. Aliment Pharmacol Ther. — 2013 Oct. — 38. — 946.
12. Karen van Rensburg. Acid suppressants and peptic ulcer di–sease // SAPJ. — April 2010. — Р. 33-37, indd 33.
13. New immunological investigations on Helicobacter pylori-induced gastric ulcer in patients / H.R. Rahimi, M. Rasouli, A. Jamshidzadeh et al. // Microbiol. Immunol. — 2013. — Vol. 57, № 6. — P. 455-62.
14. Perforated peptic ulcer: how to improve outcome? / M.H. Moller, S. Adamsen, M. Wojdemann, A.M. Moller // Scand. J. Gastroenterol. — 2009. — Vol. 44, №1. — P. 15-22.
15. Wang Y.R., Richter J.E., Dempsey D.T. Trends and outcomes of hospitalizations for peptic ulcer disease in the United States, 1993 to 2006 // Y.R. Wang, J.E. Richter, D.T. Dempsey Ann. Surg. — 2010. — Vol. 251, № 1. — P. 51-58.

/71.jpg)
/71_2.jpg)
/72_2.jpg)
/72.jpg)