Статья опубликована на с. 48-53
Ишемическая болезнь сердца остается основной причиной смертности в Украине, составляя более 60 % [2]. Поэтому оптимизация диагностики, в том числе и на догоспитальном этапе, дает возможность улучшить прогноз для больных с острой коронарной патологией [5–7]. В этом плане перспективным является использование в первые часы инфаркта миокарда (ИМ) усовершенствованного метода векторкардиографии (ВКГ), позволяющего у постели больного проводить векторный анализ электродвижущей силы (ЭДС) сердца и получать дополнительно к электрокардиографическому (ЭКГ) исследованию не только информацию о зоне повреждения миокарда, но и качественную и количественную характеристику биопотенциалов сердца вне области поражения [1].
Цель работы — изучить векторкардиографические признаки острого обширного инфаркта миокарда с зубцом Q передней стенки левого желудочка.
Материалы и методы
В условиях инфарктного отделения Луганской городской клинической многопрофильной больницы № 1 обследовано 149 больных с острым ИМ левого желудочка (ЛЖ). Для реализации цели в исследование включены 14 больных с первичным обширным ИМ передней стенки ЛЖ. Среди них — 8 женщин и 6 мужчин в возрасте от 54 до 80 лет. Средний возраст составил 68 ± 2 года. Больные госпитализированы в первые 24 часа от начала заболевания. В исследование не включали лиц с повторным и не-Q-ИМ, полной блокадой левой ножки пучка Гиса, поступивших в более поздние сроки, с органическими поражениями клапанов и острой левожелудочковой недостаточностью III–IV класса по Killip — Kimbal. Диагноз ИМ ЛЖ был установлен в соответствии с рекомендациями Европейского общества кардиологов [8] по клиническим данным, результатам ЭКГ в динамике и оценке биохимических маркеров некроза миокарда.
Инструментальное исследование включало ЭКГ и ВКГ. Электрокардиографически регистрировались стандартные, усиленные однополюсные и грудные отведения, а также по Небу. Векторкардиографически фиксировались петли Р, QRS и Т в системе координат в пяти проекциях (ВА1–5) с последующим анализом вращения петель в соответствии с ходом часовой стрелки, направления главного вектора, вида трассы, величины максимального вектора, площади, скорости распространения импульса по трассе петель Р, QRS и Т, углового расхождения петель QRS-Т и QRS-Р, наличия размыкания петель QRS и Т, а также направления вектора ST. Исследование ЭДС сердца проводилось на кардиодиагностическом многофункциональном комплексе МТМ-СКМ Северодонецкого научно-производственного предприятия «Микротерм» (свидетельство о государственной регистрации № 2375/2003, регистрационный № 19081403 от 26 декабря 2003 г.).
С целью анализа у больных величин ВКГ мы сравнивали их с таковыми референтной группы, в которую вошли 15 фактически здоровых мужчин и 5 женщин [1].
Статистическую обработку результатов исследования проводили с помощью компьютерной программы Statistica 6.1. При анализе результатов использовали критерий Шапиро — Уилка для проверки нормальности распределения случайной величины, параметрический t-критерий и непараметрический U-критерий Манна — Уитни для сравнения двух независимых выборок, критерий Стьюдента для определения возможных пределов ошибок (в виде M ± m, где M — среднее значение показателя, m — стандартная ошибка среднего показателя).
Результаты и их обсуждение
При госпитализации в 92,3 % случаев (13 человек) клинические проявления ИМ были типичными. Больные предъявляли жалобы на выраженные давящие или пекущие боли за грудиной длительностью не менее 30 минут. И лишь у одного больного отмечалась боль средней интенсивности в прекардиальной области с иррадиацией в левую руку.
У всех больных была диагностирована острая левожелудочковая недостаточность II класса по Killip — Kimbal. Из сопутствующей патологии у 3 больных была выявлена гипертоническая болезнь I стадии, у 9 — II стадии.
В 50 % случаев был проведен биохимический анализ крови на тропонин I. Содержание кардиоспецифического белка составило 7,24 ± 1,14 нг/мл (при норме 0–0,5 нг/мл), что подтверждало наличие некроза миокарда.
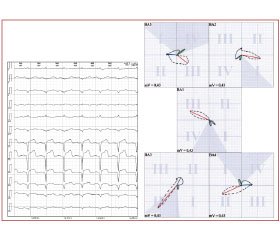
На ЭКГ у всех больных определялась элевация сегмента ST более 2 мм в грудных отведениях с V1 по V5(6) и Anterior по Небу с реципрокными изменениями в III, avF и Dorsalis по Небу в виде депрессии сегмента ST и появления высокого положительного зубца Т (9 больных — 64,3 %) . В V1–3 уже при поступлении у всех больных был сформирован комплекс QS. При этом невозможно было достоверно определить глубину поражения миокарда (трансмуральный или нетрансмуральный), что обусловлено близостью прилежания стенки желудочка в этой области к грудным электродам, расположенным на передней грудной стенке, и поэтому даже при сохранности части мышечных волокон этой зоны ее ЭДС не регистрировалась [3]. Кроме того, в половине случаев визуализировался комплекс QS и в левых грудных отведениях, что указывало на трансмуральность процесса. У остальных больных отмечалось выраженное снижение амплитуды зубца R в отведениях V4–6 (рис. 1).
/49.jpg)
При ИМ данной локализации пораженный мио–кард не участвует в генерировании нормальной ЭДС. Поэтому противоположно направленные электрические силы здоровых участков, оказавшись несбалансированными, «перетягивают» петлю QRS в противоположную сторону от очага поражения. Эти изменения наглядно демонстрирует векторная ЭКГ. Так, обширный ИМ передней стенки проявлялся пространственным перемещением не только начальной, но и нисходящей части петли QRS вправо, назад и вниз в 71,4 % случаев (10 человек) и вниз с начинающимся смещением вправо и назад у 4 больных (28,6 %), что указывает на значительную распространенность очага поражения.
Векторный анализ ЭДС сердца обладает большей чувствительностью по сравнению с ЭКГ, так как позволяет с высокой степенью достоверности определять глубину поражения миокарда. Так, у 50 % больных вся петля QRS в первой проекции и ее начальная часть — во второй расположены в верхней половине системы координат, что эквивалентно трансмуральному поражению передней стенки ЛЖ [4]. У остальных больных выявлено повреждение части стенки ЛЖ, что подтверждается размещением в нижней половине системы координат всей петли QRS в ВА1 (21,4 % случаев) и в ВА2 (50 % случаев), а также ее начальной части с переходом в верхнюю половину системы координат в 28,6 % случаев в первой проекции.
У всех больных выявлены признаки местной внутрижелудочковой блокады. Так, в ВА1, 4 изменялось направление записи петли QRS по и против часовой стрелки соответственно. В третьей проекции в связи с отсутствием вектора начального отклонения петля QRS начиналась в IV квадранте. У 21,4 % больных регистрировались перекресты петель QRS с образованием истинных узлов во всех проекциях. Кроме того, по всей трассе петель QRS в ВА1, 2, 4, 5 и на ее начальной части в третьей проекции наблюдалось сгущение отметок времени в 1,4–2,1 раза (р < 0,01–0,001) как отражение нарушения проводимости в зоне поражения миокарда (табл. 1).
/50.jpg)
В связи со снижением генерирования ЭДС при развитии некроза значительно уменьшилась суммарная площадь петель QRS (в 2,5 раза) за счет всех проекций: в первой — в 4,5 раза (р < 0,001) и в остальных — в 2,2 раза (р < 0,01–0,001) с одновременным укорочением величины максимального вектора петель QRS в первой, четвертой и пятой проекциях (в 1,7–1,8 раза (р < 0,01–0,001)). Появилась незамкнутость петель QRS, обусловленная смещением интервала ST на ЭКГ вверх от изолинии: в ВА1 — 0,48 ± 0,11 мм, в ВА2 — 1,05 ± 0,11 мм, в ВА3 — 1,07 ± 0,10 мм, в ВА4 — 1,76 ± 0,21 мм и в ВА5 — 1,61 ± 0,23 мм. При этом вектор ST ориентирован от отрицательно заряженных здоровых участков миокарда в сторону очага поражения вверх и вправо. Нарушение поздней реполяризации заключается в нарушении пространственного расположения и фазовых характеристик петель Т. Петли Т выходили за пределы петель QRS у всех больных с увеличением углового расхождения петель QRS-Т в ВА1, 4, 5 до 15 раз (р < 0,001). Наблюдалось увеличение площади петель Т во второй, третьей, четвертой и пятой проекциях в 2,2–3,3 раза (р < 0,01–0,001) при укорочении их максимального вектора в ВА1, 3–5 в 1,7–1,9 раза (р < 0,05–0,001) вследствие округления петель (табл. 2).
/51.jpg)
Кроме этого, скоростные показатели петель Т во всех проекциях имели разнонаправленные значения (р < 0,001), что может быть обусловлено электрической негомогенностью миокарда (табл. 3).
В пятой проекции отмечено разряжение отметок времени в области вектора конечного отклонения (p < 0,01), что эквивалентно увеличению скорости распространения возбуждения и может указывать на перегрузку миокарда базальных отделов желудочков (табл. 1).
Предсердия также испытывают повышенную нагрузку, что определялось увеличением площади петель Р в первых трех проекциях в 2–2,8 раза (p < 0,01) и возрастанием их максимального вектора в четвертой и пятой проекциях в 1,4–1,7 раза (р < 0,05–0,001) на фоне удлинения петель (табл. 1) и увеличения скоростных показателей (р < 0,001) во всех проекциях (табл. 4).
При этом нарушение процессов реполяризации в передней стенке предсердий, а также в заднебоковой стенке левого предсердия и задней стенке правого предсердия подтверждается увеличением углового расхождения петель QRS-Р в ВА1, 4, 5 и уменьшением — в ВА3 (p < 0,001) (табл. 1).
Следовательно, изменение биопотенциалов сердца при остром обширном ИМ передней стенки ЛЖ векторкардиографически характеризуется смещением петель QRS вправо, назад и вниз; уменьшением суммарной площади петель QRS за счет всех проекций; локальной внутрижелудочковой блокадой; появлением вектора повреждения ST, направленного вверх и вправо; нарушением процессов поздней реполяризации в виде нарушения пространственной ориентации и фазовых величин петель Т. При этом векторный анализ позволил не только подтвердить наличие некроза миокарда, но и уточнить трансмуральность его повреждения в дополнение к ЭКГ-методу. Кроме того, при ВКГ-исследовании выявлена компенсаторная гемодинамическая перегрузка отделов сердца, находящихся за пределами ишемизированного миокарда.
Выводы
1. Острый обширный инфаркт миокарда передней стенки ЛЖ векторкардиографически проявляется смещением петель QRS (вправо, назад и вниз) при уменьшении их суммарной площади (в 2,5 раза; р < 0,01–0,001), нарушением проводимости в виде изменения направления записи петель QRS в первой и четвертой проекциях, отсутствием вектора начального отклонения в третьей проекции, перекрестами петель со сгущением отметок времени на их трассе во всех проекциях (в 1,4–2,1 раза; р < 0,01–0,001).
2. При остром обширном инфаркте миокарда передней стенки левого желудочка на трансмуральность поражения указывает расположение в верхней половине системы координат всей петли QRS в первой проекции и ее начальной части во второй проекции. Нетрансмуральность повреждения подтверждается размещением в нижней половине системы координат всей петли QRS в ВА1 (21,4 %) и в ВА2 (50 %), а также ее начальной части с переходом в верхнюю половину системы координат в первой проекции (28,6 %).
3. Нарушение процессов реполяризации при остром передне-перегородочно-боковом инфаркте миокарда характеризуется появлением вектора повреждения ST (направленного вверх и вправо), расположением петель Т вне петель QRS с увеличением углового расхождения петель QRS-Т в ВА1, 4, 5 (до 15 раз; р < 0,001), увеличением площади петель Т в ВА2–5 (в 2,2–3,3 раза; р < 0,01–0,001) при укорочении их максимального вектора в ВА1, 3–5 (в 1,7–1,9 раза; р < 0,05–0,001) и разнонаправленными значениями скоростных показателей петель Т во всех проекциях (р < 0,001).
4. При остром обширном переднем инфаркте миокарда вне зоны некроза регистрируются разряжение отметок времени в области вектора конечного отклонения петель QRS и увеличение углового расхождения петель QRS-Т (в 7,1 раза; р < 0,001) в пятой проекции, увеличение площади предсердных петель Р в первых трех проекциях (в 2–2,8 раза; p < 0,01) и их максимального вектора в ВА4, 5 (в 1,4–1,7 раза; р < 0,05–0,001) при увеличении скоростных показателей во всех проекциях (р < 0,001) и углового расхождения петель QRS-Р в ВА1, 4, 5 и при уменьшении — в ВА3 (p < 0,001), что указывает на гемодинамическую перегрузку базальных отделов желудочков и предсердий с нарушением процессов реполяризации в них.

/49.jpg)
/50.jpg)
/51.jpg)
/52.jpg)