Статья опубликована на с. 119-124
В современной медицинской практике большое место занимают заболевания, требующие проведения инфузионной терапии с целью нормализации водно-солевого баланса и осуществления полного или частичного парентерального питания. В этой связи внимание врачей всегда привлекает появление на фармацевтическом рынке новых инфузионных сред, способных существенно улучшить качество лечения больных.
Учитывая актуальность темы, мы бы хотели посвятить настоящий обзор препарату Гликостерил®, содержащему в своем составе натрия хлорид, калия хлорид, кальция хлорид, магния хлорид (0,8; 0,0298; 0,0361; 0,0254 г в 100 мл соответственно) и фруктозу (5 или 10 г в 100 мл в составе препаратов Гликостерил® Ф5 или Гликостерил® Ф10 соответственно). Уникальной особенностью данного препарата является то, что вместо глюкозы в его состав входит фруктоза.
Хорошо известно, что при целом ряде острых состояний у пациентов возникает так называемая стресс-индуцированная гипергликемия, которая существенно ухудшает состояние больных и прогноз выздоровления (табл. 1).
Применение Гликостерила® при некоторых из них (тяжелый сепсис, септический шок, тяжелые ожоги, ожоговый шок и т.д.) позволяет устранить стресс-индуцированную гипергликемию и существенно улучшить клинические исходы. Более подробно результаты соответствующих исследований будут представлены ниже.
Полный спектр зарегистрированных показаний к применению Гликостерила® выглядит следующим образом:
— как средство для парциального парентерального питания при изо- и гипотонической дегидратации вследствие неукротимой рвоты, профузной диареи, кишечной непроходимости, при острой массивной кровопотере, ожогах, шоке, коллапсе;
— для компенсации потребности в углеводах, в том числе при сахарном диабете и других нарушениях утилизации глюкозы, при условии нормального кислотно-щелочного равновесия крови либо смещении его в щелочную сторону.
Перспективные результаты исследований
При стресс-индуцированной гипергликемии
В исследование Л.В. Усенко и соавт. [1] было включено 48 пациентов с тяжелым сепсисом и септическим шоком в возрасте от 18 до 72 лет. Они были разделены на две группы. Первая группа получала кристаллоидные и коллоидные растворы в соответствии с протоколом многокомпонентной терапии сепсиса (The MUST Protocol). Вторая группа дополнительно к протоколу, но вместо эквивалентного объема кристаллоидов получала Гликостерил® Ф10 (суточная доза 12–14 мл/кг; первоначально струйное введение 50–60 мл, затем со скоростью 60–75 мл/ч).
Исходный уровень глюкозы в плазме крови у больных первой группы составил 10,98 ± 5,21 ммоль/л, у больных второй группы — 11,78 ± 4,10 ммоль/л.
В результате исследования был выявлен ряд метаболических изменений. На фоне введения Гликостерила® Ф10 было отмечено снижение уровня глюкозы в плазме крови до 6,18 ± 0,91 ммоль/л (p < 0,05). После начала инфузии данного препарата отмечалось резкое повышение содержания лактата и пирувата в плазме крови (на 34,6 и 218 % соответственно), с последующим снижением содержания лактата к 3-му часу наблюдения на 58,4 % от его максимальной концентрации при сохранении повышенной концентрации пирувата. Было выявлено также снижение дозы вводимого инсулина с 2,36 ЕД/ч (первая группа) до 1,14 ЕД/ч (группа с Гликостерилом® Ф10).
Одновременно в группе пациентов, получавших инфузионную терапию Гликостерилом® Ф10, было отмечено уменьшение выраженности системного воспалительного ответа (С-реактивный белок) и тяжести состояния пациентов (шкала APACHE II) (рис. 1, 2).
В конечном счете включение в состав инфузионной терапии Гликостерила® Ф10 приводило к снижению показателя летальности с 25 до 16 % и длительности лечения в отделении интенсивной терапии с 9,3 до 6,3 дня.
Авторы сообщают об отсутствии побочных эффектов при использовании Гликостерила® Ф10.
В исследование Е.Ю. Сорокиной и соавт. [2] было включено 20 пациентов с тяжелой ожоговой травмой, средний возраст составил 49,1 ± 14,0 года. При поступлении в отделение всем больным проводилась инфузионно-трансфузионная, респираторная, реологическая, антибактериальная терапия, инотропная поддержка и профилактика язв Курлинга. Со 2-х суток ожоговой болезни в состав инфузионной терапии включался Гликостерил® Ф10, вводимый внутривенно капельно в течение 2–3-х суток ожогового шока.
Гликостерил® Ф10 не вводили тяжело обож–женным пациентам с сопутствующим сахарным диабетом или с нескорригированной гипергликемией.
На фоне внутривенного введения Гликостерила® Ф10 функциональные расстройства дыхания не нарастали, происходила нормализация насыщения крови кислородом до 97–98 %, отмечалась дальнейшая стабилизация показателей гемодинамики. Это позволило предположить, что Гликостерил® Ф10 улучшает функцию миокарда, способствует улучшению вентиляционно-перфузионных отношений и перфузии тканей.
На фоне введения Гликостерила® Ф10 содержание глюкозы в плазме крови снижалось с 7,59 до 5,9 ммоль/л без дополнительного введения инсулина. Уменьшение выведения с мочой креатинина на 20,1 % свидетельствовало о снижении протеолиза скелетной мускулатуры. Содержание ионов К+ в плазме крови составило 4,7 ± 0,4 ммоль/л, сохранялась умеренная гипонатриемия (136,0 ± 3,6 ммоль/л), отмечалась тенденция к повышению уровня Mg2+ на 6,6 % от исходного уровня. Осмолярность плазмы крови поддерживалась в пределах физиологической нормы.
Авторами исследования был сделан вывод о том, что Гликостерил® Ф10, вводимый в состав инфузионно-трансфузионной терапии со вторых суток ожогового шока в комплексе с нутриционной поддержкой, способствует восполнению энергетических затрат и оптимизации углеводного обмена, снижает показатели катаболической реакции (протеолиз скелетной мускулатуры) организма пострадавшего на ожоговую травму.
При другой патологии
В исследование О.В. Кравца и соавт. [3] было включено 40 пациентов с острой тонкокишечной непроходимостью, средний возраст 42 ± 5 лет. Больные были распределены на две группы. В первую группу вошли 20 больных, которым до-, интра- и послеоперационную инфузионную терапию проводили рутинными кристаллоидами. Больным второй группы в состав интраоперационной инфузионной терапии включали Гликостерил® Ф10 в дозе 4–5 мл/кг.
Операцию (ликвидация спаечной кишечной непроходимости) выполняли под внутривенным программированным полинаркозом, средняя длительность операции составила 1,5 ± 0,6 ч.
Исходно при поступлении пациентов в отделение у них было выявлено наличие гипотонической дегидратации и метаболического гипохлоремического алкалоза (табл. 3).
Проведение стандартной инфузионной терапии устраняет явления метаболического алкалоза, однако не позволяет в полной мере устранить гипотоническую дегидратацию и восстановить до нормальных значений уровень электролитов в плазме крови. Применение Гликостерила® Ф10 позволяло достичь лучших результатов: были устранены явления метаболического алкалоза, в большей мере уменьшена гипотоническая дегидратация, уровень электролитов в плазме крови возвращался к норме.
Исследователи отметили, что инфузия Гликостерила® Ф10, несмотря на высокое содержание фруктозы в его составе, не вызывала повышения уровня глюкозы в плазме крови, что дает возможность применения этого раствора у больных сахарным диабетом.
Борьба с периоперационной гипотермией
Развитие периоперационной гипотермии связано с большим количеством побочных эффектов, включая патологию сердца, коагулопатию, инфекцию операционной раны, увеличение срока восстановления и срока госпитализации. Поэтому одна из задач анестезиологов сводится к тому, чтобы предотвратить развитие периоперационной гипотермии, за исключением тех особых случаев, когда она показана [4]. Пациенты могут стать гипотермичными на любом этапе периоперационного периода (предоперационная фаза, интраоперационная фаза, послеоперационная фаза) [5].
Развитие интраоперационной гипотермии изначально связано с внутренним перераспределением тепла тела, что обусловливает большую часть снижения температуры тела во время первого часа анестезии. В последующем гипотермия связана главным образом с тем, что потеря тепла превышает его метаболическую продукцию. У пациентов, которые стали достаточно гипотермичными, дальнейшее снижение температуры ядра тела ограничивается реактивацией терморегуляторной вазоконстрикции [4].
Для того чтобы оценить, способна ли фруктоза предотвращать развитие интраоперационной гипотермии, T. Mizobe и соавт. [4] включили в исследование 40 пациентов, которым предстояла открытая полостная операция. Пациенты были случайным образом распределены на две группы: первая группа (n = 20) получала инфузии фруктозы (0,5 г/кг/ч) в течение 4 ч (начало за 3 ч до индукции анестезии). Больные второй группы (n = 20) получали аналогичное количество физиологического раствора.
В результате исследования было выяснено, что спустя 3 ч после индукции анестезии температура ядра тела (измеренная в дистальных отделах пищевода) у больных первой группы составила 35,7 ± 0,4 °С, а у больных второй группы — 35,1 ± 0,4 °С (p = 0,001). Это свидетельствует о том, что предоперационная инфузия фруктозы помогает поддерживать нормотермию во время интраоперационного периода. Было также выяснено, что этот эффект достигается за счет усиления метаболической продукции тепла и повышения порога вазоконстрикции.
Механизмы влияния фруктозы на углеводный обмен
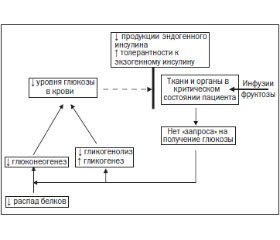
При развитии критических состояний (тяжелый сепсис, септический шок, тяжелые ожоги, ожоговый шок и т.д.) ткани и органы испытывают энергодефицит, вследствие чего посылают «запрос» на получение глюкозы (рис. 3). В результате в печени и мышцах активируется гликогенолиз (расщепление гликогена) с высвобождением глюкозы в плазму крови. Кроме того, в печени активируется глюконеогенез (образование глюкозы), субстратом для которого являются аминокислоты, высвобождающиеся при расщеплении белков, содержащихся в мышцах (больной худеет). Вновь образованная глюкоза также поступает в плазму крови. Трагедия же заключается в том, что в организме критически больных пациентов снижается продукция эндогенного инсулина и растет толерантность к экзогенному инсулину. Поэтому глюкоза не доставляется в ткани и органы, которые испытывают в ней сильную потребность, а накапливается в плазме крови, приводя к развитию стресс-индуцированной гипергликемии. Выше мы приводили результаты исследований, которые показывают, что данное состояние усугубляет течение и прогноз имеющегося заболевания.
Фруктоза, в отличие от глюкозы, не требует инсулина для поступления внутрь клеток. Поэтому сразу же после инфузии фруктоза поступает внутрь «голодающих» тканей и органов и вместо глюкозы включается в гликолиз, восполняя имеющийся энергодефицит (рис. 4).
Поскольку необходимость в глюкозе отпадает, перестает подаваться «запрос» на ее доставку. Вследствие этого и ряда других эффектов фруктоза угнетает гликогенолиз и глюконеогенез (мышцы больных перестают разрушаться из-за прекращения распада белков). Более того, происходит активация гликогенеза (синтеза гликогена). Все вместе это приводит к снижению содержания глюкозы в плазме крови, часто до нормального уровня, что устраняет стресс-индуцированную гипергликемию, облегчает тяжесть и улучшает прогноз имеющегося заболевания. Следует отметить, что фруктоза, проявляя свои положительные эффекты, не уменьшает инсулинорезистентность, напротив, она может даже усилить это состояние [6, 7].
Из вышеописанных механизмов следует также, что больным, находящимся в критических состояниях, для ликвидации энергодефицита тканей и органов более целесообразно производить внутривенные инфузии фруктозы, нежели глюкозы. В то время как фруктоза уменьшает выраженность стресс-индуцированной гипергликемии, глюкоза может ухудшить это состояние. Примером могут служить результаты исследования Y.P. Zhou и соавт. [8]. В проспективное рандомизированное двойное слепое исследование был включен 41 пациент с площадью ожога 10–30 % от общей поверхности тела и ожогами 3-й степени 1–10 % от общей поверхности тела. Они были разделены на две группы. Больным первой группы (n = 21) производили внутривенную инфузию 500 мл, 50 г/л фруктозы ежедневно в течение 3 дней после эскар–эктомии (удаление ожогового струпа). Больным второй группы (n = 20) в аналогичных условиях внутривенно вводили глюкозу.
В результате было выяснено, что во второй группе пациентов содержание глюкозы в плазме крови было увеличено в течение 3 дней после операции и достигало пика к 3-му дню (8,4 ± 3,5 ммоль/л), что было заметно выше, чем до введения глюкозы (6,4 ± 2,4 ммоль/л; p < 0,01). В первой группе подобное увеличение содержания глюкозы в плазме крови не отмечалось (p > 0,05).
Таким образом, внутривенное введение фруктозы, в отличие от глюкозы, не повышало содержание глюкозы в плазме крови в послеоперационном периоде у ожоговых больных.
Особенности применения Гликостерила®
Препарат не применяют при неконтролируемой гипергликемии, когда доза вводимого инсулина составляет ≥ 6 ЕД/ч.
Фруктоза, поступая в клетки и включаясь в гликолиз вместо глюкозы, может приводить к повышению содержания в плазме крови молочной кислоты (лактата). Поэтому препарат применяют лишь при нормальном кислотно-щелочном равновесии крови либо смещении его в щелочную сторону и не применяют при метаболическом ацидозе.
Следует помнить, что препарат способен усиливать образование мочевой кислоты, что может приводить к развитию гиперурикемии.
Препарат не применяют при гипертонической дегидратации, гипергидратации и гипокалиемии.
Гликостерил® не применяют у лиц с врожденной непереносимостью фруктозы, поскольку это может приводить к серьезным осложнениям у взрослых и детей, вплоть до летального исхода.
Препарат не применяют у детей в связи с отсутствием достаточного количества клинических исследований.
Выводы
В выполненных исследованиях была подтверждена высокая эффективность и хорошая переносимость Гликостерила® у пациентов в критических состояниях, протекающих со стресс-индуцированной гипергликемией или без нее. Это дает возможность рекомендовать Гликостерил® к более широкому применению в медицинской практике.
/121.jpg)

/120_2.jpg)
/120.jpg)
/121_2.jpg)
/123.jpg)